Mikrodissektion und Whole-Mount-Rasterelektronenmikroskopie Visualisierung des Aderhautplexus der Maus
Summary
Der Plexus choroideus (CP), ein in den Neurowissenschaften wenig erforschtes Gewebe, spielt eine Schlüsselrolle bei der Gesundheit und Erkrankung des zentralen Nervensystems. Dieses Protokoll beschreibt eine Mikrodissektionstechnik zur Isolierung des CP und die Verwendung von Rasterelektronenmikroskopie, um einen Gesamtüberblick über seine zelluläre Struktur zu erhalten.
Abstract
Der Plexus choroideus (CP), eine stark vaskularisierte Struktur, die in die Ventrikel des Gehirns hineinragt, ist eines der am wenigsten untersuchten Gewebe in den Neurowissenschaften. Da immer deutlicher wird, dass diese winzige Struktur eine entscheidende Rolle für die Gesundheit und Erkrankung des Zentralnervensystems (ZNS) spielt, ist es von größter Bedeutung, die CP aus den Hirnventrikeln so zu präparieren, dass eine nachgelagerte Verarbeitung von der funktionellen bis zur strukturellen Analyse möglich ist. Hier wird die Isolierung des lateralen und vierten Hirnventrikels der Maus beschrieben, ohne dass spezielle Werkzeuge oder Geräte erforderlich sind. Diese Isolationstechnik bewahrt die Lebensfähigkeit, Funktion und Struktur der Zellen innerhalb des CP. Aufgrund seiner hohen Vaskularisation kann der CP mit einem binokularen Mikroskop in den Ventrikelhöhlen des Gehirns schwebend dargestellt werden. Die transkardiale Perfusion, die für die nachgelagerte Analyse erforderlich ist, kann jedoch die Identifizierung des CP-Gewebes erschweren. Abhängig von den weiteren Verarbeitungsschritten (z.B. RNA- und Proteinanalyse) kann dies durch die Visualisierung des CP über transkardiale Perfusion mit Bromphenolblau gelöst werden. Nach der Isolierung kann der CP mit verschiedenen Techniken verarbeitet werden, darunter RNA-, Protein- oder Einzelzellanalysen, um weitere Erkenntnisse über die Funktion dieser speziellen Gehirnstruktur zu gewinnen. Hier wird die Rasterelektronenmikroskopie (REM) auf dem CP der ganzen Montierung eingesetzt, um einen Gesamtüberblick über die Struktur zu erhalten.
Introduction
Enge Barrieren trennen das zentrale Nervensystem (ZNS) von der Peripherie, einschließlich der Blut-Hirn-Schranke (BHS) und der Blut-Liquor-Schranke (Liquor). Diese Barrieren schützen das ZNS vor äußeren Beleidigungen und sorgen für eine ausgewogene und kontrollierte Mikroumgebung 1,2,3. Während die BHS im Laufe der Zeit ausgiebig untersucht wurde, hat die Blut-Liquor-Schranke am Plexus choroideus (CP) erst in den letzten zehn Jahren an Forschungsinteresse gewonnen. Diese letztere Barriere befindet sich in den vier Ventrikeln des Gehirns (Abbildung 1A, B) und ist gekennzeichnet durch eine einzelne Schicht von CPE-Zellen (Aderhautplexus-Epithelzellen), die ein zentrales Stroma, undichte Kapillaren, Fibroblasten und eine lymphatische und myeloische Zellpopulation umgeben (Abbildung 1C)4,5,6. Die CPE-Zellen sind durch Tight Junctions fest miteinander verbunden und verhindern so ein Austreten aus den darunter liegenden gefensterten Blutkapillaren in den Liquor und das Gehirn. Darüber hinaus wird der Transport durch die CPE-Zellen durch eine Reihe von ein- und ausgehenden Transportsystemen reguliert, die den Zustrom nützlicher Verbindungen (z. B. Nährstoffe und Hormone) aus dem Blut in den Liquor und den Ausfluss schädlicher Moleküle (z. B. Stoffwechselabfälle, überschüssige Neurotransmitter) in die andere Richtung steuern 1,6. Um ihre aktive Transportfunktion ausüben zu können, enthalten die CPE-Zellen zahlreiche Mitochondrien in ihrem Zytoplasma7. Darüber hinaus ist der CP die Hauptquelle für Liquor und fungiert durch das Vorhandensein residenter Entzündungszellen als Torwächter des Gehirns1. Aufgrund seiner einzigartigen Lage zwischen Blut und Gehirn ist der CP auch perfekt positioniert, um eine Immunüberwachung durchzuführen8.
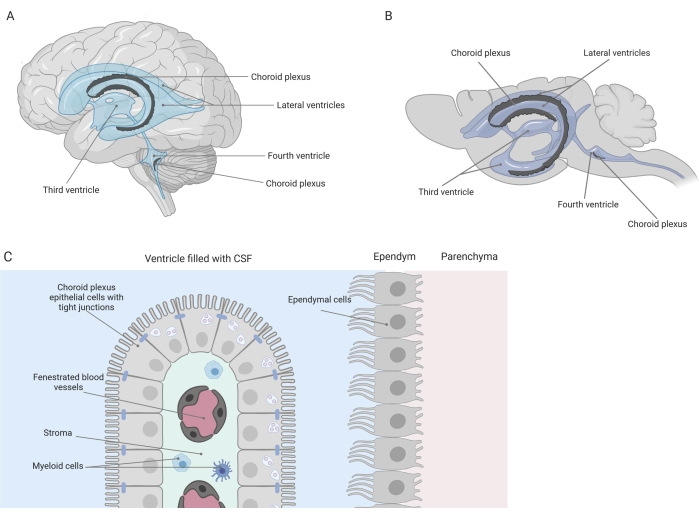
Abbildung 1: Schematische Übersicht über die Lage und Zusammensetzung des Plexus choroideus (CP). (A,B) CP-Gewebe befindet sich in den beiden lateralen, dem dritten und vierten Ventrikel von (A) menschlichen und (B) Mausgehirnen. (C) Das CP-Gewebe besteht aus einer einzigen Schicht eng verbundener quaderförmiger CP-Epithelzellen (CPE), die gefensterte Kapillaren, lockeres Bindegewebe sowie lymphatische und myeloische Zellen umgeben, und bildet die Blut-Liquor-Schranke (angepasst und modifiziert ab Referenz23). Figur erstellt mit Biorender.com. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
In den letzten zehn Jahren haben immer mehr Beweise, darunter mehrere Berichte unserer Forschungsgruppe, gezeigt, dass die CP eine zentrale Rolle bei Gesundheit und Krankheit spielt. 9,10,11,12,13,14,15,16,17,18 . So ist beispielsweise bekannt, dass die alternde Blut-Liquor-Schranke morphologische Veränderungen unter anderem in den Zellkernen, Mikrovilli und der Basalmembran aufweist 1,19. Darüber hinaus ist im Zusammenhang mit der Alzheimer-Krankheit die allgemeine Barriereintegrität beeinträchtigt und all diese altersbedingten Veränderungen scheinen noch ausgeprägter zu sein 1,8,20. Zusätzlich zu den morphologischen Veränderungen sind das Transkriptom, das Proteom und das Sekretom des CP während der Erkrankung verändert 12,21,22,23. Daher ist ein fortgeschrittenes Wissen über die CP unerlässlich, um ihre Rolle bei neurologischen Erkrankungen besser zu verstehen und möglicherweise neue therapeutische Strategien zu entwickeln.
Eine effiziente Methode zur genauen Mikrodissektion des CP aus den Hirnventrikeln ist der erste unschätzbare Schritt, um eine ordnungsgemäße Untersuchung dieser winzigen Gehirnstruktur zu ermöglichen. Aufgrund seiner stark vaskularisierten Beschaffenheit (Abbildung 2B) kann der CP, der in den Ventrikelhöhlen des Gehirns schwimmt, mit einem binokularen Mikroskop identifiziert werden. Für die nachgelagerte Analyse ist jedoch häufig eine transkardiale Perfusion erforderlich, was die korrekte Identifizierung und Isolierung des CP-Gewebes erschwert (Abbildung 2C). Wenn es die weiteren Verarbeitungsschritte zulassen (z.B. bei RNA- und Proteinanalysen), kann der CP über eine transkardiale Perfusion mit Bromphenolblau visualisiert werden (Abbildung 2A). Mehrere Veröffentlichungen beschreiben bereits die Isolierung des CP aus Rattengehirnen24 und Mäusewelpen25. In dieser Arbeit wird eine Mikrodissektions-Isolationstechnik beschrieben, um den CP aus erwachsenen Mäusen zu isolieren. Wichtig ist, dass diese Isolationstechnik die Lebensfähigkeit, Funktion und Struktur der Zellen innerhalb des CP bewahrt. Die Isolierung des im vierten und lateralen Ventrikel schwimmenden CP wird hier beschrieben. Kurz gesagt, die Mäuse werden unheilbar betäubt und bei Bedarf transkardiale Perfundierte durchgeführt. Es ist jedoch zu beachten, dass die Perfusion die Struktur der Zellen innerhalb des CP schädigen kann. Wenn die Probe mit Transmissionselektronenmikroskopie (TEM), serieller Blockflächen-Rasterelektronenmikroskopie (SBF-REM) oder fokussiertem Ionenstrahl-SEM (FIB-REM) analysiert werden soll, sollte daher keine Perfusion durchgeführt werden. Als nächstes wird das gesamte Gehirn isoliert und eine Zange verwendet, um das Gehirn sagittal zu halbisieren. Von hier aus können die in den Seitenventrikeln schwimmenden CPs identifiziert und präpariert werden, während die CPs aus dem vierten Ventrikel von der Kleinhirnseite des Gehirns isoliert werden können.
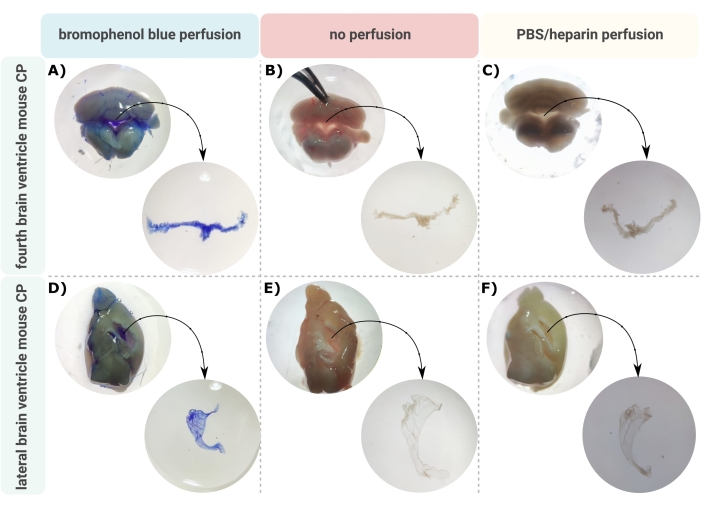
Abbildung 2: Darstellung des (A-C) vierten und (D-F) lateralen Ventrikelplexus choroideus (CP) nach (A,D)-Bromphenolblau-Perfusion, (B,E) keiner Perfusion und (C,F)-Perfusion mit PBS/Heparin. Die Bilder werden mit einem Stereomikroskop (8x-32-fache Vergrößerung) aufgenommen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Sobald der CP richtig aus den Hirnventrikeln herauspräpariert ist, kann ein ganzes Repertoire an Techniken angewendet werden, um die Funktion dieser Struktur besser zu verstehen. Beispielsweise kann eine Durchflusszytometrie oder Einzelzell-RNA-Sequenzierung durchgeführt werden, um die infiltrierenden Entzündungszellen unter bestimmten Krankheitsbedingungen zu quantifizieren und phänotypisch zu analysieren26,27. Zusätzlich zur zellulären Zusammensetzung kann die molekulare Zusammensetzung des CP analysiert werden, um das Vorhandensein von Zytokinen und Chemokinen über den Enzyme-linked Immunosorbent Assay (ELISA), Immunoblot oder durch gleichzeitige Analyse mehrerer Zytokine unter Verwendung des Zytokin-Bead-Arrays28 zu beurteilen. Darüber hinaus können Transkriptom-, Gefäß-, Immunzell-Histologie- und Sekretomanalysen an den mikropräparierten CP-Explantatendurchgeführt werden 29. Hier wird die Rasterelektronenmikroskopie (REM) am gesamten CP eingesetzt, um einen Gesamtüberblick über die CP-Struktur zu erhalten. Das REM verwendet einen Strahl fokussierter Elektronen, um die Oberfläche abzutasten und ein Bild der Topographie und Zusammensetzung der Oberfläche zu erstellen. Da die Wellenlänge von Elektronen viel kleiner ist als die von Licht, liegt die Auflösung des REM im Nanometerbereich und ist der eines Lichtmikroskops überlegen. Folglich können morphologische Untersuchungen auf subzellulärer Ebene mittels REM durchgeführt werden. Kurzzeitig wird das präparierte CP sofort in ein glutaraldehydhaltiges Fixiermittel für eine nächtliche Fixierung überführt, gefolgt von Osmication und Uranylacetat-Färbung. Die Proben werden dann mit Blei-Aspartat-Färbung behandelt, dehydriert und schließlich für die Bildgebung eingebettet.
Somit ermöglicht dieses Protokoll die effiziente Isolierung des CP aus den Hirnventrikeln der Maus, die mit einer Vielzahl von nachgeschalteten Techniken weiter analysiert werden können, um seine Struktur und Funktion zu untersuchen.
Protocol
Representative Results
Discussion
In dieser Arbeit wird eine Methode beschrieben, um den Plexus choroideus (CP) aus dem lateralen Ventrikel und dem vierten Ventrikel eines Mausgehirns zu isolieren. Diese gesamte Montagemethode des CP erleichtert die weitere Analyse unter Verwendung eines Repertoires von Techniken, um einen vollständigen Überblick über die CP-Morphologie, die zelluläre Zusammensetzung, das Transkriptom, das Proteom und das Sekretom zu erhalten. Solche Analysen sind entscheidend, um diese bemerkenswerte Struktur, die aus den Herzkammer…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Diese Arbeit wurde von der Belgischen Stiftung für Alzheimer-Forschung (SAO; Projektnummer: 20200032), der Forschungsstiftung Flandern (FWO Vlaanderen; Projektnummern: 1268823N, 11D0520N, 1195021N) und dem Baillet Latour Fund unterstützt. Wir danken dem VIB BioImaging Core für die Schulung, den Support und den Zugang zum Instrumentenpark.
Materials
| 26G x 1/2 needle | Henke Sass Wolf | 4710004512 | |
| Aluminium specimen mounts | EM Sciences | 75220 | |
| Cacodylate buffer | EM Sciences | 11652 | |
| Carbon steel surgial blades | Swann-Morton | 0210 | size: 0.45 mm x 12 mm |
| Carbon adhesive tabs -12 mm | EM Sciences | 77825-12 | |
| Critical point dryer | Bal-Tec | CPD030 | |
| Crossbeam 540 | Zeiss | SEM system | |
| Forceps | Fine Science Tools GmbH | 91197-00 | |
| Glutaraldehyde | EM Sciences | 16220 | |
| Heparin | Sigma-Aldrich | H-3125 | |
| Ismatec Reglo ICC Digital Peristaltic pump 2-channel | Metrohm Belgium N.V | CPA-7800160 | |
| Osmium Tetroxide | EM Sciences | 19170 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Phosphate buffered saline (PBS) | Lonza | BE17-516F | |
| Platinum | Quorum | Q150T ES | PBS without Ca++ Mg++ or phenol red; sterile filtered |
| Sodium pentobarbital | Kela NV | 514 | |
| Specimen Basket Stainless Steel | EM Sciences | 70190-01 | |
| Stemi DV4 Stereo microscope | Zeiss | ||
| Surgical scissors | Fine Science Tools GmbH | 91460-11 |
Riferimenti
- Vandenbroucke, R. E. A hidden epithelial barrier in the brain with a central role in regulating brain homeostasis. Implications for aging. Annals of the American Thoracic Society. 13, 407-410 (2016).
- Engelhardt, B., Sorokin, L. The blood-brain and the blood-cerebrospinal fluid barriers: function and dysfunction. Seminars in Immunopathology. 31 (4), 497-511 (2009).
- Engelhardt, B., Wolburg-Buchholz, K., Wolburg, H. Involvement of the choroid plexus in central nervous system inflammation. Microscopy Research and Technique. 52 (1), 112-129 (2001).
- Engelhardt, B., Vajkoczy, P., Weller, R. O. The movers and shapers in immune privilege of the CNS. Nature Immunology. 18 (2), 123-131 (2017).
- De Bock, M., et al. A new angle on blood-CNS interfaces: a role for connexins. FEBS Letters. 588 (8), 1259-1270 (2014).
- Strazielle, N., Ghersi-Egea, J. F. Physiology of blood-brain interfaces in relation to brain disposition of small compounds and macromolecules. Molecular Pharmaceutics. 10 (5), 1473-1491 (2013).
- Redzic, Z. B., Segal, M. B. The structure of the choroid plexus and the physiology of the choroid plexus epithelium. Advanced Drug Delivery Reviews. 56 (12), 1695-1716 (2004).
- Kratzer, I., Ek, J., Stolp, H. The molecular anatomy and functions of the choroid plexus in healthy and diseased brain. Biochimica et Biophysica Acta-Biomembranes. 1862 (11), 183430 (2020).
- Demeestere, D., Libert, C., Vandenbroucke, R. E. Clinical implications of leukocyte infiltration at the choroid plexus in (neuro)inflammatory disorders. Drug Discovery Today. 20 (8), 928-941 (2015).
- Brkic, M., et al. Amyloid βoligomers disrupt blood-CSF barrier integrity by activating matrix metalloproteinases. Journal of Neuroscience. 35 (37), 12766-12778 (2015).
- Vandenbroucke, R. E., et al. Matrix metalloprotease 8-dependent extracellular matrix cleavage at the blood-CSF barrier contributes to lethality during systemic inflammatory diseases. Journal of Neuroscience. 32 (29), 9805-9816 (2012).
- Marques, F., et al. The choroid plexus response to a repeated peripheral inflammatory stimulus. BMC Neuroscience. 10, 135 (2009).
- Marques, F., et al. The choroid plexus in health and in disease: dialogues into and out of the brain. Neurobiology of Disease. 107, 32-40 (2017).
- Lun, M. P., Monuki, E. S., Lehtinen, M. K. Development and functions of the choroid plexus-cerebrospinal fluid system. Nature Reviews Neuroscience. 16 (8), 445-457 (2015).
- Spector, R., Keep, R. F., Snodgrass, S. R., Smith, Q. R., Johanson, C. E. A balanced view of choroid plexus structure and function: Focus on adult humans. Experimental Neurology. 267, 78-86 (2015).
- Lehtinen, M. K., et al. The choroid plexus and cerebrospinal fluid: emerging roles in development, disease, and therapy. Journal of Neuroscience. 33 (45), 17553-17559 (2013).
- Balusu, S., Brkic, M., Libert, C., Vandenbroucke, R. E. The choroid plexus-cerebrospinal fluid interface in Alzheimer’s disease: more than just a barrier. Neural Regeneration Research. 11 (4), 534-537 (2016).
- Demeestere, D., Libert, C., Vandenbroucke, R. E. Therapeutic implications of the choroid plexus-cerebrospinal fluid interface in neuropsychiatric disorders. Brain, Behavior, and Immunity. 50, 1-13 (2015).
- Simon, M. J., Iliff, J. J. Regulation of cerebrospinal fluid (CSF) flow in neurodegenerative, neurovascular and neuroinflammatory disease. Biochimica et Biophysica Acta-Molecular Basis of Disease. 1862 (3), 442-451 (2016).
- Serot, J. M., Zmudka, J., Jouanny, P. A possible role for CSF turnover and choroid plexus in the pathogenesis of late onset Alzheimer’s disease. Journal of Alzheimer’s Disease. 30 (1), 17-26 (2012).
- Marques, F., et al. Altered iron metabolism is part of the choroid plexus response to peripheral inflammation. Endocrinology. 150 (6), 2822-2828 (2009).
- Thouvenot, E., et al. The proteomic analysis of mouse choroid plexus secretome reveals a high protein secretion capacity of choroidal epithelial cells. Proteomics. 6 (22), 5941-5952 (2006).
- Vandendriessche, C., et al. Importance of extracellular vesicle secretion at the blood-cerebrospinal fluid interface in the pathogenesis of Alzheimer’s disease. Acta Neuropathologica Communications. 9 (1), 143 (2021).
- Bowyer, J. F., et al. A visual description of the dissection of the cerebral surface vasculature and associated meninges and the choroid plexus from rat brain. Journal of Visualized Experiments. (69), e4285 (2012).
- Inoue, T., Narita, K., Nonami, Y., Nakamura, H., Takeda, S. Observation of the ciliary movement of choroid plexus epithelial cells ex vivo. Journal of Visualized Experiments. (101), e52991 (2015).
- Dani, N., et al. A cellular and spatial map of the choroid plexus across brain ventricles and ages. Cell. 184 (11), 3056-3074 (2021).
- Carloni, S., et al. Identification of a choroid plexus vascular barrier closing during intestinal inflammation. Science. 374 (6566), 439-448 (2021).
- Van Hoecke, L., et al. Involvement of the choroid plexus in the pathogenesis of Niemann-Pick disease type. C. Frontiers in Cell Neuroscience. 15, 757482 (2021).
- Shipley, F. B., et al. Tracking calcium dynamics and immune surveillance at the choroid plexus blood-cerebrospinal fluid interface. Neuron. 108 (4), 623-639 (2020).
- Guerin, C. J., Kremer, A., Borghgraef, P., Lippens, S. Targeted studies using serial block face and focused ion beam scan electron microscopy. Journal of Visualized Experiments. (150), e59480 (2019).
- JoVE. Scanning Electron Microscopy (SEM). JoVE Science Education Database. , (2022).
- Pauwels, M., et al. Choroid plexus derived extracelular vesicles exhibit brain targeting characteristics). Biomaterials. 290, 121830 (2022).

