एक ट्यूमर गोलाकार मॉडल में एंटीबॉडी पर निर्भर सेलुलर Cytotoxicity quantifying : दवा की खोज के लिए आवेदन
Summary
यहां, हम यौगिकों की पहचान करने के लिए एक विधि प्रस्तुत करते हैं जो एडीसीसी तंत्र को संशोधित करते हैं, एंटीट्यूमर एंटीबॉडी का एक महत्वपूर्ण कैंसर सेल-हत्या तंत्र। एनके कोशिकाओं के साइटोटोक्सिक प्रभाव को Trastuzumab की उपस्थिति में स्तन कैंसर सेल स्फेरॉइड में मापा जाता है। छवि विश्लेषण जीवित और मृत हत्यारे और स्फेरॉइड में लक्ष्य कोशिकाओं की पहचान करता है।
Abstract
ट्यूमर एंटीजन को लक्षित करने वाली मोनोक्लोनल एंटीबॉडी-आधारित इम्यूनोथेरेपी अब कैंसर उपचार का एक मुख्य आधार है। एंटीबॉडी की कार्रवाई के नैदानिक रूप से प्रासंगिक तंत्रों में से एक एंटीबॉडी-निर्भर सेलुलर साइटोटॉक्सिसिटी (एडीसीसी) है, जहां एंटीबॉडी कैंसर कोशिकाओं को बांधता है और ट्यूमर कोशिकाओं को मारने के लिए प्रतिरक्षा प्रणाली के सेलुलर घटक, जैसे, प्राकृतिक हत्यारा (एनके) कोशिकाओं को संलग्न करता है। इन उपचारों की प्रभावशीलता को सहायक यौगिकों की पहचान करके सुधार किया जा सकता है जो कैंसर कोशिकाओं की संवेदनशीलता या प्रतिरक्षा कोशिकाओं की शक्ति को बढ़ाते हैं। इसके अलावा, पिछली स्थितियों या कैंसर से जुड़े लक्षणों के लिए सह-औषधीय कैंसर रोगियों में अनदेखा दवा बातचीत एंटीबॉडी थेरेपी की सफलता निर्धारित कर सकती है; इसलिए, इस तरह की अवांछित दवा बातचीत को समाप्त करने की आवश्यकता है। इन लक्ष्यों को ध्यान में रखते हुए, हमने एक कैंसर एडीसीसी मॉडल बनाया और एडीसीसी-मॉड्यूलेटिंग दवाओं को खोजने के लिए यहां एक सरल प्रोटोकॉल का वर्णन किया। चूंकि कैंसर सेल स्फेरॉइड जैसे 3 डी मॉडल एंटीकैंसर थेरेपी के लिए ट्यूमर के विवो प्रतिक्रियाओं में भविष्यवाणी करने में 2 डी संस्कृतियों से बेहतर हैं, ईजीएफपी-व्यक्त एचईआर 2 + जेआईएमटी -1 स्तन कैंसर कोशिकाओं और एनके 92 के स्फेरॉइड सह-संस्कृतियां। सीडी 16 सेल लाइनों को स्थापित किया गया था और ट्रास्टुज़ुमाब के साथ प्रेरित किया गया था, जो एचईआर 2-पॉजिटिव स्तन कैंसर के खिलाफ नैदानिक रूप से अनुमोदित एक मोनोक्लोनल एंटीबॉडी है। JIMT-1 spheroids सेल से बचाने वाली क्रीम यू-नीचे 96 अच्छी तरह से प्लेटों में फार्म करने के लिए अनुमति दी गई थी. 3 दिन, एनके कोशिकाओं और Trastuzumab जोड़ा गया. स्फेरॉइड को तब एपोप्टोटिक सेल डेथ को मापने के लिए एनेक्सिन वी-एलेक्सा 647 के साथ दाग दिया गया था, जिसे स्वचालित माइक्रोस्कोप के साथ स्फेरॉइड के परिधीय क्षेत्र में मात्राबद्ध किया गया था। एडीसीसी-मॉड्यूलेटिंग अणुओं की पहचान करने के लिए हमारे परख की प्रयोज्यता को यह दिखाकर प्रदर्शित किया जाता है कि मेटास्टैटिक कैंसर के खिलाफ एफडीए द्वारा अनुमोदित एक रिसेप्टर टाइरोसिन किनसे अवरोधक, लगभग पूरी तरह से एडीसीसी को समाप्त कर देता है। स्फेरॉइड और छवि अधिग्रहण और विश्लेषण पाइपलाइनों की पीढ़ी कैंसर सेल स्फेरॉइड में एडीसीसी-मॉड्यूलेटिंग यौगिकों के लिए उच्च-थ्रूपुट स्क्रीनिंग के साथ संगत है।
Introduction
बहुकोशिकीय ट्यूमर स्फेरॉइड (एमसीटीएस) व्यापक रूप से तीन आयामी (3 डी) मॉडल का उपयोग किया जाता है जो कैंसर कोशिका जीव विज्ञान में यंत्रवत अंतर्दृष्टि प्राप्त करने के लिए एक महत्वपूर्ण उपकरण का प्रतिनिधित्व करने और प्रतिनिधित्व करने के लिए पक्षपाती कोशिकाओं की प्रवृत्ति के कारण बनते हैं। वे कई तकनीकों द्वारा सेल प्रकारों की एक विस्तृत श्रृंखला से उत्पन्न किया जा सकता है, जैसे तरल-आधारित और मचान-आधारित 3 डी संस्कृतियां1. मोनोलेयर 2 डी मॉडल पर उनका मुख्य लाभ यह है कि वे ट्यूमर कोशिकाओं के जैविक व्यवहार की नकल करके, अर्थात् संरचनात्मक संगठन और हाइपोक्सिया में विवो ट्यूमर की मुख्य विशेषताओं को पुन: व्यवस्थित करते हैं, विशेष रूप से चिकित्सीय पलायन और दवा प्रतिरोध2 के लिए अग्रणी तंत्र। इस प्रकार, चूंकि एमसीटीएस विषाक्तता और दवा संवेदनशीलता की भविष्यवाणी में सुधार कर सकता है, इसलिए वे व्यापक रूप से 3 डी में कैंसर का अध्ययन करने के लिए उपयोग किए जाते हैं और विभिन्न प्रकारके कैंसर के लिए प्रभावी दवाओं के विकास को बढ़ा सकते हैं।
किसी भी बीमारी का अध्ययन करने के लिए, प्रासंगिक और सुविधाजनक मॉडल की महत्वपूर्ण आवश्यकता है। कैंसर इम्यूनोलॉजी अध्ययन के लिए मॉडल स्थापित करना चुनौतीपूर्ण है क्योंकि प्रतिरक्षा प्रणाली में कई सेल प्रकार होते हैं। प्रत्येक सेल प्रकार में कई उपप्रकार और सक्रियण राज्यों का एक व्यापक स्पेक्ट्रम होता है। ये विभिन्न प्रतिरक्षा कोशिका प्रकार कैंसर कोशिकाओं और अन्य ट्यूमर घटकों के साथ बातचीत करते हैं, अंततः रोग के परिणाम को प्रभावित करते हैं। इन विट्रो सेल संस्कृति विधियों में 2 डी इन जटिल सेलुलर इंटरैक्शन recapitulate करने में विफल, के रूप में वे अनुवाद क्षमता की कमी है और सिस्टम स्तर (जैसे, ऊतकों में)4,5 पर एक दवा की कार्रवाई की भविष्यवाणी करने में असमर्थ हैं. इसके अलावा, माउस मॉडल भी मानव और murine प्रतिरक्षा प्रणाली के बीच मूलभूत अंतर के कारण गंभीर सीमाएं है. इसलिए, 3 डी संस्कृति प्रणाली उपलब्ध मॉडलों में मौजूदा अंतराल को भर सकती है, एक वैकल्पिक विधि प्रदान कर सकती है और कैंसर इम्यूनोलॉजी6 की हमारी समझ में सुधार कर सकती है। विशेष रूप से, अंडाकार आकृति मॉडल immunotherapies परीक्षण के लिए इस्तेमाल किया जा सकता है, मुख्य रूप से प्रतिरक्षा सेल घुसपैठ और अंडाकार आकृति लक्ष्य7 के खिलाफ विरोधी tumoral प्रभाव को बढ़ाने के लिए दवा स्क्रीनिंग और चिकित्सीय एंटीबॉडी की दक्षता का आकलन करने के लिए. इसके अलावा, स्ट्रोमा कोशिकाओं (जैसे, लिम्फोसाइट्स, मैक्रोफेज, फाइब्रोब्लास्ट्स) और कैंसर कोशिकाओं के बीच बातचीत का अध्ययन करने के लिए और नई एंटीकैंसर रणनीतियों के विकास के लिए विभिन्न चयापचय और प्रोलिफेरेटिव राज्यों में कोशिकाओं से बना एमसीटीएस की क्षमताका पर्याप्त प्रदर्शन किया गया है। इसलिए, ट्यूमर माइक्रोएन्वायरमेंट के पैथोफिज़ियोलॉजी को ध्यान में रखते हुए, दवा-परीक्षण प्रक्रिया को बढ़ावा देने के लिए भविष्य कहनेवाला और सटीक प्लेटफार्मों की पुष्टि करने की एक महत्वपूर्ण आवश्यकता है।
स्तन कैंसर (बीसी) महिलाओं में दुनिया भर में सबसे अधिक पाया जाने वाला कैंसर है। इस विषम बीमारी का नैदानिक वर्गीकरण ट्रांसमेम्ब्रेन रिसेप्टर्स की उपस्थिति पर आधारित है, उदाहरण के लिए, एस्ट्रोजन (ईआर) और प्रोजेस्टेरोन (पीआर) रिसेप्टर्स (सामूहिक रूप से हार्मोन रिसेप्टर्स, एचआर) के साथ-साथ मानव एपिडर्मल ग्रोथ फैक्टर रिसेप्टर 2 (एचईआर 2) प्रोटीन / ऑन्कोजीन के अतिअभिव्यक्ति या प्रवर्धन के साथ। इन रिसेप्टर्स की इम्यूनोहिस्टोकेमिकल अभिव्यक्ति के आधार पर, चार उपप्रकारों को आमतौर पर पहचाना जाता है: ल्यूमिनल ए (एचआर + / एचईआर 2-), ल्यूमिनल बी (एचआर + / एचईआर 2 +), एचईआर 2-पॉजिटिव (एचआर / एचईआर 2 +) और ट्रिपल-नकारात्मक स्तन कैंसर (एचआर / एचईआर 2-)। HER2+ समूह BC मामलों के 10-15% का गठन करता है और ER और PR की अनुपस्थिति के साथ उच्च HER2 अभिव्यक्ति की विशेषता है, ल्यूमिनल ट्यूमर की तुलना में बदतर रोग का निदान होता है, और HER2/neu प्रोटीन9 के खिलाफ निर्देशित विशिष्ट दवाओं की आवश्यकता होती है।
बीसी विकास एक बहु-चरण प्रक्रिया है, और रोग10 के सफल उपचार के लिए एक प्रारंभिक निदान आवश्यक है। हालांकि, हाल ही में उभरे व्यक्तिगत बीसी उपचार विकल्प (जैसे, अंतःस्रावी और एंटी-एचईआर 2 एंटीबॉडी थेरेपी) के बावजूद, बीसी ऑन्कोलॉजिस्ट को चुनौती देना जारी रखता है। बस सर्जरी की तरह, कीमोथेरेपी, और रेडियोथेरेपी, इन व्यक्तिगत उपचारों भी गंभीर प्रतिकूल प्रभाव हो सकता है और रोगियों को इन एजेंटों के प्रतिरोध विकसित कर सकते हैं, यह सबसे अच्छा रणनीति11,12 निर्धारित करने के लिए एक दीर्घकालिक चुनौती बनाने. इसलिए, ट्यूमर और उसके माइक्रोएन्वायरमेंट के बीच परस्पर क्रिया की बेहतर समझ आवश्यक है और उपन्यास उपचार के विकास के लिए नई दिशाएं प्रदान करने की उम्मीद है जो विभिन्न बीसी उपप्रकारों की विशिष्टताओं को ध्यान में रख रहे हैं13. इम्यूनोथेरेपी की एक नई लहर, जैसे एंटीबॉडी दवा संयुग्म, दत्तक टी-सेल थेरेपी, टीके और उपन्यास एचईआर 2-निर्देशित मोनोक्लोनल एंटीबॉडी (एमएबीएस) का अध्ययन एचईआर 2-व्यक्त ट्यूमर14 वाले रोगियों की एक व्यापक आबादी में किया जा रहा है।
उदाहरण के लिए, Trastuzumab, HER2+ BC के लिए एक कुशल उपचार पद्धति का प्रतिनिधित्व करता है। अपनी क्रिया के तरीके के हिस्से के रूप में, Trastuzumab टुकड़ा क्रिस्टलीकृत गामा रिसेप्टर (FcγR) -निर्भर गतिविधियों की मध्यस्थता करता है। FcγR Fc टुकड़े के लिए उनकी आत्मीयता और उनके द्वारा शुरू की गई प्रतिरक्षा प्रतिक्रिया से प्रतिष्ठित हैं। प्राकृतिक हत्यारा (एनके) कोशिकाओं पर FcγRIIIa (CD16A) को सक्रिय करना एंटीबॉडी-निर्भर सेलुलर साइटोटॉक्सिसिटी (ADCC) की मध्यस्थता के लिए महत्वपूर्ण है, जबकि मैक्रोफेज पर FcγRIIa (CD32A) और FcγRIIIa को ट्रिगर करना एंटीबॉडी-निर्भर सेलुलर फागोसाइटोसिस (ADCP)15को प्रेरित करता है। पशु मॉडल पर अध्ययन से पता चला है कि FcγRI की कमी चूहों (CD64) और FcγRIII (CD16) रिसेप्टर्स ट्यूमर-विशिष्ट एंटीजन के खिलाफ सुरक्षात्मक प्रतिरक्षा प्रतिक्रियाओं को शुरू करने में असमर्थ थे, जिससे पता चलता है कि ADCC संभवतः mAb Trastuzumab16 के लिए कार्रवाई का एक प्रमुख तंत्र है।
चूंकि एनके कोशिकाएं एडीसीसी द्वारा कैंसर सेल की हत्या के लिए ट्यूमर सेल-बाउंड एबीएस का सहारा लेती हैं, इसलिए एफसी रिसेप्टर्स की अभिव्यक्ति ट्रास्टुज़ुमाब17 (चित्रा 1)के साथ एक कुशल उपचार के लिए महत्वपूर्ण है। इसके अलावा, उनकी कार्रवाई कुशलता से सक्रिय और निरोधात्मक रिसेप्टर्स, जैसे, हत्यारा सेल immunoglobulin की तरह (केआईआर) रिसेप्टर्स18 की उत्तेजना द्वारा संतुलित है.
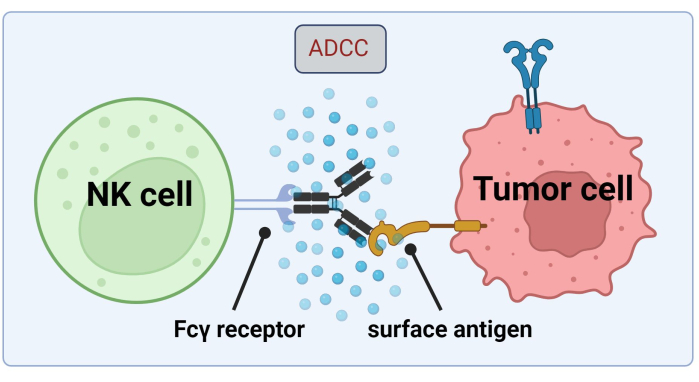
चित्र 1. एक एंटीट्यूमर प्रतिक्रिया के संदर्भ में एडीसीसी का तंत्र। एक प्राकृतिक हत्यारा (एनके) सेल का एफसीγ रिसेप्टर एक एंटीबॉडी के एफसी क्षेत्र को पहचानता है, जो पहले एक कैंसर सेल पर सतह एंटीजन से बंधा था। यह प्रतिरक्षाविज्ञानी अन्तर्ग्रथन एनके सेल के क्षरण की ओर जाता है जो ग्रैनजाइम और पेरफोरिन जैसे साइटोटोक्सिक मध्यस्थों को जारी करता है। ये अणु कोशिका झिल्ली में ताकना गठन में योगदान करते हैं और लक्ष्य कोशिका की क्रमादेशित कोशिका मृत्यु (Biorender.com के साथ बनाई गई छवि) के कारण एपोप्टोटिक मार्गों को सक्रिय करते हैं। कृपया इस चित्र का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.
HER2+ BC के लिए इम्यूनोथेरेपी विकास एक विकसित क्षेत्र का प्रतिनिधित्व करता है। इस मामले में, किसी को प्रतिरक्षा प्रणाली के विभिन्न घटकों के बीच बातचीत पर विचार करना चाहिए। इसके अलावा, पिछले प्रकाशनों बड़े पैमाने पर संयोजन चिकित्सा पारंपरिक के सभी प्रकार शामिल परीक्षण किया है, प्रतिरक्षा या सेल चिकित्सा synergizing संयोजन19 की पहचान करने के लिए.
HER2+ BC के कई 3D मॉडल पहले दवा की खोज के लिए उपयोग किए गए हैं। उदाहरण के लिए, Balalaeva एट अल SKBR-3 spheroids HER2 लक्षित immunotoxin 4D5scFv-PE4020 के cytotoxicity का आकलन करने के लिए HER2 overexpress इस्तेमाल किया. एक अन्य अध्ययन में, एक 3 डी Matrigel आधारित HER2 + बीसी संस्कृति प्रणाली Trastuzumab और अंतःस्रावी एजेंटों21 के जवाब में सेल वृद्धि को मापने के लिए स्थापित किया गया था. ये अध्ययन चिकित्सकीय चिकित्सीय प्रतिक्रियाओं22 में सुधार करने के लिए एक प्रभावी रणनीति का प्रतिनिधित्व करने में एचईआर 2 overexpress कैंसर कोशिकाओं के ट्यूमर अंडाकार मॉडल के महत्व पर प्रकाश डाला.
हमारे समूह ने पहले सुनिटिनिब, एक बहुलक्षित टाइरोसिन किनसे अवरोधक की पहचान की, जो 2 डी संस्कृति परख में JIMT-1 HER2+ BC कोशिकाओं में Trastuzumab-निर्भर ADCC के अवरोधक के रूप में था। अध्ययन से पता चला है कि Sunitinib autophagy लाती है और एनके कोशिकाओं की हत्या समारोह impairs, HER2 अभिव्यक्ति downregulation और JIMT-1 कोशिकाओं17 की सतह लगाव को बढ़ाने.
यहां हमने उच्च-थ्रूपुट स्क्रीनिंग अनुप्रयोगों के लिए उपयोग किए जाने वाले एक उपन्यास 3 डी, गोलाकार एडीसीसी मॉडल (एनके.92.सीडी 16 + ट्रास्टुज़ुमाब + जेआईएमटी-1-ईजीएफपी कैंसर कोशिकाओं) की स्थापना की और उपर्युक्त निष्कर्षों को मान्य करने के लिए, सुनीतिनिब का उपयोग एक मॉडल यौगिक के रूप में किया गया था। सबसे पहले, हम JIMT-1 कोशिकाओं17 व्यक्त EGFP उत्पन्न और इन कोशिकाओं से spheroids वृद्धि हुई. ADCC Trastuzumab के साथ एक साथ एनके कोशिकाओं द्वारा प्रेरित किया गया था, और spheroids उपस्थिति या 24 घंटे (चित्रा 2) के लिए परीक्षण यौगिकों की अनुपस्थिति में संस्कृति में रखा गया था. एडीसीसी की मात्रा का ठहराव एक उच्च-सामग्री विश्लेषण प्रणाली का उपयोग करके एपोप्टोटिक कैंसर कोशिका मृत्यु (एनेक्सिन वी धुंधला) का पता लगाने पर आधारित है।
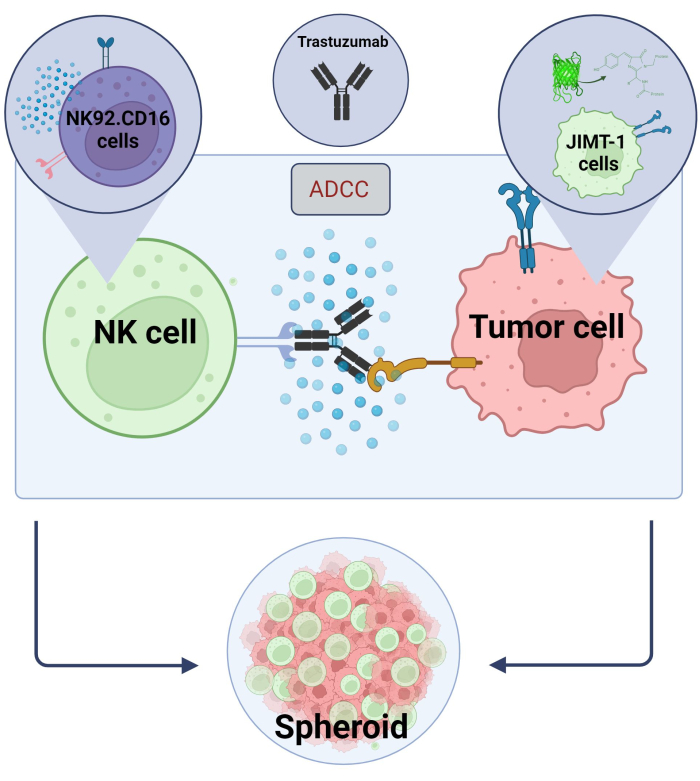
चित्र 2. एक 3 डी गोलाकार सह-संस्कृति प्रणाली में ADCC. हमारी प्रयोगात्मक सेटिंग्स एक 3 डी स्फेरॉइड प्रणाली पर आधारित हैं जो 2 डी मॉडल की तुलना में विवो माइक्रोएन्वायरमेंट में अधिक सटीक रूप से मॉडल कर सकती हैं। JIMT-1 EGFP स्तन कैंसर कोशिकाओं को एक गोल आकार के सेलुलर क्लस्टर बनाने के लिए अवतल कोशिका विकर्षक तल पर वरीयता दी गई थी, जिसे स्फेरॉइड कहा जाता है। ADCC को तब NK92 जोड़कर शुरू किया गया था। CD16 प्राकृतिक हत्यारा कोशिकाएं (E: T अनुपात = 20: 1) और एक एंटी-HER2 मोनोक्लोनल एंटीबॉडी, Trastuzumab। प्रयोगात्मक मॉडल एडीसीसी संशोधित परीक्षण यौगिकों (Biorender.com के साथ बनाई गई छवि) की पहचान के लिए कुशल और आसानी से लागू साबित हुआ है। कृपया इस चित्र का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.
हमने प्रदर्शित किया कि इस तरह से डेटा प्राप्त करना वास्तविक समय में किया जा सकता है और कैंसर की दवा की खोज में उच्च-सामग्री स्क्रीनिंग में उपयोग के लिए सांख्यिकीय रूप से मजबूत है। महत्वपूर्ण रूप से, यह मॉडल यौगिकों के एक बड़े सेट के विस्तारित सत्यापन की अनुमति देता है, और इसे ब्याज के कई परखों पर लागू किया जा सकता है।
Protocol
Representative Results
Discussion
पिछले कई दशकों में बीसी के इलाज में महत्वपूर्ण सुधार के बावजूद, रोगियों को अभी भी नियमित रूप से दवा प्रतिरोध विकसित या नकारात्मक पक्ष प्रभाव24. बीसी से जुड़ी उच्च रुग्णता और मृत्यु दर अंतर्निह?…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
LV को राष्ट्रीय अनुसंधान, विकास और नवाचार कार्यालय अनुदान GINOP-2.3.2-15-2016-00010 TUMORDNS”, GINOP-2.3.2-15-2016-00048-STAYALIVE, OTKA K132193 और K147482 से धन प्राप्त हुआ। इस परियोजना को एचयूएन-आरईएन हंगेरियन रिसर्च नेटवर्क से धन प्राप्त हुआ है। CD16.176V.NK-92 कोशिकाओं को ब्रिंक बायोलॉजिक्स, lnc की ओर से डॉ. केरी एस. कैंपबेल (फॉक्स चेस सेंटर, फिलाडेल्फिया, PA) से प्राप्त किया गया था। सैन डिएगो, सीए), दुनिया भर में पेटेंट द्वारा संरक्षित हैं, और नांटकवेस्ट, एलएनसी द्वारा लाइसेंस प्राप्त थे। (www.nantkwest.com)। लेखक NK-92 सेल लाइन और TR-F(ab’)2 के उपयोग और तकनीकी सलाह के लिए उनकी मदद के लिए György Vereb और Árpád Szöőr के आभारी हैं।
Materials
| 96-well glass bottom Cell Carrier Ultra microplates | PerkinElmer, Waltham, MA, USA | LLC 6055302 | for spheroids measurements |
| 96-well tissue culture plates | TPP | 92096 | for cell seeding |
| α-MEM medium | Sigma | M8042 | in NK medium |
| Agarose | Sigma | A9539 | for spheroids seeding |
| Annexin V-Alexa Fluo 647 conjugate | Invitrogen-ThermoFisher Scientific | A23204 | for apoptosis measurement with HCS |
| CD16.176 V.NK-92 cells | Dr. Kerry S. Campbell (the Fox Chase Cancer Center, Philadelphia, PA on behalf of Brink Biologics, Inc. San Diego, CA) | ATCC CRL-2407 | for cell culture |
| Cell Tracker Blue | Invitrogen-Thermo Scientific, Waltham, MA, USA) | C2110 | for staining of NK cells |
| DMEM/F-12 medium | Sigma | D8437 | in JIMT1-EGFP medium |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418 | for coating HCS plate before transfering the spheroids |
| Fetal bovine serum (FBS) | Biosera | FB-1090/500 | JIMT-1-EGFP and NK medium |
| Glutamine | Gibco | 35,050–061 | in NK medium |
| GraphPad Prism 8.0.1 | GraphPad Software Inc., San Diego, CA, USA | for statistical analysis | |
| Harmony software | PerkinElmer, Waltham, MA, USA | for HCA | |
| IL-2 | Proleukin, Novartis Hungária Kft., Budapest, Hungary | PHC0026 | in NK medium |
| Insulin (Humulin R) | Eli Lilly | HI0219 | JIMT-1-EGFP medium |
| JIMT-1 breast cancer cells | for cell culture | ||
| MEM Non-essential Amino Acids (MEM-NEAA) | Gibco | 11,140–050 | in NK medium |
| Na-pyruvate | Lonza | BE13-115E | in NK medium |
| Opera Phenix High-Content Analysis equipment | PerkinElmer, Waltham, MA, USA | HH14001000 | for HCA |
| PBS (Posphate buffered saline) | Lonza | BE17-517Q | for washing the cells |
| Penicillin-Streptomycin | Biosera | LM-A4118 | JIMT-1-EGFP and NK medium |
| pLP-1, pLP-2, pLP-VSV-G, pWOXEGFP | Invitrogen, (Prof. József T zsér, University of Debrecen) zsér, University of Debrecen) |
for JIMT-1-EGFP cell line | |
| Pluronic-F127 | Sigma | P2443 | for coating HCS plate before transfering the spheroids |
| Sunitinib malate | SigmaAldrich | PZ0012 | for treatments |
| Trastuzumab Ab (humanized anti-HER2 monoclonal antibody) | Herzuma®, EGIS Pharmaceuticals, Budapest, Hungary | NDC-63459-303-43 | for treatments |
| Trastuzumab-F(ab')2 | Gift from Prof. György Vereb and Árpád Szö r r |
Department of Biophysics and Cell Biology, University of Debrecen | for treatments |
| Trypan blue 0.4% solution | Sigma | T8154 | for cell counting |
| Trypsin-EDTA 1X in PBS | Biosera | LM-T1706 | for cells detachment |
Riferimenti
- Jubelin, C., et al. Three-dimensional in vitro culture models in oncology research. Cell Biosci. 12 (1), 155 (2022).
- Mittler, F., et al. High-content monitoring of drug effects in a 3D spheroid model. Front Oncol. 7, 293 (2017).
- Badr-Eldin, S. M., Aldawsari, H. M., Kotta, S., Deb, P. K., Venugopala, K. N. Three-dimensional in vitro cell culture models for efficient drug discovery: Progress so far and future prospects. Pharmaceuticals (Basel). 15 (8), 926 (2022).
- Brancato, V., Oliveira, J. M., Correlo, V. M., Reis, R. L., Kundu, S. C. Could 3D models of cancer enhance drug screening. Biomaterials. 232, 119744 (2020).
- Pinto, B., Henriques, A. C., Silva, P. M. A., Bousbaa, H. Three-dimensional spheroids as in vitro preclinical models for cancer research. Pharmaceutics. 12 (12), 1186 (2020).
- Fitzgerald, A. A., Li, E., Weiner, L. M. 3D culture systems for exploring cancer immunology. Cancers (Basel). 13 (1), 56 (2020).
- Zanoni, M., et al. 3D tumor spheroid models for in vitro therapeutic screening: A systematic approach to enhance the biological relevance of data obtained. Sci Rep. 6, 19103 (2016).
- Boucherit, N., Gorvel, L., Olive, D. 3D tumor models and their use for the testing of immunotherapies. Front Immunol. 11, 603640 (2020).
- Li, Y., et al. Recent progress on immunotherapy for breast cancer: Tumor microenvironment, nanotechnology and more. Front Bioeng Biotechnol. 9, 680315 (2021).
- Lo Nigro, C., et al. NK-mediated antibody-dependent cell-mediated cytotoxicity in solid tumors: Biological evidence and clinical perspectives. Ann Transl Med. 7 (5), 105 (2019).
- Sun, Y. S., et al. Risk factors and preventions of breast cancer. Int J Biol Sci. 13 (11), 1387-1397 (2017).
- Liu, P. H., Wei, J. C., Wang, Y. H., Yeh, M. H. Female breast cancer incidence predisposing risk factors identification using nationwide big data: A matched nested case-control study in taiwan. BMC Cancer. 22 (1), 849 (2022).
- Burguin, A., Diorio, C., Durocher, F. Breast cancer treatments: Updates and new challenges. J Pers Med. 11 (8), 808 (2021).
- Costa, R. L. B., Czerniecki, B. J. Clinical development of immunotherapies for HER2(+) breast cancer: A review of HER2-directed monoclonal antibodies and beyond. NPJ Breast Cancer. 6, 10 (2020).
- Musolino, A., et al. Role of fcgamma receptors in HER2-targeted breast cancer therapy. J Immunother Cancer. 10 (1), e003171 (2022).
- Petricevic, B., et al. Trastuzumab mediates antibody-dependent cell-mediated cytotoxicity and phagocytosis to the same extent in both adjuvant and metastatic HER2/NEU breast cancer patients. J Transl Med. 11, 307 (2013).
- Guti, E., et al. The multitargeted receptor tyrosine kinase inhibitor sunitinib induces resistance of HER2 positive breast cancer cells to Trastuzumab-mediated ADCC. Cancer Immunol Immunother. 71 (9), 2151-2168 (2022).
- Barok, M., et al. Trastuzumab decreases the number of circulating and disseminated tumor cells despite Trastuzumab resistance of the primary tumor. Cancer Lett. 260 (1-2), 198-208 (2008).
- Toth, G., et al. The combination of Trastuzumab and Pertuzumab administered at approved doses may delay development of Trastuzumab resistance by additively enhancing antibody-dependent cell-mediated cytotoxicity. MAbs. 8 (7), 1361-1370 (2016).
- Ehlers, F. a. I., et al. ADCC-inducing antibody Trastuzumab and selection of KIR-HLA ligand mismatched donors enhance the NK cell anti-breast cancer response. Cancers (Basel). 13 (13), 3232 (2021).
- Gangadhara, S., Smith, C., Barrett-Lee, P., Hiscox, S. 3d culture of Her2+ breast cancer cells promotes AKT to MAPK switching and a loss of therapeutic response. BMC Cancer. 16, 345 (2016).
- Balalaeva, I. V., Sokolova, E. A., Puzhikhina, A. D., Brilkina, A. A., Deyev, S. M. Spheroids of Her2-positive breast adenocarcinoma for studying anticancer immunotoxins in vitro. Acta Naturae. 9 (1), 38-43 (2017).
- Selis, F., et al. Pegylated Trastuzumab fragments acquire an increased in vivo stability but show a largely reduced affinity for the target antigen. Int J Mol Sci. 17 (4), 491 (2016).
- Johnston, R. L., et al. High content screening application for cell-type specific behaviour in heterogeneous primary breast epithelial subpopulations. Breast Cancer Res. 18 (1), 18 (2016).
- Kandaswamy, C., Silva, L. M., Alexandre, L. A., Santos, J. M. High-content analysis of breast cancer using single-cell deep transfer learning. J Biomol Screen. 21 (3), 252-259 (2016).
- Esquer, H., Zhou, Q., Abraham, A. D., Labarbera, D. V. Advanced high-content-screening applications of clonogenicity in cancer. SLAS Discov. 25 (7), 734-743 (2020).
- Pickl, M., Ries, C. H. Comparison of 3D and 2D tumor models reveals enhanced Her2 activation in 3D associated with an increased response to trastuzumab. Oncogene. 28 (3), 461-468 (2009).

