Bir Tümör Sferoid Modelinde Antikora Bağımlı Hücresel Sitotoksisitenin Ölçülmesi: İlaç Keşfi Uygulaması
Summary
Burada, antitümör antikorların önemli bir kanser hücresi öldürme mekanizması olan ADCC mekanizmasını modüle eden bileşikleri tanımlamak için bir yöntem sunuyoruz. NK hücrelerinin sitotoksik etkisi, Trastuzumab varlığında meme kanseri hücre sferoidlerinde ölçülür. Görüntü analizi, sferoidlerdeki canlı ve ölü öldürücü ve hedef hücreleri tanımlar.
Abstract
Tümör antijenlerini hedef alan monoklonal antikor bazlı immünoterapi artık kanser tedavisinin temel dayanağıdır. Antikorların klinik olarak ilgili etki mekanizmalarından biri, antikorun kanser hücrelerine bağlandığı ve tümör hücrelerini öldürmek için bağışıklık sisteminin hücresel bileşenini, örneğin doğal öldürücü (NK) hücreleri devreye soktuğu antikora bağımlı hücresel sitotoksisitedir (ADCC). Bu tedavilerin etkinliği, kanser hücrelerinin duyarlılığını veya bağışıklık hücrelerinin gücünü artıran adjuvan bileşiklerin tanımlanmasıyla geliştirilebilir. Ek olarak, önceki durumlar veya kanserle ilişkili semptomlar için birlikte ilaç verilen kanser hastalarında keşfedilmemiş ilaç etkileşimleri, antikor tedavisinin başarısını belirleyebilir; Bu nedenle, bu tür istenmeyen ilaç etkileşimlerinin ortadan kaldırılması gerekir. Bu hedefleri göz önünde bulundurarak, bir kanser ADCC modeli oluşturduk ve burada ADCC modüle edici ilaçları bulmak için basit bir protokol açıkladık. Kanser hücresi sferoidleri gibi 3D modeller, tümörlerin antikanser tedavilerine in vivo yanıtlarını tahmin etmede 2D kültürlerden daha üstün olduğundan, EGFP eksprese eden HER2 + JIMT-1 meme kanseri hücrelerinin ve NK92’nin sferoid ko-kültürleri. CD16 hücre hatları, HER2 pozitif meme kanserine karşı klinik olarak onaylanmış bir monoklonal antikor olan Trastuzumab ile kuruldu ve indüklendi. JIMT-1 sferoidlerinin hücre itici U-tabanlı 96 oyuklu plakalarda oluşmasına izin verildi. 3. günde, NK hücreleri ve Trastuzumab eklendi. Sferoidler daha sonra apoptotik hücre ölümünü ölçmek için Annexin V-Alexa 647 ile boyandı ve bu da sferoidlerin periferik bölgesinde otomatik bir mikroskopla ölçüldü. Testimizin ADCC modüle edici molekülleri tanımlamak için uygulanabilirliği, FDA tarafından metastatik kansere karşı onaylanan bir reseptör tirozin kinaz inhibitörü olan Sunitinib’in ADCC’yi neredeyse tamamen ortadan kaldırdığını göstererek gösterilmiştir. Sferoidlerin ve görüntü elde etme ve analiz boru hatlarının oluşturulması, kanser hücresi sferoidlerinde ADCC modüle edici bileşikler için yüksek verimli tarama ile uyumludur.
Introduction
Çok hücreli tümör sferoidleri (MCTS), yapışık hücrelerin kümelenme eğilimi nedeniyle oluşan, yaygın olarak kullanılan üç boyutlu (3D) modellerdir ve kanser hücresi biyolojisine mekanik içgörü kazandırmak için önemli bir aracı temsil eder. Sıvı bazlı ve iskele bazlı 3D kültürler gibi çok sayıda teknikle çok çeşitli hücre tiplerinden üretilebilirler1. Tek katmanlı 2D modellere göre en büyük avantajları, tümör hücrelerinin biyolojik davranışını, özellikle terapötik kaçışa ve ilaç direncine yol açan mekanizmaları taklit ederek in vivo tümörlerin temel özelliklerini, yani yapısal organizasyon ve hipoksiyi özetlemeleridir2. Bu nedenle, MCTS toksisite ve ilaç duyarlılığının öngörülebilirliğini artırabildiğinden, kanserleri 3D olarak incelemek için yaygın olarak kullanılırlar ve farklı kanser türleri için etkili ilaçların geliştirilmesini artırabilirler3.
Herhangi bir hastalığı incelemek için, ilgili ve uygun modellere kritik bir ihtiyaç vardır. Kanser immünolojisi çalışmaları için modeller oluşturmak zordur çünkü bağışıklık sistemi birden fazla hücre tipinden oluşur. Her hücre tipinin birkaç alt tipi ve geniş bir aktivasyon durumu yelpazesi vardır. Bu farklı bağışıklık hücresi tipleri, kanser hücreleri ve diğer tümör bileşenleri ile etkileşime girerek sonuçta hastalığın sonucunu etkiler. 2D in vitro hücre kültürü yöntemleri, çevrilebilirlikten yoksun oldukları ve bir ilacın sistem düzeyinde (örneğin dokularda) etkisini tahmin edemedikleri için bu karmaşık hücresel etkileşimleri özetlemekte başarısız olur4,5. Ayrıca, fare modelleri, insan ve fare bağışıklık sistemleri arasındaki temel farklılıklar nedeniyle ciddi sınırlamalara sahiptir. Bu nedenle, 3D kültür sistemleri, mevcut modellerdeki mevcut boşlukları doldurabilir, alternatif bir yöntem sağlayabilir ve kanser immünolojisi anlayışımızı geliştirebilir6. Spesifik olarak, sferoid modeller, immünoterapileri test etmek için, esas olarak immün hücre infiltrasyonunu ve sferoid hedeflere karşı anti-tümöral etkileri arttırmak için ilaç taramasının ve terapötik antikorların etkinliğini değerlendirmek için kullanılabilir7. Ayrıca, farklı metabolik ve proliferatif durumlardaki hücrelerden oluşan MCTS’nin stroma hücreleri (örneğin lenfositler, makrofajlar, fibroblastlar) ve kanser hücreleri arasındaki etkileşimleri inceleme ve yeni antikanser stratejilerinin geliştirilmesi için potansiyeli fazlasıyla gösterilmiştir8. Bu nedenle, tümör mikroçevresinin patofizyolojisini dikkate alarak, ilaç testi sürecini hızlandırmak için öngörücü ve doğru platformları desteklemek için hayati bir ihtiyaç vardır.
Meme kanseri (MK) tüm dünyada kadınlarda en sık teşhis edilen kanserdir. Bu heterojen hastalığın klinik sınıflandırması, transmembran reseptörlerinin varlığına dayanır., östrojen (ER) ve progesteron (PR) reseptörleri (topluca hormon reseptörleri, HR olarak adlandırılır) ve insan epidermal büyüme faktörü reseptörü 2 (HER2) proteininin aşırı ekspresyonu veya amplifikasyonu ile birlikte. Bu reseptörlerin immünohistokimyasal ekspresyonuna dayanarak, dört alt tip yaygın olarak tanınır: luminal A (HR+/HER2-), luminal B (HR+/HER2+), HER2-pozitif (HR-/HER2+) ve üçlü negatif meme kanseri (HR-/HER2-). HER2+ grubu, BC olgularının %10-15’ini oluşturur ve ER ve PR yokluğu ile yüksek HER2 ekspresyonu ile karakterizedir, luminal tümörlere kıyasla daha kötü prognoza sahiptir ve HER2/neu proteinine yönelik spesifik ilaçlar gerektirir9.
BC gelişimi çok aşamalı bir süreçtir ve hastalığın başarılı bir tedavisi için erken tanı şarttır10. Bununla birlikte, son zamanlarda ortaya çıkan kişiselleştirilmiş BC tedavi seçeneklerine (örneğin, endokrin ve anti-HER2 antikor tedavileri) rağmen, BC onkologları zorlamaya devam ediyor. Tıpkı cerrahi, kemoterapi ve radyoterapi gibi, bu kişiselleştirilmiş tedavilerin de ciddi yan etkileri olabilir ve hastalar bu ajanlara karşı direnç geliştirebilir, bu da en iyi stratejiyi belirlemeyi uzun vadeli bir zorluk haline getirir11,12. Bu nedenle, tümör ve mikroçevresi arasındaki etkileşimin daha iyi anlaşılması esastır ve farklı BC alt tiplerinin özelliklerini dikkate alan yeni tedavilerin geliştirilmesi için yeni yönler sağlaması beklenmektedir13. Antikor ilaç konjugatları, evlat edinen T hücresi tedavileri, aşılar ve yeni HER2’ye yönelik monoklonal antikorlar (mAb’ler) gibi yeni bir immünoterapi dalgası, HER2 eksprese eden tümörleri olan geniş bir hasta popülasyonunda incelenmektedir14.
Örneğin trastuzumab, HER2+ BC için etkili bir tedavi yöntemini temsil eder. Etki şeklinin bir parçası olarak, Trastuzumab, fragman kristalleşebilir gama reseptörüne (FcγR) bağlı aktivitelere aracılık eder. FcγR’ler, Fc fragmanına olan afiniteleri ve başlattıkları bağışıklık tepkisi ile ayırt edilir. Doğal öldürücü (NK) hücreler üzerinde FcγRIIIa’nın (CD16A) aktive edilmesi, antikora bağımlı hücresel sitotoksisiteye (ADCC) aracılık etmek için çok önemlidir, makrofajlarda FcγRIIa (CD32A) ve FcγRIIIa’yı tetiklemek antikora bağımlı hücresel fagositozu (ADCP) indükler15. Hayvan modelleri üzerinde yapılan çalışmalar, FcγRI (CD64) ve FcγRIII (CD16) reseptörlerinden yoksun farelerin, tümöre özgü antijenlere karşı koruyucu bağışıklık tepkileri başlatamadığını gösterdi ve bu da ADCC’nin muhtemelen mAb Trastuzumab16 için önemli bir etki mekanizması olduğunu ortaya koydu.
NK hücreleri, ADCC tarafından kanser hücresinin öldürülmesi için tümör hücresine bağlı Abs’ye başvurduğundan, Fc reseptörlerinin ekspresyonu Trastuzumab17 ile etkili bir tedavi için kritik öneme sahiptir (Şekil 1). Ayrıca, etkileri, aktive edici ve inhibitör reseptörlerin, örneğin Öldürücü hücreli immünoglobulin benzeri (KIR) reseptörlerin uyarılmasıyla verimli bir şekilde dengelenir18.
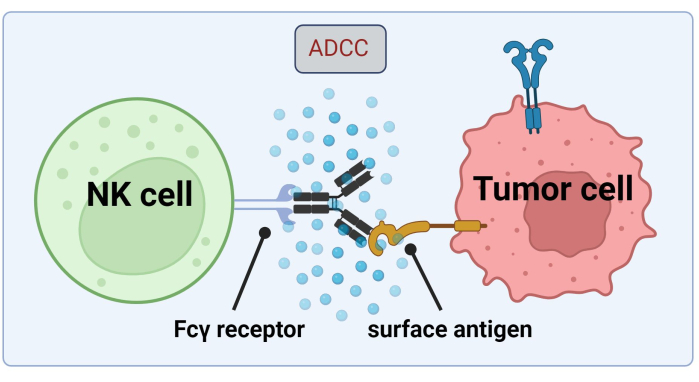
Şekil 1. Bir antitümör yanıtı bağlamında ADCC’nin mekanizması. Doğal öldürücü (NK) bir hücrenin Fcγ reseptörü, daha önce bir kanser hücresi üzerindeki bir yüzey antijenine bağlanmış olan bir antikorun Fc bölgesini tanır. Bu immünolojik sinaps, granzimler ve perforin gibi sitotoksik mediatörleri serbest bırakan NK hücresinin degranülasyonuna yol açar. Bu moleküller hücre zarında gözenek oluşumuna katkıda bulunur ve hedef hücrenin programlanmış hücre ölümüne neden olan apoptotik yolları aktive eder ( Biorender.com ile oluşturulan görüntü). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
HER2+ BC için immünoterapi geliştirme, gelişen bir alanı temsil etmektedir. Bu durumda, bağışıklık sisteminin çeşitli bileşenleri arasındaki etkileşimler göz önünde bulundurulmalıdır. Ayrıca, önceki yayınlar, sinerji yaratan kombinasyonları tanımlamak için her türlü geleneksel, immün veya hücre tedavisini içeren kombinasyon tedavilerini kapsamlı bir şekilde test etmiştir19.
HER2+ BC’nin birkaç 3D modeli daha önce ilaç keşfi için kullanılmıştır. Örneğin, Balalaeva ve ark. HER2 hedefli immünotoksin 4D5scFv-PE4020’nin sitotoksisitesini değerlendirmek için HER2’yi aşırı eksprese eden SKBR-3 sferoidlerini kullandılar. Başka bir çalışmada, Trastuzumab ve endokrin ajanlara yanıt olarak hücre büyümesini ölçmek için 3D Matrigel tabanlı bir HER2+ BC kültür sistemi kurulmuştur21. Bu çalışmalar, terapötik yanıtları klinik olarak iyileştirmek için etkili bir stratejiyi temsil etmede HER2 aşırı eksprese eden kanser hücrelerinin tümör sferoid modellerinin önemini vurgulamaktadır22.
Grubumuz daha önce çok hedefli bir tirozin kinaz inhibitörü olan Sunitinib’i, 2D kültür tahlilinde JIMT-1 HER2 + BC hücrelerinde Trastuzumab’a bağımlı ADCC’nin bir inhibitörü olarak tanımladı. Çalışma, Sunitinib’in otofajiyi indüklediğini ve NK hücrelerinin öldürme fonksiyonunu bozduğunu, HER2 ekspresyonunu aşağı regüle ettiğini ve JIMT-1 hücrelerinin yüzey bağlanmasını arttırdığınıortaya koydu 17.
Burada, yüksek verimli tarama uygulamaları için kullanılmak üzere yeni bir 3D, küresel ADCC modeli (NK.92.CD16 + Trastuzumab + JIMT-1-EGFP kanser hücreleri) oluşturduk ve yukarıda belirtilen bulguları doğrulamak için Sunitinib bir model bileşik olarak kullanıldı. İlk olarak, JIMT-1 hücrelerini17 eksprese eden EGFP ürettik ve bu hücrelerden sferoidler büyüttük. ADCC, Trastuzumab ile birlikte NK hücreleri tarafından indüklendi ve sferoidler, 24 saat boyunca test bileşiklerinin varlığında veya yokluğunda kültürde tutuldu (Şekil 2). ADCC’nin miktar tayini, bir Yüksek İçerik Analiz sistemi kullanılarak apoptotik kanser hücresi ölümünün (Annexin V boyama) saptanmasına dayanır.
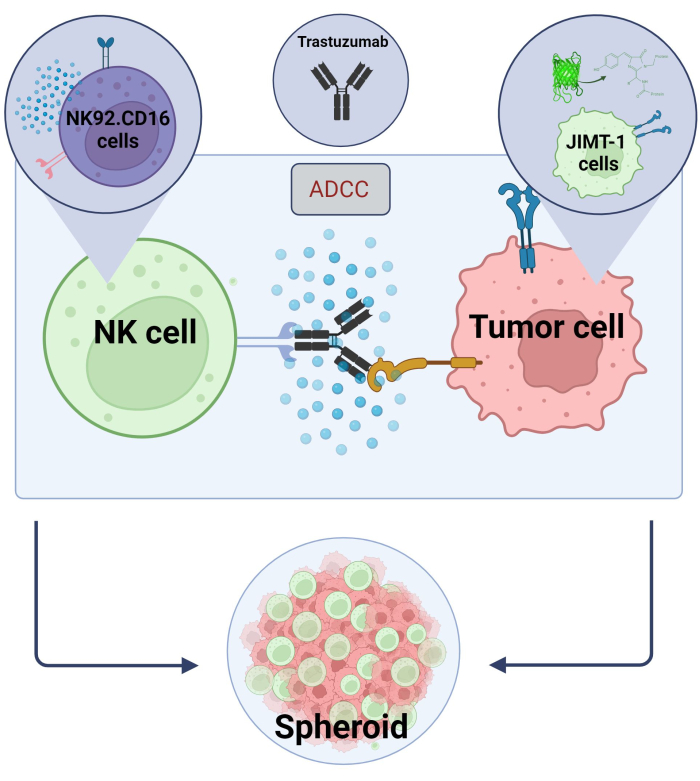
Şekil 2. 3D küresel ko-kültür sisteminde ADCC. Deneysel ayarlarımız, 2B modellere kıyasla in vivo mikro ortamı daha doğru bir şekilde modelleyebilen bir 3B küresel sisteme dayanmaktadır. JIMT-1 EGFP meme kanseri hücreleri, sferoid adı verilen yuvarlak şekilli bir hücresel küme oluşturmak için içbükey bir hücre kovucu tabana ekildi. ADCC daha sonra NK92 eklenerek başlatıldı. CD16 doğal öldürücü hücreler (E:T oranı = 20:1) ve bir anti-HER2 monoklonal antikoru olan Trastuzumab. Deneysel modelin, ADCC modifiye edici test bileşiklerinin tanımlanması için verimli ve kolayca uygulanabilir olduğu kanıtlanmıştır ( Biorender.com ile oluşturulan görüntü). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Bu şekilde veri elde etmenin gerçek zamanlı olarak yapılabileceğini ve kanser ilacı keşfinde yüksek içerikli taramada kullanım için istatistiksel olarak sağlam olduğunu gösterdik. Daha da önemlisi, bu model daha büyük bir bileşik setinin genişletilmiş bir doğrulamasına izin verir ve ilgilenilen birkaç tahlillere uygulanabilir.
Protocol
Representative Results
Discussion
Son birkaç on yılda BC tedavisinde önemli gelişmelere rağmen, hastalar hala düzenli olarak ilaç direnci geliştirmekte veya olumsuz yan etkiler yaşamaktadır24. BC ile bağlantılı yüksek morbidite ve mortalite, terapötik gelişim için eyleme geçirilebilecek yeni molekülleri tanımlamak için sağlam tarama platformları gibi, altta yatan moleküler mekanizmaların sürekli araştırılmasını gerektirir25. Bu stratejiler, hücre kültürüne dayalı translas…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
LV, Ulusal Araştırma, Geliştirme ve İnovasyon Ofisi hibelerinden fon aldı GINOP-2.3.2-15-2016-00010 TUMORDNS”, GINOP-2.3.2-15-2016-00048-STAYALIVE, OTKA K132193 ve K147482. Bu proje HUN-REN Macar Araştırma Ağı’ndan fon almıştır. CD16.176V.NK-92 hücreleri, Dr. Kerry S. Campbell’dan (Fox Chase Center, Philadelphia, PA, Brink Biologics, lnc. San Diego, CA), dünya çapında patentlerle korunmaktadır ve Nantkwest, lnc tarafından lisanslanmıştır. (www.nantkwest.com). Yazarlar, NK-92 hücre hattı ve TR-F(ab’)2’nin kullanımındaki yardımları ve teknik tavsiyeleri için György Vereb ve Árpád Szöőr’e müteşekkirdir.
Materials
| 96-well glass bottom Cell Carrier Ultra microplates | PerkinElmer, Waltham, MA, USA | LLC 6055302 | for spheroids measurements |
| 96-well tissue culture plates | TPP | 92096 | for cell seeding |
| α-MEM medium | Sigma | M8042 | in NK medium |
| Agarose | Sigma | A9539 | for spheroids seeding |
| Annexin V-Alexa Fluo 647 conjugate | Invitrogen-ThermoFisher Scientific | A23204 | for apoptosis measurement with HCS |
| CD16.176 V.NK-92 cells | Dr. Kerry S. Campbell (the Fox Chase Cancer Center, Philadelphia, PA on behalf of Brink Biologics, Inc. San Diego, CA) | ATCC CRL-2407 | for cell culture |
| Cell Tracker Blue | Invitrogen-Thermo Scientific, Waltham, MA, USA) | C2110 | for staining of NK cells |
| DMEM/F-12 medium | Sigma | D8437 | in JIMT1-EGFP medium |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418 | for coating HCS plate before transfering the spheroids |
| Fetal bovine serum (FBS) | Biosera | FB-1090/500 | JIMT-1-EGFP and NK medium |
| Glutamine | Gibco | 35,050–061 | in NK medium |
| GraphPad Prism 8.0.1 | GraphPad Software Inc., San Diego, CA, USA | for statistical analysis | |
| Harmony software | PerkinElmer, Waltham, MA, USA | for HCA | |
| IL-2 | Proleukin, Novartis Hungária Kft., Budapest, Hungary | PHC0026 | in NK medium |
| Insulin (Humulin R) | Eli Lilly | HI0219 | JIMT-1-EGFP medium |
| JIMT-1 breast cancer cells | for cell culture | ||
| MEM Non-essential Amino Acids (MEM-NEAA) | Gibco | 11,140–050 | in NK medium |
| Na-pyruvate | Lonza | BE13-115E | in NK medium |
| Opera Phenix High-Content Analysis equipment | PerkinElmer, Waltham, MA, USA | HH14001000 | for HCA |
| PBS (Posphate buffered saline) | Lonza | BE17-517Q | for washing the cells |
| Penicillin-Streptomycin | Biosera | LM-A4118 | JIMT-1-EGFP and NK medium |
| pLP-1, pLP-2, pLP-VSV-G, pWOXEGFP | Invitrogen, (Prof. József T zsér, University of Debrecen) zsér, University of Debrecen) |
for JIMT-1-EGFP cell line | |
| Pluronic-F127 | Sigma | P2443 | for coating HCS plate before transfering the spheroids |
| Sunitinib malate | SigmaAldrich | PZ0012 | for treatments |
| Trastuzumab Ab (humanized anti-HER2 monoclonal antibody) | Herzuma®, EGIS Pharmaceuticals, Budapest, Hungary | NDC-63459-303-43 | for treatments |
| Trastuzumab-F(ab')2 | Gift from Prof. György Vereb and Árpád Szö r r |
Department of Biophysics and Cell Biology, University of Debrecen | for treatments |
| Trypan blue 0.4% solution | Sigma | T8154 | for cell counting |
| Trypsin-EDTA 1X in PBS | Biosera | LM-T1706 | for cells detachment |
Riferimenti
- Jubelin, C., et al. Three-dimensional in vitro culture models in oncology research. Cell Biosci. 12 (1), 155 (2022).
- Mittler, F., et al. High-content monitoring of drug effects in a 3D spheroid model. Front Oncol. 7, 293 (2017).
- Badr-Eldin, S. M., Aldawsari, H. M., Kotta, S., Deb, P. K., Venugopala, K. N. Three-dimensional in vitro cell culture models for efficient drug discovery: Progress so far and future prospects. Pharmaceuticals (Basel). 15 (8), 926 (2022).
- Brancato, V., Oliveira, J. M., Correlo, V. M., Reis, R. L., Kundu, S. C. Could 3D models of cancer enhance drug screening. Biomaterials. 232, 119744 (2020).
- Pinto, B., Henriques, A. C., Silva, P. M. A., Bousbaa, H. Three-dimensional spheroids as in vitro preclinical models for cancer research. Pharmaceutics. 12 (12), 1186 (2020).
- Fitzgerald, A. A., Li, E., Weiner, L. M. 3D culture systems for exploring cancer immunology. Cancers (Basel). 13 (1), 56 (2020).
- Zanoni, M., et al. 3D tumor spheroid models for in vitro therapeutic screening: A systematic approach to enhance the biological relevance of data obtained. Sci Rep. 6, 19103 (2016).
- Boucherit, N., Gorvel, L., Olive, D. 3D tumor models and their use for the testing of immunotherapies. Front Immunol. 11, 603640 (2020).
- Li, Y., et al. Recent progress on immunotherapy for breast cancer: Tumor microenvironment, nanotechnology and more. Front Bioeng Biotechnol. 9, 680315 (2021).
- Lo Nigro, C., et al. NK-mediated antibody-dependent cell-mediated cytotoxicity in solid tumors: Biological evidence and clinical perspectives. Ann Transl Med. 7 (5), 105 (2019).
- Sun, Y. S., et al. Risk factors and preventions of breast cancer. Int J Biol Sci. 13 (11), 1387-1397 (2017).
- Liu, P. H., Wei, J. C., Wang, Y. H., Yeh, M. H. Female breast cancer incidence predisposing risk factors identification using nationwide big data: A matched nested case-control study in taiwan. BMC Cancer. 22 (1), 849 (2022).
- Burguin, A., Diorio, C., Durocher, F. Breast cancer treatments: Updates and new challenges. J Pers Med. 11 (8), 808 (2021).
- Costa, R. L. B., Czerniecki, B. J. Clinical development of immunotherapies for HER2(+) breast cancer: A review of HER2-directed monoclonal antibodies and beyond. NPJ Breast Cancer. 6, 10 (2020).
- Musolino, A., et al. Role of fcgamma receptors in HER2-targeted breast cancer therapy. J Immunother Cancer. 10 (1), e003171 (2022).
- Petricevic, B., et al. Trastuzumab mediates antibody-dependent cell-mediated cytotoxicity and phagocytosis to the same extent in both adjuvant and metastatic HER2/NEU breast cancer patients. J Transl Med. 11, 307 (2013).
- Guti, E., et al. The multitargeted receptor tyrosine kinase inhibitor sunitinib induces resistance of HER2 positive breast cancer cells to Trastuzumab-mediated ADCC. Cancer Immunol Immunother. 71 (9), 2151-2168 (2022).
- Barok, M., et al. Trastuzumab decreases the number of circulating and disseminated tumor cells despite Trastuzumab resistance of the primary tumor. Cancer Lett. 260 (1-2), 198-208 (2008).
- Toth, G., et al. The combination of Trastuzumab and Pertuzumab administered at approved doses may delay development of Trastuzumab resistance by additively enhancing antibody-dependent cell-mediated cytotoxicity. MAbs. 8 (7), 1361-1370 (2016).
- Ehlers, F. a. I., et al. ADCC-inducing antibody Trastuzumab and selection of KIR-HLA ligand mismatched donors enhance the NK cell anti-breast cancer response. Cancers (Basel). 13 (13), 3232 (2021).
- Gangadhara, S., Smith, C., Barrett-Lee, P., Hiscox, S. 3d culture of Her2+ breast cancer cells promotes AKT to MAPK switching and a loss of therapeutic response. BMC Cancer. 16, 345 (2016).
- Balalaeva, I. V., Sokolova, E. A., Puzhikhina, A. D., Brilkina, A. A., Deyev, S. M. Spheroids of Her2-positive breast adenocarcinoma for studying anticancer immunotoxins in vitro. Acta Naturae. 9 (1), 38-43 (2017).
- Selis, F., et al. Pegylated Trastuzumab fragments acquire an increased in vivo stability but show a largely reduced affinity for the target antigen. Int J Mol Sci. 17 (4), 491 (2016).
- Johnston, R. L., et al. High content screening application for cell-type specific behaviour in heterogeneous primary breast epithelial subpopulations. Breast Cancer Res. 18 (1), 18 (2016).
- Kandaswamy, C., Silva, L. M., Alexandre, L. A., Santos, J. M. High-content analysis of breast cancer using single-cell deep transfer learning. J Biomol Screen. 21 (3), 252-259 (2016).
- Esquer, H., Zhou, Q., Abraham, A. D., Labarbera, D. V. Advanced high-content-screening applications of clonogenicity in cancer. SLAS Discov. 25 (7), 734-743 (2020).
- Pickl, M., Ries, C. H. Comparison of 3D and 2D tumor models reveals enhanced Her2 activation in 3D associated with an increased response to trastuzumab. Oncogene. 28 (3), 461-468 (2009).

