Kwantificering van antilichaamafhankelijke cellulaire cytotoxiciteit in een tumorsferoïde model: aanvraag voor ontdekking van geneesmiddelen
Summary
Hier presenteren we een methode om verbindingen te identificeren die het ADCC-mechanisme moduleren, een belangrijk kankerceldodend mechanisme van antitumorantilichamen. Het cytotoxische effect van NK-cellen wordt gemeten in sferoïden van borstkankercellen in aanwezigheid van Trastuzumab. Beeldanalyse identificeert levende en dode killer- en doelcellen in sferoïden.
Abstract
Op monoklonale antilichamen gebaseerde immunotherapie gericht op tumorantigenen is nu een steunpilaar van de behandeling van kanker. Een van de klinisch relevante werkingsmechanismen van de antilichamen is antilichaamafhankelijke cellulaire cytotoxiciteit (ADCC), waarbij het antilichaam zich bindt aan de kankercellen en de cellulaire component van het immuunsysteem, bijvoorbeeld natural killer (NK)-cellen, inschakelt om de tumorcellen te doden. De effectiviteit van deze therapieën kan worden verbeterd door adjuvante verbindingen te identificeren die de gevoeligheid van de kankercellen of de potentie van de immuuncellen verhogen. Bovendien kunnen onontdekte geneesmiddelinteracties bij kankerpatiënten die comedicatie hebben gekregen voor eerdere aandoeningen of kankergerelateerde symptomen het succes van de antilichaamtherapie bepalen; Daarom moeten dergelijke ongewenste geneesmiddelinteracties worden geëlimineerd. Met deze doelen in gedachten hebben we een ADCC-model voor kanker gemaakt en beschrijven we hier een eenvoudig protocol om ADCC-modulerende medicijnen te vinden. Aangezien 3D-modellen zoals sferoïden van kankercellen superieur zijn aan 2D-culturen bij het voorspellen van in vivo reacties van tumoren op antikankertherapieën, sferoïde co-culturen van EGFP-expressieve HER2+ JIMT-1-borstkankercellen en de NK92. CD16-cellijnen werden opgezet en geïnduceerd met Trastuzumab, een monoklonaal antilichaam dat klinisch is goedgekeurd tegen HER2-positieve borstkanker. JIMT-1 sferoïden mochten zich vormen in celafstotende U-bodem 96-well platen. Op dag 3 werden NK-cellen en Trastuzumab toegevoegd. De sferoïden werden vervolgens gekleurd met Annexine V-Alexa 647 om apoptotische celdood te meten, die met een geautomatiseerde microscoop in de perifere zone van de sferoïden werd gekwantificeerd. De toepasbaarheid van onze test om ADCC-modulerende moleculen te identificeren, wordt aangetoond door aan te tonen dat Sunitinib, een receptortyrosinekinaseremmer die door de FDA is goedgekeurd tegen uitgezaaide kanker, ADCC bijna volledig afschaft. Het genereren van de sferoïden en beeldacquisitie- en analysepijplijnen zijn compatibel met high-throughput screening voor ADCC-modulerende verbindingen in sferoïden van kankercellen.
Introduction
Meercellige tumorsferoïden (MCTS) zijn veelgebruikte driedimensionale (3D) modellen die ontstaan als gevolg van de neiging van aanhangende cellen om te aggregeren en een belangrijk hulpmiddel vormen voor het verkrijgen van mechanistisch inzicht in de biologie van kankercellen. Ze kunnen worden gegenereerd uit een breed scala aan celtypen door middel van tal van technieken, zoals 3D-culturen op basis van vloeistof en steigers1. Hun belangrijkste voordeel ten opzichte van monolayer 2D-modellen is dat ze de belangrijkste kenmerken van in vivo tumoren, namelijk structurele organisatie en hypoxie, samenvatten door het biologische gedrag van tumorcellen na te bootsen, met name de mechanismen die leiden tot therapeutische ontsnapping en resistentie tegen geneesmiddelen. Aangezien MCTS de voorspelbaarheid van toxiciteit en gevoeligheid voor geneesmiddelen kan verbeteren, worden ze dus veel gebruikt om kankers in 3D te bestuderen en kunnen ze de ontwikkeling van effectieve geneesmiddelen voor verschillende soorten kanker verbeteren.
Om elke ziekte te bestuderen, is er een kritieke behoefte aan relevante en handige modellen. Het opzetten van modellen voor kankerimmunologische studies is een uitdaging omdat het immuunsysteem uit meerdere celtypen bestaat. Elk celtype heeft verschillende subtypen en een breed spectrum aan activeringstoestanden. Deze verschillende immuunceltypen interageren met kankercellen en andere tumorcomponenten, wat uiteindelijk de uitkomst van de ziekte beïnvloedt. 2D in vitro celkweekmethoden slagen er niet in om deze complexe cellulaire interacties te recapituleren, omdat ze niet vertaalbaar zijn en niet in staat zijn om de werking van een geneesmiddel op systeemniveau (bijv. in weefsels) te voorspellen4,5. Bovendien hebben muismodellen ook ernstige beperkingen vanwege de fundamentele verschillen tussen het immuunsysteem van mensen en muizen. 3D-kweeksystemen kunnen daarom de huidige hiaten in de beschikbare modellen opvullen, een alternatieve methode bieden en ons begrip van kankerimmunologie verbeteren6. In het bijzonder kunnen sferoïde modellen worden gebruikt voor het testen van immunotherapieën, voornamelijk om de efficiëntie van geneesmiddelenscreening en therapeutische antilichamen te beoordelen voor het versterken van de infiltratie van immuuncellen en antitumorale effecten tegen de sferoïde doelen7. Bovendien is het potentieel van MCTS, samengesteld uit cellen in verschillende metabole en proliferatieve toestanden, om de interacties tussen stromacellen (bijv. lymfocyten, macrofagen, fibroblasten) en kankercellen te bestuderen en voor de ontwikkeling van nieuwe antikankerstrategieën ruimschoots aangetoond8. Daarom is het van vitaal belang om voorspellende en nauwkeurige platforms te bevestigen om het testproces van geneesmiddelen te stimuleren, rekening houdend met de pathofysiologie van de micro-omgeving van de tumor.
Borstkanker (BC) is wereldwijd de meest voorkomende vorm van kanker bij vrouwen. De klinische classificatie van deze heterogene ziekte is gebaseerd op de aanwezigheid van transmembraanreceptoren, zoals oestrogeen (ER) en progesteron (PR) receptoren (gezamenlijk hormoonreceptoren genoemd, HR), samen met de overexpressie of amplificatie van het humane epidermale groeifactorreceptor 2 (HER2) eiwit/oncogen. Op basis van de immunohistochemische expressie van deze receptoren worden vier subtypes algemeen herkend: luminaal A (HR+/HER2-), luminaal B (HR+/HER2+), HER2-positief (HR-/HER2+) en triple-negatief borstkanker (HR-/HER2-). De HER2+-groep vormt 10-15% van de BC-gevallen en wordt gekenmerkt door een hoge HER2-expressie met afwezigheid van ER en PR, met een slechtere prognose in vergelijking met luminale tumoren en waarvoor specifieke geneesmiddelen nodig zijn die gericht zijn tegen het HER2/neu-eiwit9.
De ontwikkeling van BC is een proces dat uit meerdere stappen bestaat en een vroege diagnose is essentieel voor een succesvolle behandeling van de ziekte. Ondanks recent naar voren gekomen gepersonaliseerde BC-behandelingsopties (bijv. endocriene en anti-HER2-antilichaamtherapieën), blijft BC oncologen uitdagen. Net als chirurgie, chemotherapie en radiotherapie kunnen deze gepersonaliseerde therapieën ook ernstige bijwerkingen hebben en kunnen patiënten resistentie tegen deze middelen ontwikkelen, waardoor het een uitdaging op lange termijn is om de beste strategie te bepalen11,12. Daarom is een beter begrip van de wisselwerking tussen de tumor en zijn micro-omgeving essentieel en zal dit naar verwachting nieuwe richtingen bieden voor de ontwikkeling van nieuwe behandelingen die rekening houden met de specifieke kenmerken van de verschillende BC-subtypes13. Een nieuwe golf van immunotherapieën, zoals antilichaamgeneesmiddelconjugaten, adoptieve T-celtherapieën, vaccins en nieuwe HER2-gerichte monoklonale antilichamen (mAbs) wordt bestudeerd in een brede populatie van patiënten met tumoren die HER2 tot expressie brengen14.
Trastuzumab vertegenwoordigt bijvoorbeeld een efficiënte behandelingsmodaliteit voor HER2+ BC. Als onderdeel van zijn werkingsmechanisme bemiddelt Trastuzumab fragmentkristalliseerbare gammareceptor (FcγR)-afhankelijke activiteiten. FcγR’s onderscheiden zich door hun affiniteit voor het Fc-fragment en de immuunrespons die ze initiëren. Het activeren van FcγRIIIa (CD16A) op natural killer (NK)-cellen is cruciaal voor het mediëren van antilichaamafhankelijke cellulaire cytotoxiciteit (ADCC), terwijl het activeren van FcγRIIa (CD32A) en FcγRIIIa op macrofagen antilichaamafhankelijke cellulaire fagocytose (ADCP) induceert15. Studies op diermodellen toonden aan dat muizen zonder FcγRI (CD64) en FcγRIII (CD16) receptoren niet in staat waren om beschermende immuunresponsen tegen tumorspecifieke antigenen te initiëren, wat aantoont dat ADCC waarschijnlijk een belangrijk werkingsmechanisme is voor de mAb Trastuzumab16.
Aangezien NK-cellen hun toevlucht nemen tot tumorcelgebonden Abs voor het doden van kankercellen door ADCC, is expressie van Fc-receptoren van cruciaal belang voor een efficiënte behandeling met Trastuzumab17 (Figuur 1). Bovendien wordt hun werking efficiënt in evenwicht gehouden door een stimulatie van activerende en remmende receptoren, b.v. Killer-cell immunoglobuline-achtige (KIR) receptoren18.
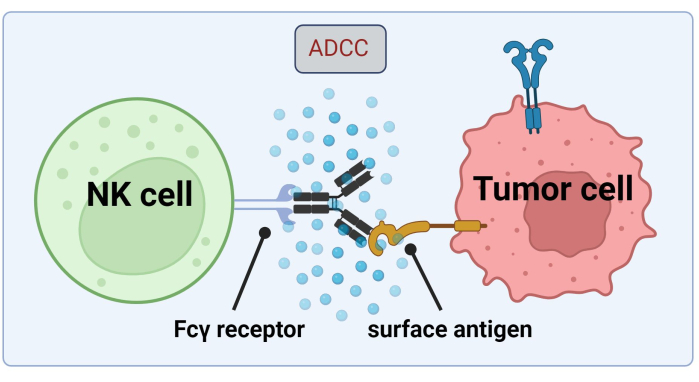
Figuur 1. Mechanisme van ADCC in de context van een antitumorrespons. De Fcγ-receptor van een natural killer (NK)-cel herkent het Fc-gebied van een antilichaam, dat eerder was gebonden aan een oppervlakte-antigeen op een kankercel. Deze immunologische synaps leidt tot de degranulatie van de NK-cel, waarbij cytotoxische mediatoren zoals granzymen en perforine vrijkomen. Deze moleculen dragen bij aan de porievorming in het celmembraan en activeren apoptotische routes die geprogrammeerde celdood van de doelcel veroorzaken (afbeelding gemaakt met Biorender.com). Klik hier om een grotere versie van deze figuur te bekijken.
De ontwikkeling van immunotherapie voor HER2+ BC vertegenwoordigt een evoluerend veld. In dit geval moet rekening worden gehouden met interacties tussen verschillende componenten van het immuunsysteem. Bovendien zijn in eerdere publicaties combinatietherapieën met alle soorten traditionele, immuun- of celtherapieën uitgebreid getest om synergetische combinaties teidentificeren19.
Verschillende 3D-modellen van HER2+ BC zijn eerder gebruikt voor het ontdekken van geneesmiddelen. Balalaeva et al. gebruikten bijvoorbeeld SKBR-3-sferoïden die HER2 tot overexpressie brachten om de cytotoxiciteit van het HER2-gerichte immunotoxine 4D5scFv-PE4020 te beoordelen. In een andere studie werd een op 3D Matrigel gebaseerd HER2+ BC-kweeksysteem opgezet om de celgroei te meten als reactie op trastuzumab en endocrienemiddelen21. Deze studies benadrukken het belang van tumorsferoïde modellen van HER2 die kankercellen tot overexpressie brengen bij het vertegenwoordigen van een effectieve strategie om therapeutische responsen klinisch te verbeteren22.
Onze groep identificeerde eerder Sunitinib, een multitargeted tyrosinekinaseremmer, als een remmer van Trastuzumab-afhankelijke ADCC in JIMT-1 HER2+ BC-cellen in een 2D-kweektest. Uit de studie bleek dat Sunitinib autofagie induceert en de dodende functie van NK-cellen schaadt, waardoor de HER2-expressie wordt verlaagd en de oppervlaktehechting van JIMT-1-cellen wordt verbeterd17.
Hier hebben we een nieuw 3D, sferoïde ADCC-model (NK.92.CD16 + Trastuzumab + JIMT-1-EGFP-kankercellen) opgesteld dat kan worden gebruikt voor screeningstoepassingen met hoge doorvoer en, om de bovengenoemde bevindingen te valideren, werd Sunitinib gebruikt als modelverbinding. Eerst genereerden we EGFP die JIMT-1-cellen tot expressie bracht17 en kweekten we sferoïden uit deze cellen. ADCC werd geïnduceerd door NK-cellen samen met Trastuzumab, en sferoïden werden gedurende 24 uur in kweek gehouden in de aan- of afwezigheid van testverbindingen (figuur 2). De kwantificering van ADCC is gebaseerd op de detectie van apoptotische kankerceldood (Annexine V-kleuring) met behulp van een High-Content Analysis-systeem.
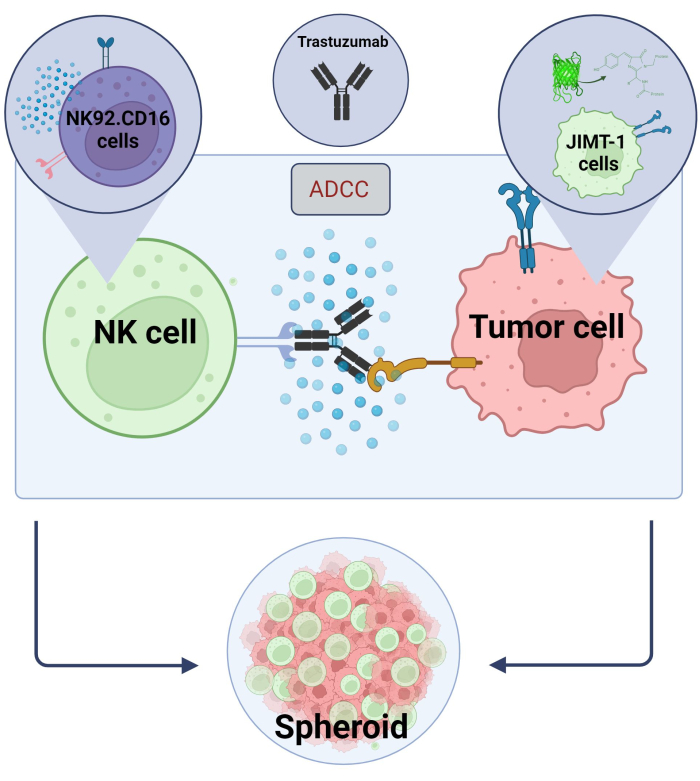
Figuur 2. ADCC in een 3D sferoïde co-cultuur systeem. Onze experimentele instellingen zijn gebaseerd op een 3D-sferoïde systeem dat de in vivo micro-omgeving nauwkeuriger kan modelleren in vergelijking met 2D-modellen. JIMT-1 EGFP-borstkankercellen werden gezaaid op een concave celafstotende bodem om een ronde cellulaire cluster te vormen, sferoïde genaamd. ADCC werd vervolgens geïnitieerd door NK92 toe te voegen. CD16 natural killer-cellen (E:T-verhouding = 20:1) en een anti-HER2 monoklonaal antilichaam, Trastuzumab. Het experimentele model is efficiënt en gemakkelijk toepasbaar gebleken voor de identificatie van ADCC-modificerende testverbindingen (afbeelding gemaakt met Biorender.com). Klik hier om een grotere versie van deze figuur te bekijken.
We hebben aangetoond dat het op deze manier verwerven van gegevens in realtime kan worden gedaan en statistisch robuust is voor gebruik bij screening met een hoog gehalte bij de ontdekking van kankergeneesmiddelen. Belangrijk is dat dit model een uitgebreide validatie van een grotere reeks verbindingen mogelijk maakt en kan worden toegepast op verschillende interessante tests.
Protocol
Representative Results
Discussion
Ondanks aanzienlijke verbeteringen in de behandeling van BC in de afgelopen decennia, ontwikkelen patiënten nog steeds regelmatig medicatieresistentie of ervaren ze negatievebijwerkingen24. De hoge morbiditeit en mortaliteit die verband houden met BC vereisen een voortdurend onderzoek naar de onderliggende moleculaire mechanismen, net als robuuste screeningplatforms om nieuwe moleculen te identificeren die bruikbaar zijn voor therapeutische ontwikkeling25. Deze strategieë…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
LV ontving financiering van subsidies van het National Research, Development and Innovation Office GINOP-2.3.2-15-2016-00010 TUMORDNS”, GINOP-2.3.2-15-2016-00048-STAYALIVE, OTKA K132193 en K147482. Dit project is gefinancierd door het HUN-REN Hungarian Research Network. CD16.176V.NK-92 cellen werden verkregen van Dr. Kerry S. Campbell (Fox Chase Center, Philadelphia, PA, namens Brink Biologics, lnc. San Diego, CA), worden wereldwijd beschermd door patenten en zijn in licentie gegeven door Nantkwest, lnc. (www.nantkwest.com). De auteurs zijn György Vereb en Árpád Szöőr dankbaar voor hun hulp bij het gebruik van de NK-92 cellijn en de TR-F(ab’)2, en voor technisch advies.
Materials
| 96-well glass bottom Cell Carrier Ultra microplates | PerkinElmer, Waltham, MA, USA | LLC 6055302 | for spheroids measurements |
| 96-well tissue culture plates | TPP | 92096 | for cell seeding |
| α-MEM medium | Sigma | M8042 | in NK medium |
| Agarose | Sigma | A9539 | for spheroids seeding |
| Annexin V-Alexa Fluo 647 conjugate | Invitrogen-ThermoFisher Scientific | A23204 | for apoptosis measurement with HCS |
| CD16.176 V.NK-92 cells | Dr. Kerry S. Campbell (the Fox Chase Cancer Center, Philadelphia, PA on behalf of Brink Biologics, Inc. San Diego, CA) | ATCC CRL-2407 | for cell culture |
| Cell Tracker Blue | Invitrogen-Thermo Scientific, Waltham, MA, USA) | C2110 | for staining of NK cells |
| DMEM/F-12 medium | Sigma | D8437 | in JIMT1-EGFP medium |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418 | for coating HCS plate before transfering the spheroids |
| Fetal bovine serum (FBS) | Biosera | FB-1090/500 | JIMT-1-EGFP and NK medium |
| Glutamine | Gibco | 35,050–061 | in NK medium |
| GraphPad Prism 8.0.1 | GraphPad Software Inc., San Diego, CA, USA | for statistical analysis | |
| Harmony software | PerkinElmer, Waltham, MA, USA | for HCA | |
| IL-2 | Proleukin, Novartis Hungária Kft., Budapest, Hungary | PHC0026 | in NK medium |
| Insulin (Humulin R) | Eli Lilly | HI0219 | JIMT-1-EGFP medium |
| JIMT-1 breast cancer cells | for cell culture | ||
| MEM Non-essential Amino Acids (MEM-NEAA) | Gibco | 11,140–050 | in NK medium |
| Na-pyruvate | Lonza | BE13-115E | in NK medium |
| Opera Phenix High-Content Analysis equipment | PerkinElmer, Waltham, MA, USA | HH14001000 | for HCA |
| PBS (Posphate buffered saline) | Lonza | BE17-517Q | for washing the cells |
| Penicillin-Streptomycin | Biosera | LM-A4118 | JIMT-1-EGFP and NK medium |
| pLP-1, pLP-2, pLP-VSV-G, pWOXEGFP | Invitrogen, (Prof. József T zsér, University of Debrecen) zsér, University of Debrecen) |
for JIMT-1-EGFP cell line | |
| Pluronic-F127 | Sigma | P2443 | for coating HCS plate before transfering the spheroids |
| Sunitinib malate | SigmaAldrich | PZ0012 | for treatments |
| Trastuzumab Ab (humanized anti-HER2 monoclonal antibody) | Herzuma®, EGIS Pharmaceuticals, Budapest, Hungary | NDC-63459-303-43 | for treatments |
| Trastuzumab-F(ab')2 | Gift from Prof. György Vereb and Árpád Szö r r |
Department of Biophysics and Cell Biology, University of Debrecen | for treatments |
| Trypan blue 0.4% solution | Sigma | T8154 | for cell counting |
| Trypsin-EDTA 1X in PBS | Biosera | LM-T1706 | for cells detachment |
Riferimenti
- Jubelin, C., et al. Three-dimensional in vitro culture models in oncology research. Cell Biosci. 12 (1), 155 (2022).
- Mittler, F., et al. High-content monitoring of drug effects in a 3D spheroid model. Front Oncol. 7, 293 (2017).
- Badr-Eldin, S. M., Aldawsari, H. M., Kotta, S., Deb, P. K., Venugopala, K. N. Three-dimensional in vitro cell culture models for efficient drug discovery: Progress so far and future prospects. Pharmaceuticals (Basel). 15 (8), 926 (2022).
- Brancato, V., Oliveira, J. M., Correlo, V. M., Reis, R. L., Kundu, S. C. Could 3D models of cancer enhance drug screening. Biomaterials. 232, 119744 (2020).
- Pinto, B., Henriques, A. C., Silva, P. M. A., Bousbaa, H. Three-dimensional spheroids as in vitro preclinical models for cancer research. Pharmaceutics. 12 (12), 1186 (2020).
- Fitzgerald, A. A., Li, E., Weiner, L. M. 3D culture systems for exploring cancer immunology. Cancers (Basel). 13 (1), 56 (2020).
- Zanoni, M., et al. 3D tumor spheroid models for in vitro therapeutic screening: A systematic approach to enhance the biological relevance of data obtained. Sci Rep. 6, 19103 (2016).
- Boucherit, N., Gorvel, L., Olive, D. 3D tumor models and their use for the testing of immunotherapies. Front Immunol. 11, 603640 (2020).
- Li, Y., et al. Recent progress on immunotherapy for breast cancer: Tumor microenvironment, nanotechnology and more. Front Bioeng Biotechnol. 9, 680315 (2021).
- Lo Nigro, C., et al. NK-mediated antibody-dependent cell-mediated cytotoxicity in solid tumors: Biological evidence and clinical perspectives. Ann Transl Med. 7 (5), 105 (2019).
- Sun, Y. S., et al. Risk factors and preventions of breast cancer. Int J Biol Sci. 13 (11), 1387-1397 (2017).
- Liu, P. H., Wei, J. C., Wang, Y. H., Yeh, M. H. Female breast cancer incidence predisposing risk factors identification using nationwide big data: A matched nested case-control study in taiwan. BMC Cancer. 22 (1), 849 (2022).
- Burguin, A., Diorio, C., Durocher, F. Breast cancer treatments: Updates and new challenges. J Pers Med. 11 (8), 808 (2021).
- Costa, R. L. B., Czerniecki, B. J. Clinical development of immunotherapies for HER2(+) breast cancer: A review of HER2-directed monoclonal antibodies and beyond. NPJ Breast Cancer. 6, 10 (2020).
- Musolino, A., et al. Role of fcgamma receptors in HER2-targeted breast cancer therapy. J Immunother Cancer. 10 (1), e003171 (2022).
- Petricevic, B., et al. Trastuzumab mediates antibody-dependent cell-mediated cytotoxicity and phagocytosis to the same extent in both adjuvant and metastatic HER2/NEU breast cancer patients. J Transl Med. 11, 307 (2013).
- Guti, E., et al. The multitargeted receptor tyrosine kinase inhibitor sunitinib induces resistance of HER2 positive breast cancer cells to Trastuzumab-mediated ADCC. Cancer Immunol Immunother. 71 (9), 2151-2168 (2022).
- Barok, M., et al. Trastuzumab decreases the number of circulating and disseminated tumor cells despite Trastuzumab resistance of the primary tumor. Cancer Lett. 260 (1-2), 198-208 (2008).
- Toth, G., et al. The combination of Trastuzumab and Pertuzumab administered at approved doses may delay development of Trastuzumab resistance by additively enhancing antibody-dependent cell-mediated cytotoxicity. MAbs. 8 (7), 1361-1370 (2016).
- Ehlers, F. a. I., et al. ADCC-inducing antibody Trastuzumab and selection of KIR-HLA ligand mismatched donors enhance the NK cell anti-breast cancer response. Cancers (Basel). 13 (13), 3232 (2021).
- Gangadhara, S., Smith, C., Barrett-Lee, P., Hiscox, S. 3d culture of Her2+ breast cancer cells promotes AKT to MAPK switching and a loss of therapeutic response. BMC Cancer. 16, 345 (2016).
- Balalaeva, I. V., Sokolova, E. A., Puzhikhina, A. D., Brilkina, A. A., Deyev, S. M. Spheroids of Her2-positive breast adenocarcinoma for studying anticancer immunotoxins in vitro. Acta Naturae. 9 (1), 38-43 (2017).
- Selis, F., et al. Pegylated Trastuzumab fragments acquire an increased in vivo stability but show a largely reduced affinity for the target antigen. Int J Mol Sci. 17 (4), 491 (2016).
- Johnston, R. L., et al. High content screening application for cell-type specific behaviour in heterogeneous primary breast epithelial subpopulations. Breast Cancer Res. 18 (1), 18 (2016).
- Kandaswamy, C., Silva, L. M., Alexandre, L. A., Santos, J. M. High-content analysis of breast cancer using single-cell deep transfer learning. J Biomol Screen. 21 (3), 252-259 (2016).
- Esquer, H., Zhou, Q., Abraham, A. D., Labarbera, D. V. Advanced high-content-screening applications of clonogenicity in cancer. SLAS Discov. 25 (7), 734-743 (2020).
- Pickl, M., Ries, C. H. Comparison of 3D and 2D tumor models reveals enhanced Her2 activation in 3D associated with an increased response to trastuzumab. Oncogene. 28 (3), 461-468 (2009).

