Kvantifisering av antistoffavhengig cellulær cytotoksisitet i en tumorsfæroidmodell: Søknad om legemiddeloppdagelse
Summary
Her presenterer vi en metode for å identifisere forbindelser som modulerer ADCC-mekanismen, en viktig kreftcelledrepende mekanisme for antitumorantistoffer. Den cytotoksiske effekten av NK-celler måles i brystkreftcellesfæroider i nærvær av trastuzumab. Bildeanalyse identifiserer levende og døde morder- og målceller i sfæroider.
Abstract
Monoklonal antistoffbasert immunterapi rettet mot tumorantigener er nå en bærebjelke i kreftbehandling. En av de klinisk relevante virkningsmekanismene til antistoffene er antistoffavhengig cellulær cytotoksisitet (ADCC), hvor antistoffet binder seg til kreftcellene og engasjerer den cellulære komponenten i immunsystemet, f.eks. naturlige dreperceller (NK), for å drepe tumorcellene. Effektiviteten av disse terapiene kan forbedres ved å identifisere adjuvante forbindelser som øker følsomheten til kreftcellene eller immuncellens styrke. I tillegg kan uoppdagede legemiddelinteraksjoner hos kreftpasienter medmedisinert for tidligere forhold eller kreftassosierte symptomer bestemme suksessen til antistoffbehandlingen; Derfor må slike uønskede legemiddelinteraksjoner elimineres. Med disse målene i tankene opprettet vi en kreft-ADCC-modell og beskriver her en enkel protokoll for å finne ADCC-modulerende legemidler. Siden 3D-modeller som kreftcelle sfæroider er overlegne 2D-kulturer i å forutsi in vivo-responser av svulster til kreftbehandlinger, sfæroide samkulturer av EGFP-uttrykkende HER2 + JIMT-1 brystkreftceller og NK92. CD16-cellelinjer ble satt opp og indusert med trastuzumab, et monoklonalt antistoff klinisk godkjent mot HER2-positiv brystkreft. JIMT-1 sfæroider fikk lov til å dannes i celleavvisende U-bunn 96-brønnplater. Dag 3 ble NK-celler og trastuzumab lagt til. Sfæroidene ble deretter farget med vedlegg V-Alexa 647 for å måle apoptotisk celledød, som ble kvantifisert i den perifere sonen til sfæroidene med et automatisert mikroskop. Anvendeligheten av vår analyse for å identifisere ADCC-modulerende molekyler er demonstrert ved å vise at Sunitinib, en reseptortyrosinkinasehemmer godkjent av FDA mot metastatisk kreft, nesten helt avskaffer ADCC. Genereringen av sfæroider og bildeinnsamlings- og analyserørledninger er kompatible med høy gjennomstrømningsscreening for ADCC-modulerende forbindelser i kreftcellesfæroider.
Introduction
Multicellulære tumorsfæroider (MCTS) er mye brukte tredimensjonale (3D) modeller som dannes på grunn av tendensen til adherente celler til å aggregere og representerer et viktig verktøy for å få mekanistisk innsikt i kreftcellebiologi. De kan genereres fra et bredt spekter av celletyper ved hjelp av en rekke teknikker, for eksempel væskebaserte og stillasbaserte 3D-kulturer1. Deres største fordel i forhold til monolayer 2D-modeller er at de rekapitulerer hovedtrekkene til in vivo-svulster , nemlig strukturell organisasjon og hypoksi, ved å etterligne den biologiske oppførselen til tumorceller, spesielt mekanismene som fører til terapeutisk rømning og stoffresistens2. Siden MCTS kan forbedre forutsigbarheten av toksisitet og legemiddelfølsomhet, er de mye brukt til å studere kreft i 3D og kan forbedre utviklingen av effektive medisiner for ulike typer kreft3.
For å studere noen sykdom er det et kritisk behov for relevante og praktiske modeller. Å sette opp modeller for kreftimmunologistudier er utfordrende fordi immunsystemet består av flere celletyper. Hver celletype har flere undertyper og et bredt spekter av aktiveringstilstander. Disse forskjellige immuncelletypene samhandler med kreftceller og andre tumorkomponenter, og påvirker til slutt utfallet av sykdommen. 2D in vitro cellekulturmetoder klarer ikke å rekapitulere disse komplekse cellulære interaksjonene, da de mangler oversettbarhet og ikke er i stand til å forutsi virkningen av et legemiddel på systemnivå (f.eks. i vev)4,5. Videre har musemodeller også alvorlige begrensninger på grunn av de grunnleggende forskjellene mellom menneskets og murine immunsystem. 3D-kultursystemer kan derfor fylle de nåværende hullene i tilgjengelige modeller, gi en alternativ metode og forbedre vår forståelse av kreftimmunologi6. Spesielt kan sfæroidmodeller brukes til å teste immunterapier, hovedsakelig for å vurdere effektiviteten av legemiddelscreening og terapeutiske antistoffer for å øke immuncelleinfiltrasjon og antitumorale effekter mot sfæroidmålene7. Videre har potensialet til MCTS sammensatt av celler i forskjellige metabolske og proliferative tilstander for å studere interaksjonene mellom stromaceller (f.eks. lymfocytter, makrofager, fibroblaster) og kreftceller og for utvikling av nye anticancerstrategier blitt rikelig demonstrert8. Derfor er det et viktig behov for å bekrefte prediktive og nøyaktige plattformer for å øke stofftestingsprosessen, med tanke på patofysiologien til tumormikromiljøet.
Brystkreft (BC) er den hyppigste kreftdiagnosen over hele verden hos kvinner. Den kliniske klassifiseringen av denne heterogene sykdommen er basert på tilstedeværelsen av transmembranreseptorer, f.eks. østrogen (ER) og progesteron (PR) reseptorer (kollektivt kalt hormonreseptorer, HR) sammen med overekspresjon eller amplifisering av det humane epidermale vekstfaktorreseptor 2 (HER2) proteinet / onkogenet. Basert på immunhistokjemisk ekspresjon av disse reseptorene, er fire subtyper ofte anerkjent: luminal A (HR + / HER2-), luminal B (HR + / HER2 +), HER2-positiv (HR-/HER2 +) og trippel-negativ brystkreft (HR-/HER2-). HER2 + -gruppen utgjør 10-15% av BC-tilfellene og er preget av høyt HER2-uttrykk med fravær av ER og PR, har en dårligere prognose sammenlignet med luminale svulster, og krever spesifikke legemidler rettet mot HER2 / neu-proteinet9.
BC-utvikling er en multi-trinns prosess, og en tidlig diagnose er avgjørende for en vellykket behandling av sykdommen10. Til tross for nylig oppstått personlige BC-behandlingsalternativer (f.eks. Endokrine og anti-HER2 antistoffbehandlinger), fortsetter BC å utfordre onkologer. Akkurat som kirurgi, kjemoterapi og strålebehandling, kan disse personlige terapiene også ha alvorlige bivirkninger, og pasienter kan utvikle motstand mot disse midlene, noe som gjør det til en langsiktig utfordring å bestemme den beste strategien11,12. Derfor er forbedret forståelse av samspillet mellom svulsten og dens mikromiljø viktig og forventes å gi nye retninger for utvikling av nye behandlinger som tar hensyn til spesifisitetene til de forskjellige BC-subtypene13. En ny bølge av immunterapier, som antistoffmedikamentkonjugater, adoptive T-celleterapier, vaksiner og nye HER2-rettede monoklonale antistoffer (mAbs) blir studert i en bred populasjon av pasienter med HER2-uttrykkende svulster14.
Trastuzumab representerer for eksempel en effektiv behandlingsmodalitet for HER2+ BC. Som en del av virkemåten medierer trastuzumab fragmentkrystalliserbar gammareseptor (FcγR)-avhengige aktiviteter. FcγRs utmerker seg ved deres affinitet for Fc-fragmentet og immunresponsen de initierer. Aktivering av FcγRIIIa (CD16A) på naturlige dreperceller (NK) er avgjørende for å formidle antistoffavhengig cellulær cytotoksisitet (ADCC), mens utløsing av FcγRIIa (CD32A) og FcγRIIIa på makrofager induserer antistoffavhengig cellulær fagocytose (ADCP)15. Studier på dyremodeller viste at mus som manglet FcγRI (CD64) og FcγRIII (CD16) reseptorer ikke var i stand til å initiere beskyttende immunresponser mot tumorspesifikke antigener, noe som avslørte at ADCC sannsynligvis er en viktig virkningsmekanisme for mAb trastuzumab16.
Siden NK-celler tyr til tumorcellebundet Abs for kreftcelledrap ved ADCC, er ekspresjon av Fc-reseptorer avgjørende for effektiv behandling med trastuzumab17 (figur 1). Videre er deres virkning effektivt balansert av en stimulering av aktiverende og hemmende reseptorer, for eksempel Killer-celle immunoglobulinlignende (KIR) reseptorer18.
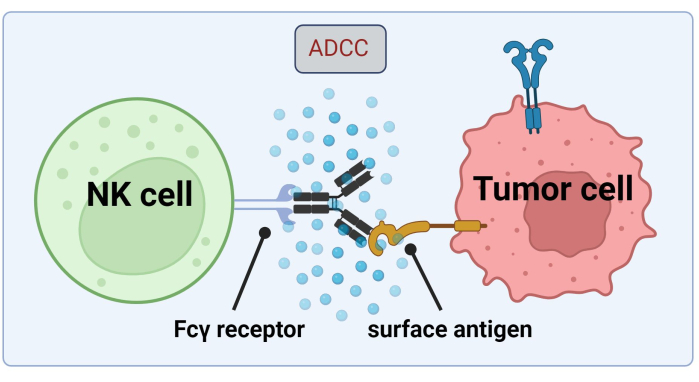
Figur 1. Mekanisme for ADCC i sammenheng med en antitumorrespons. Fcγ-reseptoren til en naturlig drepercelle (NK) gjenkjenner Fc-regionen av et antistoff, som tidligere hadde bundet seg til et overflateantigen på en kreftcelle. Denne immunologiske synapsen fører til degranulering av NK-cellen som frigjør cytotoksiske mediatorer som granzymer og perforin. Disse molekylene bidrar til poredannelse i cellemembranen og aktiverer apoptotiske veier som forårsaker programmert celledød av målcellen (bilde opprettet med Biorender.com). Klikk her for å se en større versjon av denne figuren.
Immunterapiutvikling for HER2+ BC representerer et felt i utvikling. I dette tilfellet bør man vurdere interaksjoner mellom ulike komponenter i immunsystemet. Videre har tidligere publikasjoner omfattende testet kombinasjonsterapier som involverer alle typer tradisjonelle, immun- eller celleterapier for å identifisere synergiserende kombinasjoner19.
Flere 3D-modeller av HER2+ BC har tidligere blitt brukt til oppdagelse av legemidler. For eksempel brukte Balalaeva et al. SKBR-3 sfæroider som overuttrykker HER2 for å vurdere cytotoksisiteten til det HER2-målrettede immuntoksinet 4D5scFv-PE4020. I en annen studie ble et 3D Matrigel-basert HER2 + BC-kultursystem etablert for å måle cellevekst som respons på trastuzumab og endokrine midler21. Disse studiene fremhever viktigheten av tumorsfæroidmodeller av HER2 som overuttrykker kreftceller i å representere en effektiv strategi for klinisk å forbedre terapeutiske responser22.
Vår gruppe identifiserte tidligere Sunitinib, en multimålrettet tyrosinkinasehemmer, som en hemmer av trastuzumabavhengig ADCC i JIMT-1 HER2+ BC-celler i en 2D-kulturanalyse. Studien viste at Sunitinib induserer autofagi og svekker NK-cellenes drapsfunksjon, nedregulerer HER2-uttrykk og forbedrer overflatefeste av JIMT-1-celler17.
Her etablerte vi en ny 3D, sfæroid ADCC-modell (NK.92.CD16+Trastuzumab+JIMT-1-EGFP kreftceller) som skulle brukes til screeningapplikasjoner med høy gjennomstrømning, og for å validere de ovennevnte funnene ble Sunitinib brukt som modellforbindelse. Først genererte vi EGFP som uttrykker JIMT-1-celler17 og vokste sfæroider fra disse cellene. ADCC ble indusert av NK-celler sammen med trastuzumab, og sfæroider ble holdt i kultur i nærvær eller fravær av testforbindelser i 24 timer (figur 2). Kvantifisering av ADCC er basert på påvisning av apoptotisk kreftcelledød (Annexin V-farging) ved hjelp av et analysesystem med høyt innhold.
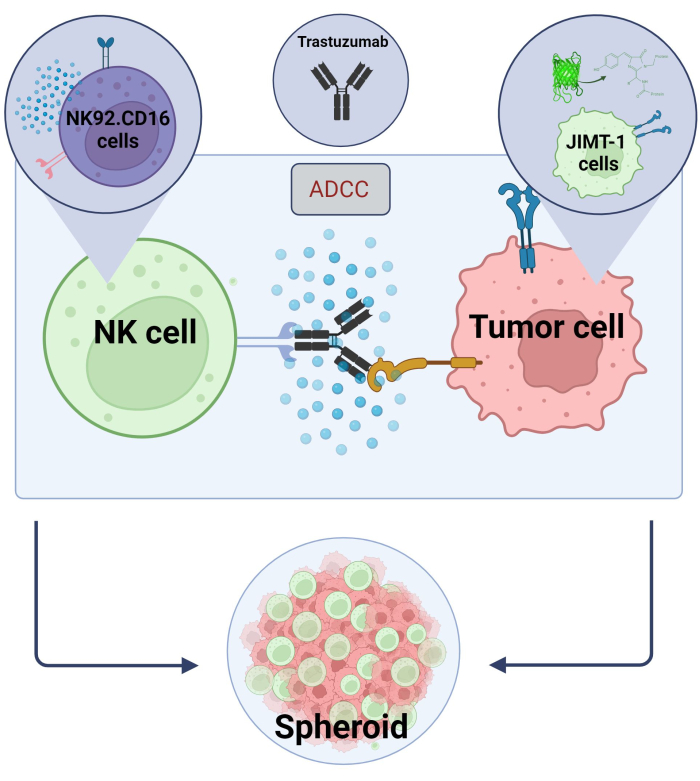
Figur 2. ADCC i et 3D sfæroid samkultursystem. Våre eksperimentelle innstillinger er basert på et 3D sfæroidsystem som mer nøyaktig kan modellere in vivo mikromiljøet sammenlignet med 2D-modeller. JIMT-1 EGFP brystkreftceller ble sådd på en konkav celleavstøtende bunn for å danne en rundformet cellulær klynge, kalt sfæroid. ADCC ble deretter initiert ved å legge til NK92. CD16 naturlige dreperceller (E:T-forhold = 20:1) og et anti-HER2 monoklonalt antistoff, trastuzumab. Den eksperimentelle modellen har vist seg effektiv og lett anvendelig for identifisering av ADCC-modifiserende testforbindelser (bilde laget med Biorender.com). Klikk her for å se en større versjon av denne figuren.
Vi demonstrerte at innsamling av data på denne måten kan gjøres i sanntid og er statistisk robust for bruk i screening med høyt innhold i kreftmedisinoppdagelse. Det er viktig at denne modellen tillater en utvidet validering av et større sett med forbindelser, og den kan brukes på flere analyser av interesse.
Protocol
Representative Results
Discussion
Til tross for betydelige forbedringer i behandling av BC de siste tiårene, utvikler pasienter fortsatt regelmessig medisineringsresistens eller opplever negative bivirkninger24. Den høye morbiditeten og dødeligheten knyttet til BC krever en kontinuerlig undersøkelse av de underliggende molekylære mekanismene, akkurat som robuste screeningplattformer for å identifisere nye molekyler som kan brukes til terapeutisk utvikling25. Disse strategiene krever cellekulturbaserte…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
LV mottok finansiering fra National Research, Development and Innovation Office tilskudd GINOP-2.3.2-15-2016-00010 TUMORDNS”, GINOP-2.3.2-15-2016-00048-STAYALIVE, OTKA K132193 og K147482. Dette prosjektet har mottatt finansiering fra HUN-REN ungarske forskningsnettverk. CD16.176V.NK-92 celler ble hentet fra Dr. Kerry S. Campbell (Fox Chase Center, Philadelphia, PA, på vegne av Brink Biologics, lnc. San Diego, CA), er beskyttet av patenter over hele verden, og ble lisensiert av Nantkwest, lnc. (www.nantkwest.com). Forfatterne takker György Vereb og Árpád Szöőr for deres hjelp med bruken av NK-92-cellelinjen og TR-F(ab’)2, og for teknisk rådgivning.
Materials
| 96-well glass bottom Cell Carrier Ultra microplates | PerkinElmer, Waltham, MA, USA | LLC 6055302 | for spheroids measurements |
| 96-well tissue culture plates | TPP | 92096 | for cell seeding |
| α-MEM medium | Sigma | M8042 | in NK medium |
| Agarose | Sigma | A9539 | for spheroids seeding |
| Annexin V-Alexa Fluo 647 conjugate | Invitrogen-ThermoFisher Scientific | A23204 | for apoptosis measurement with HCS |
| CD16.176 V.NK-92 cells | Dr. Kerry S. Campbell (the Fox Chase Cancer Center, Philadelphia, PA on behalf of Brink Biologics, Inc. San Diego, CA) | ATCC CRL-2407 | for cell culture |
| Cell Tracker Blue | Invitrogen-Thermo Scientific, Waltham, MA, USA) | C2110 | for staining of NK cells |
| DMEM/F-12 medium | Sigma | D8437 | in JIMT1-EGFP medium |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418 | for coating HCS plate before transfering the spheroids |
| Fetal bovine serum (FBS) | Biosera | FB-1090/500 | JIMT-1-EGFP and NK medium |
| Glutamine | Gibco | 35,050–061 | in NK medium |
| GraphPad Prism 8.0.1 | GraphPad Software Inc., San Diego, CA, USA | for statistical analysis | |
| Harmony software | PerkinElmer, Waltham, MA, USA | for HCA | |
| IL-2 | Proleukin, Novartis Hungária Kft., Budapest, Hungary | PHC0026 | in NK medium |
| Insulin (Humulin R) | Eli Lilly | HI0219 | JIMT-1-EGFP medium |
| JIMT-1 breast cancer cells | for cell culture | ||
| MEM Non-essential Amino Acids (MEM-NEAA) | Gibco | 11,140–050 | in NK medium |
| Na-pyruvate | Lonza | BE13-115E | in NK medium |
| Opera Phenix High-Content Analysis equipment | PerkinElmer, Waltham, MA, USA | HH14001000 | for HCA |
| PBS (Posphate buffered saline) | Lonza | BE17-517Q | for washing the cells |
| Penicillin-Streptomycin | Biosera | LM-A4118 | JIMT-1-EGFP and NK medium |
| pLP-1, pLP-2, pLP-VSV-G, pWOXEGFP | Invitrogen, (Prof. József T zsér, University of Debrecen) zsér, University of Debrecen) |
for JIMT-1-EGFP cell line | |
| Pluronic-F127 | Sigma | P2443 | for coating HCS plate before transfering the spheroids |
| Sunitinib malate | SigmaAldrich | PZ0012 | for treatments |
| Trastuzumab Ab (humanized anti-HER2 monoclonal antibody) | Herzuma®, EGIS Pharmaceuticals, Budapest, Hungary | NDC-63459-303-43 | for treatments |
| Trastuzumab-F(ab')2 | Gift from Prof. György Vereb and Árpád Szö r r |
Department of Biophysics and Cell Biology, University of Debrecen | for treatments |
| Trypan blue 0.4% solution | Sigma | T8154 | for cell counting |
| Trypsin-EDTA 1X in PBS | Biosera | LM-T1706 | for cells detachment |
Riferimenti
- Jubelin, C., et al. Three-dimensional in vitro culture models in oncology research. Cell Biosci. 12 (1), 155 (2022).
- Mittler, F., et al. High-content monitoring of drug effects in a 3D spheroid model. Front Oncol. 7, 293 (2017).
- Badr-Eldin, S. M., Aldawsari, H. M., Kotta, S., Deb, P. K., Venugopala, K. N. Three-dimensional in vitro cell culture models for efficient drug discovery: Progress so far and future prospects. Pharmaceuticals (Basel). 15 (8), 926 (2022).
- Brancato, V., Oliveira, J. M., Correlo, V. M., Reis, R. L., Kundu, S. C. Could 3D models of cancer enhance drug screening. Biomaterials. 232, 119744 (2020).
- Pinto, B., Henriques, A. C., Silva, P. M. A., Bousbaa, H. Three-dimensional spheroids as in vitro preclinical models for cancer research. Pharmaceutics. 12 (12), 1186 (2020).
- Fitzgerald, A. A., Li, E., Weiner, L. M. 3D culture systems for exploring cancer immunology. Cancers (Basel). 13 (1), 56 (2020).
- Zanoni, M., et al. 3D tumor spheroid models for in vitro therapeutic screening: A systematic approach to enhance the biological relevance of data obtained. Sci Rep. 6, 19103 (2016).
- Boucherit, N., Gorvel, L., Olive, D. 3D tumor models and their use for the testing of immunotherapies. Front Immunol. 11, 603640 (2020).
- Li, Y., et al. Recent progress on immunotherapy for breast cancer: Tumor microenvironment, nanotechnology and more. Front Bioeng Biotechnol. 9, 680315 (2021).
- Lo Nigro, C., et al. NK-mediated antibody-dependent cell-mediated cytotoxicity in solid tumors: Biological evidence and clinical perspectives. Ann Transl Med. 7 (5), 105 (2019).
- Sun, Y. S., et al. Risk factors and preventions of breast cancer. Int J Biol Sci. 13 (11), 1387-1397 (2017).
- Liu, P. H., Wei, J. C., Wang, Y. H., Yeh, M. H. Female breast cancer incidence predisposing risk factors identification using nationwide big data: A matched nested case-control study in taiwan. BMC Cancer. 22 (1), 849 (2022).
- Burguin, A., Diorio, C., Durocher, F. Breast cancer treatments: Updates and new challenges. J Pers Med. 11 (8), 808 (2021).
- Costa, R. L. B., Czerniecki, B. J. Clinical development of immunotherapies for HER2(+) breast cancer: A review of HER2-directed monoclonal antibodies and beyond. NPJ Breast Cancer. 6, 10 (2020).
- Musolino, A., et al. Role of fcgamma receptors in HER2-targeted breast cancer therapy. J Immunother Cancer. 10 (1), e003171 (2022).
- Petricevic, B., et al. Trastuzumab mediates antibody-dependent cell-mediated cytotoxicity and phagocytosis to the same extent in both adjuvant and metastatic HER2/NEU breast cancer patients. J Transl Med. 11, 307 (2013).
- Guti, E., et al. The multitargeted receptor tyrosine kinase inhibitor sunitinib induces resistance of HER2 positive breast cancer cells to Trastuzumab-mediated ADCC. Cancer Immunol Immunother. 71 (9), 2151-2168 (2022).
- Barok, M., et al. Trastuzumab decreases the number of circulating and disseminated tumor cells despite Trastuzumab resistance of the primary tumor. Cancer Lett. 260 (1-2), 198-208 (2008).
- Toth, G., et al. The combination of Trastuzumab and Pertuzumab administered at approved doses may delay development of Trastuzumab resistance by additively enhancing antibody-dependent cell-mediated cytotoxicity. MAbs. 8 (7), 1361-1370 (2016).
- Ehlers, F. a. I., et al. ADCC-inducing antibody Trastuzumab and selection of KIR-HLA ligand mismatched donors enhance the NK cell anti-breast cancer response. Cancers (Basel). 13 (13), 3232 (2021).
- Gangadhara, S., Smith, C., Barrett-Lee, P., Hiscox, S. 3d culture of Her2+ breast cancer cells promotes AKT to MAPK switching and a loss of therapeutic response. BMC Cancer. 16, 345 (2016).
- Balalaeva, I. V., Sokolova, E. A., Puzhikhina, A. D., Brilkina, A. A., Deyev, S. M. Spheroids of Her2-positive breast adenocarcinoma for studying anticancer immunotoxins in vitro. Acta Naturae. 9 (1), 38-43 (2017).
- Selis, F., et al. Pegylated Trastuzumab fragments acquire an increased in vivo stability but show a largely reduced affinity for the target antigen. Int J Mol Sci. 17 (4), 491 (2016).
- Johnston, R. L., et al. High content screening application for cell-type specific behaviour in heterogeneous primary breast epithelial subpopulations. Breast Cancer Res. 18 (1), 18 (2016).
- Kandaswamy, C., Silva, L. M., Alexandre, L. A., Santos, J. M. High-content analysis of breast cancer using single-cell deep transfer learning. J Biomol Screen. 21 (3), 252-259 (2016).
- Esquer, H., Zhou, Q., Abraham, A. D., Labarbera, D. V. Advanced high-content-screening applications of clonogenicity in cancer. SLAS Discov. 25 (7), 734-743 (2020).
- Pickl, M., Ries, C. H. Comparison of 3D and 2D tumor models reveals enhanced Her2 activation in 3D associated with an increased response to trastuzumab. Oncogene. 28 (3), 461-468 (2009).

