Kvantifiering av antikroppsberoende cellulär cytotoxicitet i en tumörsfäroidmodell: Ansökan om läkemedelsutveckling
Summary
Här presenterar vi en metod för att identifiera substanser som modulerar ADCC-mekanismen, en viktig cancercellsdödande mekanism för antitumörantikroppar. Den cytotoxiska effekten av NK-celler mäts i sfäroider av bröstcancerceller i närvaro av Trastuzumab. Bildanalys identifierar levande och döda mördar- och målceller i sfäroider.
Abstract
Monoklonal antikroppsbaserad immunterapi riktad mot tumörantigener är nu en grundpelare i cancerbehandlingen. En av de kliniskt relevanta verkningsmekanismerna för antikropparna är antikroppsberoende cellulär cytotoxicitet (ADCC), där antikroppen binder till cancercellerna och engagerar den cellulära komponenten i immunsystemet, t.ex. naturliga mördarceller (NK-celler), för att döda tumörcellerna. Effekten av dessa terapier skulle kunna förbättras genom att identifiera adjuvansföreningar som ökar cancercellernas känslighet eller immuncellernas styrka. Dessutom kan oupptäckta läkemedelsinteraktioner hos cancerpatienter som sammedicinerats för tidigare tillstånd eller cancerrelaterade symtom avgöra framgången för antikroppsbehandlingen. Därför måste sådana oönskade läkemedelsinteraktioner elimineras. Med dessa mål i åtanke skapade vi en cancer-ADCC-modell och beskriver här ett enkelt protokoll för att hitta ADCC-modulerande läkemedel. Eftersom 3D-modeller som cancercellssfäroider är överlägsna 2D-kulturer när det gäller att förutsäga in vivo-svar av tumörer på anticancerterapier, sfäroida samkulturer av EGFP-uttryckande HER2+ JIMT-1 bröstcancerceller och NK92. CD16-cellinjer sattes upp och inducerades med Trastuzumab, en monoklonal antikropp som är kliniskt godkänd mot HER2-positiv bröstcancer. JIMT-1-sfäroider tilläts bildas i cellavvisande U-bottenplattor med 96 brunnar. På dag 3 tillsattes NK-celler och Trastuzumab. Sfäroiderna färgades sedan med Annexin V-Alexa 647 för att mäta apoptotisk celldöd, som kvantifierades i sfäroidernas perifera zon med ett automatiserat mikroskop. Användbarheten av vår analys för att identifiera ADCC-modulerande molekyler visas genom att visa att Sunitinib, en receptortyrosinkinashämmare som godkänts av FDA mot metastaserande cancer, nästan helt avskaffar ADCC. Genereringen av sfäroiderna och bildinsamlings- och analyspipelines är kompatibla med screening med hög genomströmning för ADCC-modulerande föreningar i cancercellssfäroider.
Introduction
Multicellulära tumörsfäroider (MCTS) är allmänt använda tredimensionella (3D) modeller som bildas på grund av tendensen hos vidhäftande celler att aggregera och representerar ett viktigt verktyg för att få mekanistisk insikt i cancercellbiologi. De kan genereras från ett brett spektrum av celltyper med hjälp av många tekniker, såsom vätskebaserade och ställningsbaserade 3D-kulturer1. Deras främsta fördel jämfört med monolager 2D-modeller är att de rekapitulerar huvuddragen i in vivo-tumörer , nämligen strukturell organisation och hypoxi, genom att efterlikna tumörcellernas biologiska beteende, särskilt de mekanismer som leder till terapeutisk flykt och läkemedelsresistens2. Eftersom MCTS kan förbättra förutsägbarheten av toxicitet och läkemedelskänslighet används de i stor utsträckning för att studera cancer i 3D och kan förbättra utvecklingen av effektiva läkemedel för olika typer av cancer3.
För att studera alla sjukdomar finns det ett kritiskt behov av relevanta och praktiska modeller. Att sätta upp modeller för cancerimmunologiska studier är utmanande eftersom immunsystemet består av flera celltyper. Varje celltyp har flera subtyper och ett brett spektrum av aktiveringstillstånd. Dessa olika typer av immunceller interagerar med cancerceller och andra tumörkomponenter, vilket i slutändan påverkar resultatet av sjukdomen. 2D in vitro cellodlingsmetoder misslyckas med att rekapitulera dessa komplexa cellulära interaktioner, eftersom de saknar översättbarhet och inte kan förutsäga effekten av ett läkemedel på systemnivå (t.ex. i vävnader)4,5. Dessutom har musmodeller också allvarliga begränsningar på grund av de grundläggande skillnaderna mellan det mänskliga och murina immunsystemet. 3D-odlingssystem kan därför fylla de nuvarande luckorna i tillgängliga modeller, tillhandahålla en alternativ metod och förbättra vår förståelse av cancerimmunologi6. Specifikt kan sfäroidmodeller användas för att testa immunterapier, främst för att bedöma effektiviteten av läkemedelsscreening och terapeutiska antikroppar för att förbättra immuncellsinfiltration och antitumöreffekter mot sfäroidmålen7. Dessutom har potentialen hos MCTS som består av celler i olika metaboliska och proliferativa tillstånd att studera interaktionerna mellan stromaceller (t.ex. lymfocyter, makrofager, fibroblaster) och cancerceller och för utveckling av nya anticancerstrategier mer än väl visats8. Därför finns det ett stort behov av att bekräfta prediktiva och exakta plattformar för att öka läkemedelstestningsprocessen, med hänsyn till patofysiologin i tumörmikromiljön.
Bröstcancer är den vanligaste cancerformen som diagnostiseras hos kvinnor i världen. Den kliniska klassificeringen av denna heterogena sjukdom baseras på närvaron av transmembranreceptorer, t.ex. östrogenreceptorer (ER) och progesteronreceptorer (PR) (kollektivt kallade hormonreceptorer, HR) tillsammans med överuttryck eller amplifiering av det humana epidermala tillväxtfaktorreceptorn 2 (HER2)-protein/onkogen. Baserat på det immunhistokemiska uttrycket av dessa receptorer är fyra subtyper allmänt erkända: luminal A (HR+/HER2-), luminal B (HR+/HER2+), HER2-positiv (HR-/HER2+) och trippelnegativ bröstcancer (HR-/HER2-). HER2+-gruppen utgör 10-15% av BC-fallen och kännetecknas av högt HER2-uttryck med frånvaro av ER och PR, har en sämre prognos jämfört med luminala tumörer och kräver specifika läkemedel riktade mot HER2/neu-proteinet9.
BC-utveckling är en process i flera steg, och en tidig diagnos är avgörande för en framgångsrik behandling av sjukdomen10. Men trots nyligen framkomna personliga BC-behandlingsalternativ (t.ex. endokrina och anti-HER2-antikroppsterapier) fortsätter BC att utmana onkologer. Precis som kirurgi, kemoterapi och strålbehandling kan dessa personliga terapier också ha allvarliga biverkningar och patienter kan utveckla resistens mot dessa medel, vilket gör det till en långsiktig utmaning att bestämma den bästa strategin11,12. Därför är förbättrad förståelse av samspelet mellan tumören och dess mikromiljö avgörande och förväntas ge nya riktningar för utvecklingen av nya behandlingar som tar hänsyn till särdragen hos de olika BC-subtyperna13. En ny våg av immunterapier, såsom antikroppskonjugat, adoptiva T-cellsterapier, vacciner och nya HER2-riktade monoklonala antikroppar (mAbs) studeras i en bred population av patienter med HER2-uttryckandetumörer14.
Trastuzumab, till exempel, representerar en effektiv behandlingsmodalitet för HER2+ BC. Som en del av sin verkningsmekanism medierar trastuzumab fragmentkristalliserbara gammareceptorer (FcγR)-beroende aktiviteter. FcγR kännetecknas av sin affinitet för Fc-fragmentet och det immunsvar de initierar. Aktivering av FcγRIIIa (CD16A) på naturliga mördarceller (NK) är avgörande för att mediera antikroppsberoende cellulär cytotoxicitet (ADCC), medan triggning av FcγRIIa (CD32A) och FcγRIIIa på makrofager inducerar antikroppsberoende cellulär fagocytos (ADCP)15. Studier på djurmodeller visade att möss som saknade FcγRI (CD64) och FcγRIII (CD16) receptorer inte kunde initiera skyddande immunsvar mot tumörspecifika antigener, vilket avslöjar att ADCC sannolikt är en viktig verkningsmekanism för mAb Trastuzumab16.
Eftersom NK-celler tillgriper tumörcellsbundna Abs för cancercellsdödande genom ADCC, är uttryck av Fc-receptorer avgörande för en effektiv behandling med Trastuzumab17 (Figur 1). Dessutom balanseras deras verkan effektivt av en stimulering av aktiverande och hämmande receptorer, t.ex. Killer-cell immunoglobulin-like (KIR) receptorer18.
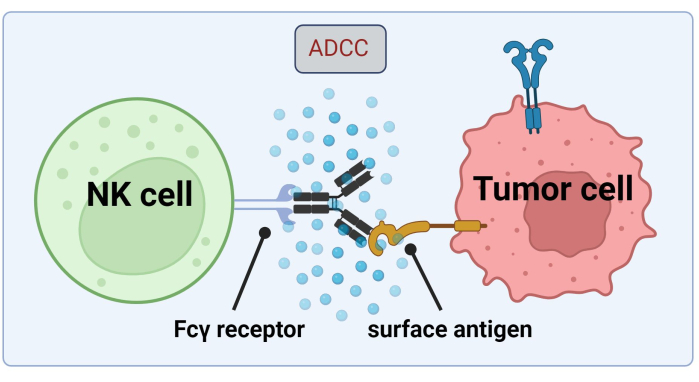
Figur 1. Mekanism för ADCC i samband med ett antitumörsvar. Fcγ-receptorn i en naturlig mördarcell (NK) känner igen Fc-regionen hos en antikropp, som tidigare hade bundit till ett ytantigen på en cancercell. Denna immunologiska synaps leder till degranulering av NK-cellen, vilket frisätter cytotoxiska mediatorer som granzymer och perforin. Dessa molekyler bidrar till porbildning i cellmembranet och aktiverar apoptotiska vägar som orsakar programmerad celldöd i målcellen (bild skapad med Biorender.com). Klicka här för att se en större version av denna figur.
Immunterapiutveckling för HER2+ BC representerar ett område under utveckling. I det här fallet bör man överväga interaktioner mellan olika komponenter i immunsystemet. Dessutom har tidigare publikationer i stor utsträckning testat kombinationsterapier som involverar alla typer av traditionella, immun- eller cellterapier för att identifiera synergiserande kombinationer19.
Flera 3D-modeller av HER2+ BC har tidigare använts för läkemedelsutveckling. Till exempel använde Balalaeva et al. SKBR-3-sfäroider som överuttrycker HER2 för att bedöma cytotoxiciteten hos det HER2-riktade immuntoxinet 4D5scFv-PE4020. I en annan studie etablerades ett 3D Matrigel-baserat HER2+ BC-odlingssystem för att mäta celltillväxt som svar på trastuzumab och endokrina medel21. Dessa studier belyser vikten av tumörsfäroidmodeller av HER2-överuttryckande cancerceller för att representera en effektiv strategi för att kliniskt förbättra terapeutiska svar22.
Vår grupp har tidigare identifierat Sunitinib, en multiriktad tyrosinkinashämmare, som en hämmare av Trastuzumab-beroende ADCC i JIMT-1 HER2+ BC-celler i en 2D-odlingsanalys. Studien visade att Sunitinib inducerar autofagi och försämrar NK-cellernas dödande funktion, nedreglerar HER2-uttrycket och förbättrar ytbindningen av JIMT-1-celler17.
Här etablerade vi en ny 3D, sfäroid ADCC-modell (NK.92.CD16+Trastuzumab+JIMT-1-EGFP cancerceller) som ska användas för screeningapplikationer med hög genomströmning och för att validera de ovan nämnda fynden användes Sunitinib som en modellförening. Först genererade vi EGFP-uttryckande JIMT-1-celler17 och odlade sfäroider från dessa celler. ADCC inducerades av NK-celler tillsammans med trastuzumab, och sfäroider hölls i odling i närvaro eller frånvaro av testsubstanser i 24 timmar (figur 2). Kvantifiering av ADCC baseras på detektion av apoptotisk cancercelldöd (Annexin V-färgning) med hjälp av ett High-Content Analysis-system.
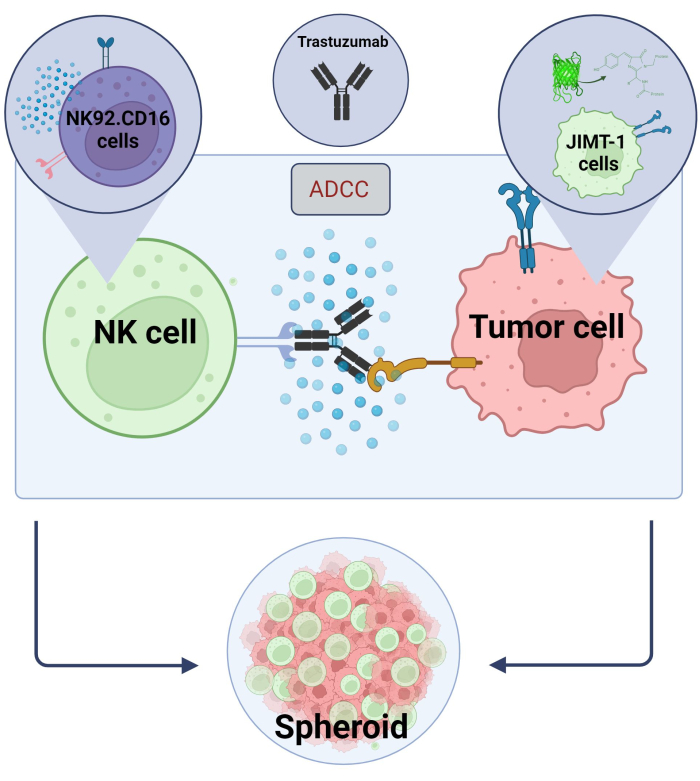
Figur 2. ADCC i ett 3D-sfäroid samkultursystem. Våra experimentella inställningar är baserade på ett 3D-sfäroidsystem som mer exakt kan modellera in vivo-mikromiljön jämfört med 2D-modeller. JIMT-1 EGFP-bröstcancerceller såddes på en konkav cellavvisande botten för att bilda ett rundformat cellkluster, kallat sfäroid. ADCC initierades sedan genom att lägga till NK92. CD16 naturliga mördarceller (E:T-förhållande = 20:1) och en monoklonal anti-HER2-antikropp, Trastuzumab. Den experimentella modellen har visat sig vara effektiv och lätt att tillämpa för identifiering av ADCC-modifierande testföreningar (bild skapad med Biorender.com). Klicka här för att se en större version av denna figur.
Vi visade att insamling av data på detta sätt kan göras i realtid och är statistiskt robust för användning vid screening med högt innehåll i cancerläkemedelsutveckling. Det är viktigt att denna modell möjliggör en utökad validering av en större uppsättning föreningar, och den kan tillämpas på flera analyser av intresse.
Protocol
Representative Results
Discussion
Trots betydande förbättringar i behandlingen av BC under de senaste decennierna utvecklar patienter fortfarande regelbundet läkemedelsresistens eller upplever negativa biverkningar24. Den höga sjukligheten och dödligheten kopplad till BC kräver en fortsatt undersökning av de underliggande molekylära mekanismerna, precis som robusta screeningplattformar för att identifiera nya molekyler som kan användas för terapeutisk utveckling25. Dessa strategier kräver cellod…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
LV fick finansiering från det nationella forsknings-, utvecklings- och innovationskontorets anslag GINOP-2.3.2-15-2016-00010 TUMORDNS”, GINOP-2.3.2-15-2016-00048-STAYALIVE, OTKA K132193 och K147482. Detta projekt har fått finansiering från HUN-REN Hungarian Research Network. CD16.176V.NK-92-celler erhölls från Dr. Kerry S. Campbell (Fox Chase Center, Philadelphia, PA, på uppdrag av Brink Biologics, lnc. San Diego, CA), skyddas av patent över hela världen och licensierades av Nantkwest, lnc. (www.nantkwest.com). Författarna är tacksamma mot György Vereb och Árpád Szöőr för deras hjälp med användningen av NK-92-cellinjen och TR-F(ab’)2 och för teknisk rådgivning.
Materials
| 96-well glass bottom Cell Carrier Ultra microplates | PerkinElmer, Waltham, MA, USA | LLC 6055302 | for spheroids measurements |
| 96-well tissue culture plates | TPP | 92096 | for cell seeding |
| α-MEM medium | Sigma | M8042 | in NK medium |
| Agarose | Sigma | A9539 | for spheroids seeding |
| Annexin V-Alexa Fluo 647 conjugate | Invitrogen-ThermoFisher Scientific | A23204 | for apoptosis measurement with HCS |
| CD16.176 V.NK-92 cells | Dr. Kerry S. Campbell (the Fox Chase Cancer Center, Philadelphia, PA on behalf of Brink Biologics, Inc. San Diego, CA) | ATCC CRL-2407 | for cell culture |
| Cell Tracker Blue | Invitrogen-Thermo Scientific, Waltham, MA, USA) | C2110 | for staining of NK cells |
| DMEM/F-12 medium | Sigma | D8437 | in JIMT1-EGFP medium |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418 | for coating HCS plate before transfering the spheroids |
| Fetal bovine serum (FBS) | Biosera | FB-1090/500 | JIMT-1-EGFP and NK medium |
| Glutamine | Gibco | 35,050–061 | in NK medium |
| GraphPad Prism 8.0.1 | GraphPad Software Inc., San Diego, CA, USA | for statistical analysis | |
| Harmony software | PerkinElmer, Waltham, MA, USA | for HCA | |
| IL-2 | Proleukin, Novartis Hungária Kft., Budapest, Hungary | PHC0026 | in NK medium |
| Insulin (Humulin R) | Eli Lilly | HI0219 | JIMT-1-EGFP medium |
| JIMT-1 breast cancer cells | for cell culture | ||
| MEM Non-essential Amino Acids (MEM-NEAA) | Gibco | 11,140–050 | in NK medium |
| Na-pyruvate | Lonza | BE13-115E | in NK medium |
| Opera Phenix High-Content Analysis equipment | PerkinElmer, Waltham, MA, USA | HH14001000 | for HCA |
| PBS (Posphate buffered saline) | Lonza | BE17-517Q | for washing the cells |
| Penicillin-Streptomycin | Biosera | LM-A4118 | JIMT-1-EGFP and NK medium |
| pLP-1, pLP-2, pLP-VSV-G, pWOXEGFP | Invitrogen, (Prof. József T zsér, University of Debrecen) zsér, University of Debrecen) |
for JIMT-1-EGFP cell line | |
| Pluronic-F127 | Sigma | P2443 | for coating HCS plate before transfering the spheroids |
| Sunitinib malate | SigmaAldrich | PZ0012 | for treatments |
| Trastuzumab Ab (humanized anti-HER2 monoclonal antibody) | Herzuma®, EGIS Pharmaceuticals, Budapest, Hungary | NDC-63459-303-43 | for treatments |
| Trastuzumab-F(ab')2 | Gift from Prof. György Vereb and Árpád Szö r r |
Department of Biophysics and Cell Biology, University of Debrecen | for treatments |
| Trypan blue 0.4% solution | Sigma | T8154 | for cell counting |
| Trypsin-EDTA 1X in PBS | Biosera | LM-T1706 | for cells detachment |
Riferimenti
- Jubelin, C., et al. Three-dimensional in vitro culture models in oncology research. Cell Biosci. 12 (1), 155 (2022).
- Mittler, F., et al. High-content monitoring of drug effects in a 3D spheroid model. Front Oncol. 7, 293 (2017).
- Badr-Eldin, S. M., Aldawsari, H. M., Kotta, S., Deb, P. K., Venugopala, K. N. Three-dimensional in vitro cell culture models for efficient drug discovery: Progress so far and future prospects. Pharmaceuticals (Basel). 15 (8), 926 (2022).
- Brancato, V., Oliveira, J. M., Correlo, V. M., Reis, R. L., Kundu, S. C. Could 3D models of cancer enhance drug screening. Biomaterials. 232, 119744 (2020).
- Pinto, B., Henriques, A. C., Silva, P. M. A., Bousbaa, H. Three-dimensional spheroids as in vitro preclinical models for cancer research. Pharmaceutics. 12 (12), 1186 (2020).
- Fitzgerald, A. A., Li, E., Weiner, L. M. 3D culture systems for exploring cancer immunology. Cancers (Basel). 13 (1), 56 (2020).
- Zanoni, M., et al. 3D tumor spheroid models for in vitro therapeutic screening: A systematic approach to enhance the biological relevance of data obtained. Sci Rep. 6, 19103 (2016).
- Boucherit, N., Gorvel, L., Olive, D. 3D tumor models and their use for the testing of immunotherapies. Front Immunol. 11, 603640 (2020).
- Li, Y., et al. Recent progress on immunotherapy for breast cancer: Tumor microenvironment, nanotechnology and more. Front Bioeng Biotechnol. 9, 680315 (2021).
- Lo Nigro, C., et al. NK-mediated antibody-dependent cell-mediated cytotoxicity in solid tumors: Biological evidence and clinical perspectives. Ann Transl Med. 7 (5), 105 (2019).
- Sun, Y. S., et al. Risk factors and preventions of breast cancer. Int J Biol Sci. 13 (11), 1387-1397 (2017).
- Liu, P. H., Wei, J. C., Wang, Y. H., Yeh, M. H. Female breast cancer incidence predisposing risk factors identification using nationwide big data: A matched nested case-control study in taiwan. BMC Cancer. 22 (1), 849 (2022).
- Burguin, A., Diorio, C., Durocher, F. Breast cancer treatments: Updates and new challenges. J Pers Med. 11 (8), 808 (2021).
- Costa, R. L. B., Czerniecki, B. J. Clinical development of immunotherapies for HER2(+) breast cancer: A review of HER2-directed monoclonal antibodies and beyond. NPJ Breast Cancer. 6, 10 (2020).
- Musolino, A., et al. Role of fcgamma receptors in HER2-targeted breast cancer therapy. J Immunother Cancer. 10 (1), e003171 (2022).
- Petricevic, B., et al. Trastuzumab mediates antibody-dependent cell-mediated cytotoxicity and phagocytosis to the same extent in both adjuvant and metastatic HER2/NEU breast cancer patients. J Transl Med. 11, 307 (2013).
- Guti, E., et al. The multitargeted receptor tyrosine kinase inhibitor sunitinib induces resistance of HER2 positive breast cancer cells to Trastuzumab-mediated ADCC. Cancer Immunol Immunother. 71 (9), 2151-2168 (2022).
- Barok, M., et al. Trastuzumab decreases the number of circulating and disseminated tumor cells despite Trastuzumab resistance of the primary tumor. Cancer Lett. 260 (1-2), 198-208 (2008).
- Toth, G., et al. The combination of Trastuzumab and Pertuzumab administered at approved doses may delay development of Trastuzumab resistance by additively enhancing antibody-dependent cell-mediated cytotoxicity. MAbs. 8 (7), 1361-1370 (2016).
- Ehlers, F. a. I., et al. ADCC-inducing antibody Trastuzumab and selection of KIR-HLA ligand mismatched donors enhance the NK cell anti-breast cancer response. Cancers (Basel). 13 (13), 3232 (2021).
- Gangadhara, S., Smith, C., Barrett-Lee, P., Hiscox, S. 3d culture of Her2+ breast cancer cells promotes AKT to MAPK switching and a loss of therapeutic response. BMC Cancer. 16, 345 (2016).
- Balalaeva, I. V., Sokolova, E. A., Puzhikhina, A. D., Brilkina, A. A., Deyev, S. M. Spheroids of Her2-positive breast adenocarcinoma for studying anticancer immunotoxins in vitro. Acta Naturae. 9 (1), 38-43 (2017).
- Selis, F., et al. Pegylated Trastuzumab fragments acquire an increased in vivo stability but show a largely reduced affinity for the target antigen. Int J Mol Sci. 17 (4), 491 (2016).
- Johnston, R. L., et al. High content screening application for cell-type specific behaviour in heterogeneous primary breast epithelial subpopulations. Breast Cancer Res. 18 (1), 18 (2016).
- Kandaswamy, C., Silva, L. M., Alexandre, L. A., Santos, J. M. High-content analysis of breast cancer using single-cell deep transfer learning. J Biomol Screen. 21 (3), 252-259 (2016).
- Esquer, H., Zhou, Q., Abraham, A. D., Labarbera, D. V. Advanced high-content-screening applications of clonogenicity in cancer. SLAS Discov. 25 (7), 734-743 (2020).
- Pickl, M., Ries, C. H. Comparison of 3D and 2D tumor models reveals enhanced Her2 activation in 3D associated with an increased response to trastuzumab. Oncogene. 28 (3), 461-468 (2009).

