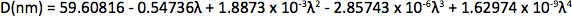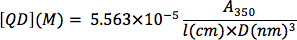Tek molekül Görüntüleme için kompakt Kuantum Noktaları
Summary
Biz tek-molekül floresan görüntüleme için minimize hidrodinamik büyüklüğü ile kolloidal Kuantum noktalarının hazırlanması tarif. Konvansiyonel kuantum noktaları ile karşılaştırıldığında, bu nanopartiküller globüler proteinlerin boyut olarak benzer ve tek-molekül parlaklık, fotodegradasyon karşı kararlılık ve proteinleri ve hücreleri nonspesifik bağlanma direnci için optimize edilmiştir.
Abstract
Tek molekül görüntüleme biyomoleküler fonksiyonu mekanizmalarını anlamak için ve hücresel biyoloji 1-4 altında yatan moleküler davranışların mekansal ve zamansal heterojenite görüntülenmesi için önemli bir araçtır. Görüntü ilgi bireyin molekülü için, tipik bir floresan etiketi (boya, protein, boncuk, ya da kuantum nokta) ile konjuge ve Epifloresans veya toplam iç yansıma floresan (TIRF) mikroskopi ile gözlenir. Boyalar ve floresan proteinleri yıllardır floresan görüntüleme dayanak noktası olmuştur ederken, onların floresans sinyalinin tam kaybından önce gözlem sadece birkaç saniye verimli, bireysel moleküllerin gözlemlemek için gerekli yüksek foton akısı altında dengesiz. Lateks boncuk ve boya etiketli boncuk geliştirilmiş sinyal istikrarı sağlamak değil deleteriously çalışma kapsamında molekülünün difüzyon ve davranışını değiştirebilir ölçüde büyük hidrodinamik boyutu pahasına.
ntent "> Kuantum nokta (QDS) bu iki sorunlu rejimler arasında bir denge sunuyor. Bu nanopartiküller yarı iletken malzemelerden oluşur ve fotodegradasyon 5 karşı olağanüstü direnç ile hidrodinamik kompakt boyutu ile tasarlanmış olabilir. Dolayısıyla son yıllarda QDS sağlayan etkili olmuştur Tek molekül düzeyinde karmaşık makromoleküler davranışın uzun vadeli gözlem. Ancak bu parçacıkların hala kendi boyutlarını hala 4,6 çok büyük olan hücresel sitoplazma ve yarık nöronal sinaptik gibi kalabalık moleküler ortamlarda bozulmuş difüzyon sergilemek bulunmuştur , 7.Kolloidal stabilite, fotostabilite, parlaklık ve geçmişte 8,9 kompakt QDS yararlılığını engellediğini nonspesifik bağlayıcı uzaklıklar dengelerken Son zamanlarda, çekirdek ve minimize hidrodinamik boyutu için QDS yüzey kaplamaları tasarladık. Bu makalenin amacı göstermektiryalıtkan bir Cd y Zn 1-y S kabuğu, kısa polietilen glikol ile modifiye multidentate polimer ligandı ile daha kaplamalı (ile kaplanmış alaşımlı Hg x Cd 1-x Se çekirdeğinden oluşan bu optimize Nanokristallerin sentezi, modifikasyonu ve karakterizasyonu, PEG) zincirleri (Şekil 1). Konvansiyonel CdSe nanokristaller ile karşılaştırıldığında, Hg x Cd 1-x Se alaşımlar geliştirilmiş hücrelerinde sinyal-gürültü ve non-sitotoksik görünür dalga boylarında uyarma için kırmızı ve yakın kızılötesi dalga boylarında floresans, floresans büyük kuantum verimi sunar. Multidentate polimer kaplamalar hidrodinamik boyutunu en aza indirmek için kapalı ve düz yapısındaki nanokristal yüzeyine bağlamak ve PEG hücreleri ve biyomoleküllerin nonspesifik bağlanma azaltmak için yüzey yükü nötralize eder. Sonuç 550-800 nm ve 12 nm civarındaki toplam hidrodinamik boyutu arasındaki emisyon ile parlak floresan nanokristal olduğunu. Bu, s 'deBirçok çözünür globüler hücrelerindeki proteinlerin ve konvansiyonel Pegile QDS (25-35 nm) göre önemli ölçüde daha küçük olarak ame boyut aralığı.
Protocol
Representative Results
Discussion
Konvansiyonel CdSe kuantum noktaları ile karşılaştırıldığında, üçlü alaşım Hg x Cd 1-x Se nanokristaller boyutu ve bağımsız floresans dalga boyu ayarlanabilir. Boyutu ilk CdSe nanokristal çekirdek sentezi sırasında seçilir ve floresan dalga boyu büyük ölçüde nanokristal boyutu 9 değişmez bir ikincil cıva katyon değişim aşamasının, seçilir. Bu saflaştırılmış Hg Cd 1 x-x Se nanokristaller kapaklama önce en azından 24 saat için oda sıca…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Yazarlar elektron mikroskobu görüntüleme için Emory Üniversitesi Entegre Mikroskopi Çekirdek Dr Hong Yi teşekkür etmek istiyorum. Bu çalışma (PN2EY018244, R01 CA108468, U54CA119338 ve 1K99CA154006-01) NIH hibe tarafından finanse edildi.
Materials
| Name of the reagent | Company | Catalogue number | Comments (optional) |
| Selenium | Sigma-Aldrich | 229865 | |
| Tri-n-octylphosphine | Strem | 15-6655 | 97% pure, unstable in air |
| Cadmium oxide | Sigma-Aldrich | 202894 | Highly toxic: use caution |
| Tetradecylphosphonic acid | PCI Synthesis | 4671-75-4 | |
| Octadecene | Alfa Aesar | L11004 | Technical grade |
| Hexadecylamine | Sigma-Aldrich | H7408 | |
| Diphenylphosphine | Sigma-Aldrich | 252964 | Pyrophoric |
| Mercury acetate | Sigma-Aldrich | 456012 | Highly toxic: use caution |
| 1-Octanethiol | Sigma-Aldrich | 471836 | Strong odor |
| Oleic acid | Sigma-Aldrich | W281506 | |
| Zinc acetate | Alfa Aesar | 35792 | |
| Cadmium acetate hydrate | Sigma-Aldrich | 229490 | Highly toxic: use caution |
| Oleylamine | Fisher Scientific | AC12954 | Unstable in air |
| Sulfur | Sigma-Aldrich | 344621 | |
| Trioctylphosphine oxide | Strem | 15-6661 | 99% |
| Pyridine | VWR | EM-PX2012-6 | Anhydrous |
| Thioglycerol | Sigma-Aldrich | M1753 | Strong odor |
| Triethylamine | Sigma-Aldrich | 471283 | Anhydrous |
| Dialysis tubing | Spectrum Labs | 131342 | 20 kDa cutoff |
| Centrifugal filter | Millipore | UFC801024 | 10 kDa cutoff |
| Monoamino-PEG | Rapp Polymere | 12 750-2 | 750 Da |
| DMTMM, 4-(4,6-Dimethoxy-1,3,5-triazin-2-yl)-4-methylmorpholinium chloride hydrate | Alfa Aesar | H26333 | |
| AKTAprime Plus Chromatography System | GE HealthCare | ||
| Superose 6 10/300 GL chromatography column | GE HealthCare | 17-5172-01 | |
| Agarose, OmniPur | VWR | EM-2120 | |
Appendix Synthesis of mercury octanethiolate: Slowly add a methanol solution of mercury acetate (1 eq.) to a stirring solution of 1-octanethiol (3 eq.) and potassium hydroxide (3 eq.) in methanol at room temperature. Isolate the mercury(II) octanethiolate precipitate via filtration, wash two times with methanol and once with ether, and then dry under vacuum. Synthesis of multidentate polymer: Dissolve polyacrylic acid (1 g, 1,773 Da) in 25 ml dimethylformamide (DMF) in a 150 ml three-necked flask and bubble with argon for 30 min. Add an anhydrous solution of cysteamine (374 mg, 4.87 mmol) in 10 ml DMF. At room temperature with vigorous stirring, slowly add anhydrous diisopropylcarbodiimide (DIC, 736 mg, 5.83 mmol) over 30 min, followed by triethylamine (170 μl, 1.22 mmol), and allow the reaction to proceed for 72 hr at 60 °C. Add mercaptoethanol (501 mg, 6.41 mmol) to quench the reaction, and stir for 2 hr at room temperature. Remove DMF via rotary evaporation and isolate the polymer with the addition of a 2:1 mixture of ice-cold acetone:chloroform, followed by centrifugation. Dissolve the polymer in ~5 ml anhydrous DMF, filter, precipitate again with diethyl ether, and repeat. Dry the product under vacuum and store under argon. Determination of CdSe core diameter: From the UV-Vis absorption spectrum determine the wavelength of the first exciton peak (λ, in nm), which is the longest-wavelength peak (e.g. roughly 498 nm for CdSe in Figure 2a), and use the sizing curve of Mulvaney and coworkers 12:
Determination of CdSe nanocrystal concentration: From a background-subtracted UV-Vis spectrum of an optically clear solution of CdSe nanocrystals, determine the absorption at 350 nm wavelength. Serial dilutions can be used to determine if the optical absorption is within the linear range of Beer’s Law. The nanocrystal concentration (QD, in M) can be determined by plugging in the nanocrystal diameter (D, in nm), the optical absorption value (A3sa), and the cuvette path length (l, in cm) into the following equation from the empirical correlation of Bawendi and coworkers 13:
|
References
- Toprak, E., Selvin, P. R. New fluorescent tools for watching nanometer-scale conformational changes of single molecules. Annu. Rev. Biophys. Biomol. Struct. 36, 349-369 (2007).
- Joo, C., Balci, H., Ishitsuka, Y., Buranachai, C., Ha, T. J. Advances in single molecule fluorescence methods for molecular biology. Annu. Rev. Biochem. 77, 51-76 (2008).
- Pinaud, F., Clarke, S., Sittner, A., Dahan, M. Probing cellular events, one quantum dot at a time. Nat. Method. 7, 275-285 (2010).
- Smith, A. M., Wen, M. M., Nie, S. M. Imaging dynamic cellular events with quantum dots. Biochemist. 32, 12-17 (2010).
- Smith, A. M., Duan, H. W., Mohs, A. M., Nie, S. M. Bioconjugated quantum dots for in vivo molecular and cellular imaging. Adv. Drug Deliv. Rev. 60, 1226-1240 (2008).
- Smith, A. M., Nie, S. M. Next-generation quantum dots. Nature Biotech. 27, 732-733 (2009).
- Groc, L., Lafourcade, M., Heine, M., Renner, M., Racine, V., Sibarita, J. -. B., Lounis, B., Choquet, D., Cognet, L. Single trafficking of neurotransmitter receptor: comparison between single-molecule/quantum dot strategies. J. Neurosci. 27, 12433-12437 (2007).
- Smith, A. M., Nie, S. M. Minimizing the hydrodynamic size of quantum dots with multifunctional multidentate polymer ligands. J. Am. Chem. Soc. 130, 11278-11279 (2008).
- Smith, A. M., Nie, S. M. Bright and compact alloyed quantum dots with broadly tunable near-infrared absorption and fluorescence spectra through mercury cation exchange. J. Am. Chem. Soc. 133, 24-26 (2011).
- Shriver, D. F., Drezdzon, M. A. . The Manipulation of Air-Sensitive Compounds. , (1986).
- Errington, R. J. . Advanced Practical Inorganic and Metalorganic Chemistry. , (1997).
- Jasieniak, J., Smith, L., van Embden, J., Mulvaney, P., Califano, M. Re-examination of the size-dependent absorption properties of CdSe quantum dots. J. Phys. Chem. C. 113, 19468-19474 (2009).
- Leatherdale, C. A., Woo, W. K., Mikulec, F. V., Bawendi, M. G. On the absorption cross section of CdSe nanocrystal quantum dots. J. Phys. Chem. B. 106, 7619-7622 (2002).
- Smith, A. M., Mohs, A. M., Nie, S. M. Tuning the optical and electronic properties of colloidal nanocrystals by lattice strain. Nature Nanotech. 4, 56-63 (2009).
- Demas, J. N., Crosby, G. A. The measurement of photoluminescence quantum yields. A review. J. Phys. Chem. 75, 991-1024 (1971).
- Van Embden, J., Jasieniak, J., Mulvaney, P. Mapping the optical properties of CdSe/CdS heterostructure nanocrystals: the effects of core size and shell thickness. J. Am. Chem. Soc. 131, 14299-14309 (2009).
- Smith, A. M., Duan, H. W., Rhyner, M. N., Ruan, G., Nie, S. M. A systematic examination of surface coatings on the optical and chemical properties of semiconductor quantum dots. Phys. Chem. Chem. Phys. 8, 3895-3903 (2006).
- Zhang, X., Mohandessi, S., Miller, L. W., Snee, P. T. Efficient functionalization of aqueous CdSe/ZnS nanocrystals using small-molecule chemical activators. Chem. Comm. 47, 3532-3534 (2011).
- Bucio, L., Souza, V., Albores, A., Sierra, A., Chavez, E., Carabez, A., Guiterrez-Ruiz, M. C. Cadmium and mercury toxicity in a human fetal hepatic cell line (WRL-68 cells). Toxicol. 102, 285-299 (1995).
- Han, S. G., Castranova, V., Vallyathan, V. J. Comparative cytotoxicity of cadmium and mercury in a human bronchial epithelial cell line (BEAS-2B) and its role in oxidative stress and induction of heat shock protein 70. J. Toxicol. Environ. Health Part A. 70, 852-860 (2007).
- Strubelt, O., Kremer, J., Tilse, A., Keogh, J., Pentz, R. J. Comparative studies on the toxicity of mercury, cadmium, and copper toward the isolated perfused rat liver. J. Toxicol. Environ. Health Part A. 47, 267-283 (1996).