النقل غشاء عمليات تحليلها بواسطة النظام ثقب النانو رقاقة الموازي عالية في قرار بروتين واحد
Summary
The presented protocol describes the analysis of membrane protein mediated transport on the single transporter level using pore-spanning solvent-free lipid bilayers. This is achieved by the creation of bulk produced nanopore array chips, combined with highly parallel data acquisition and analysis, enabling the future establishment of membrane protein effector screenings.
Abstract
نقل البروتين غشاء على مستوى بروتين واحد لا يزال يتهرب تحليل مفصل، إذا الركيزة translocated غير قابلة للكهربي. وقد بذلت جهود كبيرة في هذا المجال، ولكن تقنيات تمكين تحليل النقل عالية الإنتاجية الآلي في تركيبة مع تقنيات طبقة ثنائية المادة الدهنية الخالية من المذيبات المطلوبة للتحليل النقل غشاء نادرة. هذا النوع من النقل ولكن هو الحاسم في توازن الخلايا وبالتالي هدفا رئيسيا في تطوير العقاقير ومنهجيات للحصول على أفكار جديدة بحاجة ماسة.
يصف المخطوطة هنا قدمت إنشاء والتعامل معها من بيوشيب رواية لتحليل البروتين بوساطة عمليات النقل غشاء على قرار نقل احد. يتكون بيوشيب من microcavities محاطة nanopores التي هي موازية للغاية في التصميم ويمكن أن تنتج في الصف الصناعي وكمية. ويمكن مباشرة الجسيمات الشحمية البروتين إيواء تطبيقها علىسطح رقاقة تشكيل طبقات ثنائية للدهون، والتي تمتد المسام الذاتي تجميعها باستخدام SSM-تقنيات (بدعم الصلبة الأغشية الدهنية). المسام التي تغطي أجزاء من الغشاء وقائما بذاته، وتوفير واجهة للالنبات الركيزة داخل أو خارج الفضاء تجويف، والتي يمكن أن تتبعها قراءات الفلورسنت متعددة الأطياف في الوقت الحقيقي. وضع إجراءات التشغيل القياسية (الأورام) يسمح بإنشاء واضحة من طبقات ثنائية الدهون-إيواء البروتين على سطح رقاقة من تقريبا كل بروتين الغشاء الذي يمكن تشكيلها وظيفيا. الشرط الوحيد هو إنشاء نظام تلا الفلورسنت لركائز النقل غير كهربي.
تطبيقات فحص عالية المحتوى هي محقق عن طريق استخدام آلية المجهر الفلورسنت المقلوب تسجيل رقائق متعددة في نفس الوقت. ويمكن تحليل مجموعات البيانات الكبيرة باستخدام متاحة بحرية برامج التحليل مصمم خصيصا. ثلاثة ألوان متعددة الطيفية الفلوريةقراءة من علاوة على ذلك يسمح للتمييز البيانات غير منحازة إلى فئات الأحداث المختلفة، والقضاء على نتائج إيجابية كاذبة.
وتعتمد هذه التقنية رقاقة حاليا على شافي 2 السطوح، ولكن المزيد من functionalization باستخدام أسطح رقاقة الذهب المطلي ممكن أيضا.
Introduction
أصبح تحليل بروتينات الغشاء من الاهتمام المتزايد للبحوث الأساسية والأدوية في السنوات ال 20 الماضية. تطوير عقاقير جديدة تعتمد على تحديد وتوصيف مفصل للأهداف جديدة، ويجري حاليا واحدة من العوامل التي تحد. حقيقة أن حوالي 60٪ من جميع الأهداف المخدرات هي بروتينات غشاء 1، يجعل من تطوير تقنيات لتوضيح وظيفتها الأهم.
في الماضي، وقد تم تطوير تقنيات لدراسة قنوات كهربي والنقل في العديد 2-4. ركائز غير كهربي في العكس تمثل مهمة أكثر صعوبة. ومع ذلك فهي تحظى باهتمام خاص كأهداف المخدرات الرئيسية، كما أنها تتحكم في تدفق المواد المذابة والمواد الغذائية عبر غشاء الخلية ووظيفتها باسم المستقبلات الرئيسية في الإشارة شلالات 5.
وقد بذلت جهود كبيرة في تطوير رechniques لدراسة وظيفة البروتينات النقل غشاء 6 و 7. ظهرت النظم التي تستخدم الأغشية الصلبة المدعومة من الأدوات كما الواعدة في هذا المجال 8-10، بما في صلب طبقات ثنائية الدهون المعتمدة، طبقات ثنائية المربوطة 11، 12، الأغشية microblack الدهون 13 و 14 و الأم صفائف حويصلة 15 و 16 على سبيل المثال لا الحصر. تتوفر حتى مع الاجهزة التجارية 17، 18 بعضهم. وقد نشرت بعض الأمثلة التي تجمع بين القدرة على دراسة بروتينات الغشاء واحدة بطريقة موازية للغاية 14، 19، وهو شرط أساسي لتطبيقات الفحص. ومع ذلك، هذه الأساليب نادرا ما يسد من البحوث الأساسية إلى البيئة الصناعية. كثيرا ما تكمن الصعوبات في قدرة النظام أن يكون automatable، والإنتاج الكثيف من حيث التكلفة و / أو التحضير شاقة. نهج س vercoming جميع العقبات المذكورة أعلاه هو الهدف النهائي.
وقد تم تطوير تقنية المعروضة هنا لدراسة قنوات الغشاء والنقل في المختبر في بيئة تسيطر عليها على مستوى البروتين واحدة 20-22. وأكثر من ذلك بكثير إنشاء إعادة تشكيل بروتينات الغشاء النقاء في LUVs من نهج مماثلة لGUVs 23-26 أو الدهون السوداء الأغشية 27. يمكنهم مباشرة يتم تطبيقها على سطح رقاقة، حيث تشكيل طبقة ثنائية تجري من خلال عملية التجميع الذاتي. تصميم الزجاج السفلي من رقاقة nanoporous (الشكل 1) يسمح للفحص المجهري الهواء، مما يسمح للأتمتة واضحة للنظام. جنبا إلى جنب مع مرحلة الآلية يمكن قياس رقائق متعددة في نفس الوقت، مع كل مجال الرؤية التي تحتوي على الآلاف من تجاويف مختومة لتحليلها.
<p class="jove_content" fo:keep-together.within-page= "1">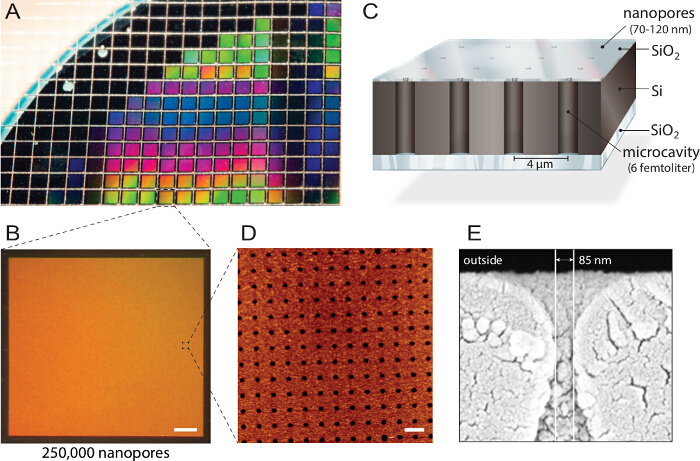
الشكل 1. تصميم biochips ثقب النانو المضاعفة. أ) السيليكون على العازل (منظم أبناء العراق) رقاقة عن طريق النقش على رد الفعل ايون. هي ملفقة حوالي 1150 رقائق الفردية من كل رقاقة مع خصائص مماثلة والجودة. ب) ويضم كل رقاقة 250،000 microcavities الفردية مع فتحات نانو. شريط مقياس: 200 ميكرون C) كل تجويف هو عنونة عبر مضان متعددة الأطياف للقراءة خارج. وintransparent أعلى كتل طبقة الاشارات الفلورسنت من الخزان العازلة، مما يجعل بيوشيب متوافقة مع المجاهر مضان مقلوب. D) مجهر القوة الذرية (AFM) التصوير يكشف ترتيب بالتساوي فتحات المسام وخشونة سطح طبقة ثاني أكسيد السيليكون من 3.6 نانومتر (ن = 40) الأمثل لالانصهار الحويصلة. مقياس شريط: 5 ميكرون E) هيئة التصنيع العسكري الضوئي الإلكترونمعارض roscopy (SEM) صورة مقطع عرضي من خلال ثقب النانو مما يتيح الوصول إلى تجاويف فيمتولتر داخل رقاقة السيليكون. تم إعادة استخدام هذا الرقم بإذن من 21. يرجى النقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
يتم تنفيذ جميع تحليل البيانات باستخدام مجانية لضمان الوصول غير المقيد للمستخدمين النهائيين. ويتم تحليل السلاسل الزمنية باستخدام برنامج معالجة الصور والعرف بناء منحنى برامج التحليل تمكين تجهيز دفعة والارتباط المباشر لمجموعات كبيرة من البيانات مع قنوات الفلورسنت متعددة وآلاف من المنحنيات.
البروتين النموذج المستخدم في هذا البروتوكول هو قناة mechanosensitive من البروتين قناة (MscL) تصرف كبير المستمدة من E. القولونية. وهي بمثابة صمام للافراج عن صدمة التناضحي في الطبيعة، ولكن تم تعديلها في مثل هذه الطريقة التي صممت بعقلانية syntيمكن أن تساهمي ظائف hetic أن تعلق على جانب قنوات انقباض. عبر المسؤول عن النفور من المنشط ملزمة تساهميا (MTSET) يتم تشغيل القناة لفتح، وخلق نانو صمام. جزيئات صغيرة مثل أيونات، المياه، بروتينات صغيرة، ولكن أيضا fluorophores صغيرة يمكن أن تتخلل من خلال القناة. هنا، يتم استخدام البروتين كنموذج للتدليل على قدرة نظام للكشف عن النبات بوساطة البروتين.
Protocol
Representative Results
Discussion
تقنية المعروضة هنا يسمح للتحليل مواز للغاية من النقل بروتين الغشاء. ويمكن مباشرة أنظمة بروتين الغشاء أعيد تطبيقها على بيوشيب، مما يجعل التكيف من الناحية النظرية كل نقل غشاء أو توجيه ممكن. تحليل النقل يقتصر فقط عن طريق إنشاء نظام تلا الفلورسنت، إما عن طريق تغيير مباش?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
We thank Barbara Windschiegl for her help in establishing SOPs; Dennis Remme for his work on the NanoCalcFX software and Alina Kollmannsperger, Markus Braner and Milan Gerovac for helpful suggestions on the manuscript. The German-Israeli Project Cooperation (DIP) provided by the DFG and the Federal Ministry of Education and Research to R.T., as well as the Federal Ministry of Economics and Technology (ZIM R&D Project) to R.T. and Nanospot GmbH supported this work.
Materials
| Reagent | |||
| [2-(Trimethylammonium)ethyl] methanethiosulfonate |
Toronto Research Chemicals Inc. | T792900 | MTSET; hydrolized by water. Keep as dry pouder aliquot at -80 °C. Use immediately (30 minutes) after solubilization in buffer. |
| 1 ml gas-tight syringe | Hamilton | #1001 | |
| 10 ml round flask | Schott Duran | ||
| 2.7 mm glas beads | Roth | N032.1 | |
| 2-Propanole | Roth | 9866.5 | |
| 30 cm Luer-Lock Extension Tube | Sarstedt | 744304 | |
| Acetone | Roth | 5025.5 | |
| Bio-Beads SM-2 Adsorbent | Bio-Rad | 152-3920 | need to be activated before first use |
| CaCl2 Dihydrat | Roth | HN04.3 | |
| Calcein | Sigma | C0875 | store dark at -20 °C |
| Chloroform reagent grade | VWR Chemicals | 22711324 | |
| DOPEATTO390 | ATTO-TEC | AD 390-165 | store dark at -20 °C |
| Ethanol absolute | Sigma-Aldrich | 32205 | |
| Injekt Single-use syringe | Braun | 460 60 51V | |
| Injekt-F single-use syringe | Braun | 91 66 017V | |
| Keck clips | Schott | KC29 | |
| L-α-Phosphatidylcholine, 20% (Soy) | Avanti Polar Lipids | 5416016 | store under inert gas at -20 °C |
| NaCl 99.5% p.a. | Roth | 3957.2 | |
| Nanopore E100 wafer/chips | Micromotive (Mainz/Germany) | available on request | |
| Nucleopore Track-Etch Membrane 0.4 µm | Whatman | 800282 | |
| Oregon Green Dextran 488 (70 kDa) | life Technologies | D-7173 | store dark at -20 °C |
| Oy647 | Luminartis (Münster/Germany) | OY-647-T-1mg | store dark at -20 °C |
| Rotilabo-syringe filtration, unsterile, pore-size 0.22 µm | Roth | P 818.1 | |
| Sephadex G-50 | Sigma-Aldrich | G5080 | column material for size exclusion chromatography |
| Silastic MDX4-4210 | Dow Corning | curing agent for chip fixation onto cover glass support | |
| sticky-Slide 8-well | ibidi | 80828 | multi-well chamber for the mounting onto glass slides (chip holder) |
| Three-way stopcock blue | Sarstedt | 744410001 | |
| Tris Pufferan 99.9% Ultra Quality | Roth | 5429.2 | |
| Triton-X 100 | Roth | 6683.1 | |
| Whatman 0.2 µm cellulose nitrate membrane filter | Roth | NH69.1 | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Büchi 461 water bath | Büchi | ||
| Büchi Rotavapor RE 111 | Büchi | ||
| Cary Eclipse Fluorescence Spectrophtometer | Varian | ||
| LiposoFast Mini Extruder | Avestin | ||
| Membrane pump | Vaccubrand | 15430 | |
| Nanosight Nanoparticle Tracking Microscope | Malvern / Nanosight | LM 14C | |
| NyONE microscope | Synentec | available on request | |
| Pump control | Vaccubrand | CVC 2II | |
| Sonicator bath Sonorex RK100H | Brandelin electronic | 31200001107477 | |
| Vaccum pump RC5 | Vaccubrand | 1805400204 | |
| Water bath W13 | Haake | 002-9910 | |
| Plasma Cleaner PDC-37G | Harrick Plasma | PDC-37G | |
| Name | Company | Catalog Number | Comments |
| Software | |||
| ImageJ | Open Source | http://imagej.nih.gov/ij/ | scientific image processing software |
| NanoCalcFX | Freeware | http://sourceforge.net/projects/nanocalc/ | data analysis/evaluation software for massive transport kinetic datasets |
| NTA 2.3 Analytical Software | Nanosight | data acquisition and analysis software for nanoparticle tracking microscope | |
| NTA 2.3 Temperature Comms | Nanosight | temperature controle software for nanoparticle tracking microscope |
References
- Yildirim, M. A., Goh, K. I., Cusick, M. E., Barabasi, A. L., Vidal, M. Drug-target network. Nat Biotechnol. 25, 1119 (2007).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflugers Arch. 391, 85-100 (1981).
- Osaki, T., Suzuki, H., Le Pioufle, B., Takeuchi, S. Multichannel simultaneous measurements of single-molecule translocation in α-hemolysin nanopore array. Anal. Chem. 81, 9866-9870 (2009).
- Carrillo, L., et al. High-resolution membrane capacitance measurements for studying endocytosis and exocytosis in yeast. Traffic. , (2015).
- Giacomini, K. M., et al. Membrane transporters in drug development. Nat. Rev. Drug Discov. 9, 215-236 (2010).
- Castell, O. K., Berridge, J., Wallace, M. I. Quantification of membrane protein inhibition by optical ion flux in a droplet interface bilayer array. Angew. Chem. Int. Ed. 51, 3134-3138 (2012).
- Zollmann, T., et al. Single liposome analysis of peptide translocation by the ABC transporter TAPL. Proc. Natl. Acad. Sci. U.S.A. 112, 2046-2051 (2015).
- Tamm, L. K., McConnell, H. M. Supported phospholipid bilayers. Biophys. J. 47, 105-113 (1985).
- Sackmann, E. Supported membranes: scientific and practical applications. Science. 271, 43-48 (1996).
- Castellana, E. T., Cremer, P. S. Solid supported lipid bilayers: From biophysical studies to sensor design. Surf. Sci. Rep. 61, 429-444 (2006).
- Wagner, M. L., Tamm, L. K. Tethered polymer-supported planar lipid bilayers for reconstitution of integral membrane proteins: silane-polyethyleneglycol-lipid as a cushion and covalent linker. Biophys. J. 79, 1400-1414 (2000).
- Naumann, C. A., et al. The polymer-supported phospholipid bilayer: tethering as a new approach to substrate-membrane stabilization. Biomacromolecules. 3, 27-35 (2002).
- Weiskopf, D., Schmitt, E. K., Klühr, M. H., Dertinger, S. K., Steinem, C. Micro-BLMs on highly ordered porous silicon substrates: Rupture process and lateral mobility. Langmuir. 23, 9134-9139 (2007).
- Watanabe, R., et al. Arrayed lipid bilayer chambers allow single-molecule analysis of membrane transporter activity. Nat. Commun. 5, (2014).
- Stamou, D., Duschl, C., Delamarche, E., Vogel, H. Self-Assembled Microarrays of Attoliter Molecular Vessels. Angew. Chem. Int. Ed. 115, 5738-5741 (2003).
- Lohr, C., et al. Single Liposomes Used to Study the Activity of Individual Transporters. Biophysical Journal. 106, 229a (2014).
- Dunlop, J., Bowlby, M., Peri, R., Vasilyev, D., Arias, R. High-throughput electrophysiology: an emerging paradigm for ion-channel screening and physiology. Nat. Rev. Drug Discov. 7, 358-368 (2008).
- Milligan, C. J., et al. Robotic multiwell planar patch-clamp for native and primary mammalian cells. Nat. Protoc. 4, 244-255 (2009).
- Soga, N., Watanabe, R., Noji, H. Attolitre-sized lipid bilayer chamber array for rapid detection of single transporters. Sci. Rep. 5, (2015).
- Kleefen, A., et al. Multiplexed parallel single transport recordings on nanopore arrays. Nano Lett. 10, 5080-5087 (2010).
- Wei, R., Gatterdam, V., Wieneke, R., Tampé, R., Rant, U. Stochastic sensing of proteins with receptor-modified solid-state nanopores. Nat. Nanotechnol. 7, 257-263 (2012).
- Urban, M., et al. Highly parallel transport recordings on a membrane-on-nanopore chip at single molecule resolution. Nano Lett. 14, 1674-1680 (2014).
- Kusters, I., Van Oijen, A. M., Driessen, A. J. Membrane-on-a-Chip: Microstructured Silicon/Silicon-Dioxide Chips for High-Throughput Screening of Membrane Transport and Viral Membrane Fusion. ACS Nano. 8, 3380-3392 (2014).
- Hansen, J. S., Thompson, J. R., Hélix-Nielsen, C., Malmstadt, N. Lipid directed intrinsic membrane protein segregation. J. Am. Chem. Soc. 135, 17294-17297 (2013).
- Heinemann, F., Schwille, P. Preparation of Micrometer-Sized Free-Standing Membranes. ChemPhysChem. 12, 2568-2571 (2011).
- Lazzara, T. D., Carnarius, C., Kocun, M., Janshoff, A., Steinem, C. Separating attoliter-sized compartments using fluid pore-spanning lipid bilayers. ACS nano. 5, 6935-6944 (2011).
- Winterhalter, M. Black lipid membranes. Curr. Opin. Colloid Interface Sci. 5, 250-255 (2000).
- Koçer, A., Walko, M., Feringa, B. L. Synthesis and utilization of reversible and irreversible light-activated nanovalves derived from the channel protein MscL. Nat. Protoc. 2, 1426-1437 (2007).

