תחבורת ממברנה תהליכים נותחה על ידי מערכת שבב nanopore מקבילה מאוד ברזולוצית חלבון יחידה
Summary
The presented protocol describes the analysis of membrane protein mediated transport on the single transporter level using pore-spanning solvent-free lipid bilayers. This is achieved by the creation of bulk produced nanopore array chips, combined with highly parallel data acquisition and analysis, enabling the future establishment of membrane protein effector screenings.
Abstract
תחבורת חלבון ממברנה על רמת החלבון היחידה עדיין מתחמקת ניתוח מפורט, אם המצע translocated הוא בלתי electrogenic. מאמצים רבים נעשו בתחום זה, אך טכניקות המאפשרות ניתוח תחבורת תפוקה גבוהה אוטומטי בשילוב עם טכניקות bilayer שומנים ממסות ללא נדרשו לניתוח של מובילי הממברנה הן נדירות. מחלקה זו של מובילי אולם הוא מכריע הומאוסטזיס התא ולכן יעד מרכזי בפיתוח תרופות ומתודולוגיות כדי לקבל תובנות חדשות זקוקה נואשות.
כתב היד המוצג כאן מתארת את ההקמה וטיפול של biochip רומן לניתוח תהליכי הובלה בתיווך חלבון הממברנה ברזולוציה טרנספורטר יחידה. Biochip מורכב microcavities המוקפת nanopores כי הוא מקביל מאוד בעיצובו יכול להיות יוצר כיתה תעשייתית וכמות. ליפוזומים-מחסה חלבון ניתן ליישם ישירותפני שטח השבב להרכיב bilayers שומנים נקבובי פורש עצמי התאסף באמצעות SSM-טכניקות (נתמכים מוצק ממברנות שומנים בדם). נקבובי פורש חלקים של הממברנה הם בודדים, מתן הממשק עבור טרנסלוקציה מצע לתוך או מתוך שטח החלל, אשר יכול להיות מלווה הודעת פלורסנט רב-ספקטרלי בזמן אמת. הקמת נהלי עבודה סטנדרטיות (SOPs) מאפשרת הקמה הפשוטה של bilayers שומנים מחסה חלבון על פני השבב של כמעט כל חלבון הממברנה כי יינתן מחדש מבחינה תפקודית. תנאי היחיד הוא הקמת מערכת לקריאה החוצה פלורסנט מצעי תחבורה שאינו electrogenic.
ביצועי תוכן יישומי הקרנה הם מטרות משנים על ידי שימוש מיקרוסקופי פלואורסצנטי הפוכים אוטומטיים הקלטה שבבית מרובה במקביל. ערכות נתונים גדולות ניתן לנתח באמצעות תוכנת ניתוח האישית מעוצב הזמינה באופן חופשי. שלושה צבעים ניאון ספקטרלי רבלקריאה החוצה יתר על כן מאפשרת אפלית נתונים משוחדת למעמדות אירוע אחרות, ביטול תוצאות חיוביות כוזבות.
טכנולוגית השבב מבוססת כיום על משטחי SiO 2, אבל functionalization נוסף באמצעות משטחי שבב מצופה זהב הוא גם אפשרי.
Introduction
הניתוח של חלבונים בממברנה הפך של הגדלת ריבית למחקר בסיס תרופות ב -20 השנים האחרונות. פיתוח תרופות חדישות תלוי בזיהוי ואפיון מפורט של מטרות חדשות, כיום להיות אחד הגורמים המגבילים. העובדה כי כ -60% מכלל מטרות התרופה הם חלבונים בממברנה 1, הופכת את הפיתוח של טכניקות על מנת להבהיר את תפקידם החשוב ביותר.
בעבר, טכניקות לחקר ערוצי מובילי electrogenic פותחו שפע 2 – 4. מצעים ללא electrogenic בניגוד להציג משימה מאתגרת יותר. הם לעומת זאת עניין מיוחד, שכן מטרות תרופת ממשלה, כפי שהם שולטים השטף של מומסים וחומרים מזינים על פני קרום התא ותפקוד כקולטנים מפתח איתות מפלים 5.
מאמץ ניכר כבר הכניסו לתוך הפיתוח של techniques ללמוד את תפקודם של חלבונים תחבורה הממברנה 6, 7. מערכות המשתמשות ממברנות מוצקות נתמך צמחו ככלים מבטיחים ביותר בתחום זה 8 – 10, כולל bilayers שומנים המוצק נתמך, bilayers הקשור 11, 12, ממברנות שומנים בדם microblack 13, 14 ו מערכי שלפוחית יליד 15, 16 עד כמה שם. חלקם אפילו זמינים כמו setups המסחרי 17, 18. כמה דוגמאות פורסמו שילוב היכולת ללמוד חלבונים בממברנה יחידים באופן מקביל מאוד 14, 19, תנאים הכרחי עבור יישומי הקרנה. עם זאת, שיטות אלו לעתים נדירות לגשר בין מחקר בסיסי כדי הסביבה התעשייתית. הקשיים בדרך כלל לשכב היכולת של המערכת להיות automatable, ייצור אינטנסיבי בעלות ו / או הכנה מפרכת. גישה o vercoming כל המכשולים הנ"ל הוא המטרה הסופית.
הטכניקה המוצגת כאן פותחה ללמוד ערוצי קרום מובילים במבחנה בסביבה מבוקרת על רמת החלבון היחידה 20 – 22. כינון של חלבונים בממברנה מטוהר אל חביבי מוקם יותר הרבה יותר מאשר גישות דומות עבור GUVs 23 – 26 או שומנים שחורים ממברנות 27. הם יכולים להיות מיושמים ישירות אל פני שטח השבב, שם היווצרות bilayer מתקיימת באמצעות תהליך הרכבה עצמית. עיצוב הזכוכית התחתונה של שבב nanoporous (איור. 1) מאפשר מיקרוסקופיה אוויר, המאפשרת האוטומציה הפשוטה של המערכת. בשילוב עם במה ממונעת שבבי מרובים ניתן למדוד בו זמנית, עם כל שדה הראייה המכילה אלף חללים אטומים לניתוח.
<p class="jove_content" fo:keep-together.within-page= "1">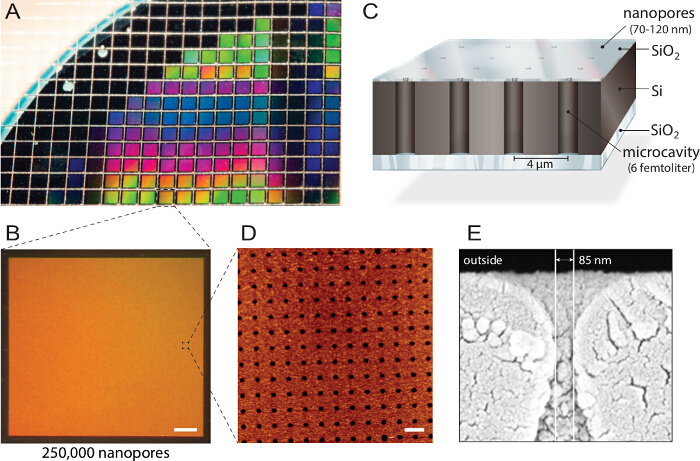
איור 1. עיצוב של biochips nanopore המרובב. א) סיליקון על מבודד (SOI) רקיק בנוי על ידי תחריט תגובתי-יון. כ 1,150 צ 'יפס פרט מיוצר מ כל רקיק עם מאפיינים זהים ואיכות. B) כל שבב מורכב 250,000 microcavities פרט עם פתחי ננו. סרגל קנה מידה:. 200 מיקרומטר C) חלל כל למיעון דרך-אאוט לקרוא קרינה רבה-ספקטרלי. בלוקי שכבה העליונים intransparent אותות הניאון ממאגר החיץ, מה שהופכים את biochip תואם מיקרוסקופי פלואורסצנטי הפוכים. D) במיקרוסקופ כוח אטומי (AFM) הדמיה חושפת מסודר באופן שווה פתחים נקבוביים וחספוס פני שטח של שכבת תחמוצת סיליקון של 3.6 ננומטר (n = 40) אופטימלי איחוי שלפוחית. סרגל קנה מידה:. 5 מיקרומטר E) מיקרופון אלקטרונים סורקroscopy (SEM) התמונה מראה חתך דרך nanopore המאפשר גישה החללים femtoliter בתוך שבב סיליקון. נתון זה נעשה שימוש חוזר באישור 21. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
כל ניתוח הנתונים מתבצע באמצעות תוכנה חופשית על מנת להבטיח גישה חופשית עבור משתמשי קצה. סדרת זמן מנותחת באמצעות תוכנת עיבוד תמונה חינם תוכנת ניתוח עקום לבנות מותאם אישית עיבוד יצווה המאפשר וקורלציה פשוטה של מערכי נתונים גדולים עם ערוצים ואלף פלורסנט מרובים של עקומות.
חלבון המודל להשתמש בפרוטוקול זה הוא ערוץ mechanosensitive של מוליכות גדולות (MscL) ערוץ חלבון נגזר E. coli. הוא מתפקד כשסתום לשחרור הלם אוסמוטי בטבע, אך הוא היה שונה בצורה כזאת כי תוכננה באופן רציונלי syntפונקציות hetic ניתן לחבר קוולנטית לצד התכווצות ערוצים. ויה-הדחייה ממונית על המפעיל המחויב קוולנטית (MTSET) בערוץ מופעל לפתוח, יצירה-שסתום ננו. מולקולות קטנות כמו יונים, מים, חלבונים קטנים, אך גם fluorophores הקטן יכולות לחלחל דרך הערוץ. הנה, החלבון משמש כמודל כדי להדגים את היכולת של המערכת לזהות טרנסלוקציה חלבון בתיווך.
Protocol
Representative Results
Discussion
הטכניקה המוצגת כאן מאפשרת בדיקה מקבילה מאוד תחבורת חלבון הממברנה. מערכות חלבון הממברנה מחדש ניתן ליישם ישירות biochip, מה שהופך את ההתאמה של תיאורטית כל טרנספורטר קרום או ערוץ אפשרי. ניתוח תחבורה מוגבל רק על ידי הקמת מערכת לקריאה החוצה פלורסנט, בין אם באמצעות שינוי קרינ?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
We thank Barbara Windschiegl for her help in establishing SOPs; Dennis Remme for his work on the NanoCalcFX software and Alina Kollmannsperger, Markus Braner and Milan Gerovac for helpful suggestions on the manuscript. The German-Israeli Project Cooperation (DIP) provided by the DFG and the Federal Ministry of Education and Research to R.T., as well as the Federal Ministry of Economics and Technology (ZIM R&D Project) to R.T. and Nanospot GmbH supported this work.
Materials
| Reagent | |||
| [2-(Trimethylammonium)ethyl] methanethiosulfonate |
Toronto Research Chemicals Inc. | T792900 | MTSET; hydrolized by water. Keep as dry pouder aliquot at -80 °C. Use immediately (30 minutes) after solubilization in buffer. |
| 1 ml gas-tight syringe | Hamilton | #1001 | |
| 10 ml round flask | Schott Duran | ||
| 2.7 mm glas beads | Roth | N032.1 | |
| 2-Propanole | Roth | 9866.5 | |
| 30 cm Luer-Lock Extension Tube | Sarstedt | 744304 | |
| Acetone | Roth | 5025.5 | |
| Bio-Beads SM-2 Adsorbent | Bio-Rad | 152-3920 | need to be activated before first use |
| CaCl2 Dihydrat | Roth | HN04.3 | |
| Calcein | Sigma | C0875 | store dark at -20 °C |
| Chloroform reagent grade | VWR Chemicals | 22711324 | |
| DOPEATTO390 | ATTO-TEC | AD 390-165 | store dark at -20 °C |
| Ethanol absolute | Sigma-Aldrich | 32205 | |
| Injekt Single-use syringe | Braun | 460 60 51V | |
| Injekt-F single-use syringe | Braun | 91 66 017V | |
| Keck clips | Schott | KC29 | |
| L-α-Phosphatidylcholine, 20% (Soy) | Avanti Polar Lipids | 5416016 | store under inert gas at -20 °C |
| NaCl 99.5% p.a. | Roth | 3957.2 | |
| Nanopore E100 wafer/chips | Micromotive (Mainz/Germany) | available on request | |
| Nucleopore Track-Etch Membrane 0.4 µm | Whatman | 800282 | |
| Oregon Green Dextran 488 (70 kDa) | life Technologies | D-7173 | store dark at -20 °C |
| Oy647 | Luminartis (Münster/Germany) | OY-647-T-1mg | store dark at -20 °C |
| Rotilabo-syringe filtration, unsterile, pore-size 0.22 µm | Roth | P 818.1 | |
| Sephadex G-50 | Sigma-Aldrich | G5080 | column material for size exclusion chromatography |
| Silastic MDX4-4210 | Dow Corning | curing agent for chip fixation onto cover glass support | |
| sticky-Slide 8-well | ibidi | 80828 | multi-well chamber for the mounting onto glass slides (chip holder) |
| Three-way stopcock blue | Sarstedt | 744410001 | |
| Tris Pufferan 99.9% Ultra Quality | Roth | 5429.2 | |
| Triton-X 100 | Roth | 6683.1 | |
| Whatman 0.2 µm cellulose nitrate membrane filter | Roth | NH69.1 | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Büchi 461 water bath | Büchi | ||
| Büchi Rotavapor RE 111 | Büchi | ||
| Cary Eclipse Fluorescence Spectrophtometer | Varian | ||
| LiposoFast Mini Extruder | Avestin | ||
| Membrane pump | Vaccubrand | 15430 | |
| Nanosight Nanoparticle Tracking Microscope | Malvern / Nanosight | LM 14C | |
| NyONE microscope | Synentec | available on request | |
| Pump control | Vaccubrand | CVC 2II | |
| Sonicator bath Sonorex RK100H | Brandelin electronic | 31200001107477 | |
| Vaccum pump RC5 | Vaccubrand | 1805400204 | |
| Water bath W13 | Haake | 002-9910 | |
| Plasma Cleaner PDC-37G | Harrick Plasma | PDC-37G | |
| Name | Company | Catalog Number | Comments |
| Software | |||
| ImageJ | Open Source | http://imagej.nih.gov/ij/ | scientific image processing software |
| NanoCalcFX | Freeware | http://sourceforge.net/projects/nanocalc/ | data analysis/evaluation software for massive transport kinetic datasets |
| NTA 2.3 Analytical Software | Nanosight | data acquisition and analysis software for nanoparticle tracking microscope | |
| NTA 2.3 Temperature Comms | Nanosight | temperature controle software for nanoparticle tracking microscope |
References
- Yildirim, M. A., Goh, K. I., Cusick, M. E., Barabasi, A. L., Vidal, M. Drug-target network. Nat Biotechnol. 25, 1119 (2007).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflugers Arch. 391, 85-100 (1981).
- Osaki, T., Suzuki, H., Le Pioufle, B., Takeuchi, S. Multichannel simultaneous measurements of single-molecule translocation in α-hemolysin nanopore array. Anal. Chem. 81, 9866-9870 (2009).
- Carrillo, L., et al. High-resolution membrane capacitance measurements for studying endocytosis and exocytosis in yeast. Traffic. , (2015).
- Giacomini, K. M., et al. Membrane transporters in drug development. Nat. Rev. Drug Discov. 9, 215-236 (2010).
- Castell, O. K., Berridge, J., Wallace, M. I. Quantification of membrane protein inhibition by optical ion flux in a droplet interface bilayer array. Angew. Chem. Int. Ed. 51, 3134-3138 (2012).
- Zollmann, T., et al. Single liposome analysis of peptide translocation by the ABC transporter TAPL. Proc. Natl. Acad. Sci. U.S.A. 112, 2046-2051 (2015).
- Tamm, L. K., McConnell, H. M. Supported phospholipid bilayers. Biophys. J. 47, 105-113 (1985).
- Sackmann, E. Supported membranes: scientific and practical applications. Science. 271, 43-48 (1996).
- Castellana, E. T., Cremer, P. S. Solid supported lipid bilayers: From biophysical studies to sensor design. Surf. Sci. Rep. 61, 429-444 (2006).
- Wagner, M. L., Tamm, L. K. Tethered polymer-supported planar lipid bilayers for reconstitution of integral membrane proteins: silane-polyethyleneglycol-lipid as a cushion and covalent linker. Biophys. J. 79, 1400-1414 (2000).
- Naumann, C. A., et al. The polymer-supported phospholipid bilayer: tethering as a new approach to substrate-membrane stabilization. Biomacromolecules. 3, 27-35 (2002).
- Weiskopf, D., Schmitt, E. K., Klühr, M. H., Dertinger, S. K., Steinem, C. Micro-BLMs on highly ordered porous silicon substrates: Rupture process and lateral mobility. Langmuir. 23, 9134-9139 (2007).
- Watanabe, R., et al. Arrayed lipid bilayer chambers allow single-molecule analysis of membrane transporter activity. Nat. Commun. 5, (2014).
- Stamou, D., Duschl, C., Delamarche, E., Vogel, H. Self-Assembled Microarrays of Attoliter Molecular Vessels. Angew. Chem. Int. Ed. 115, 5738-5741 (2003).
- Lohr, C., et al. Single Liposomes Used to Study the Activity of Individual Transporters. Biophysical Journal. 106, 229a (2014).
- Dunlop, J., Bowlby, M., Peri, R., Vasilyev, D., Arias, R. High-throughput electrophysiology: an emerging paradigm for ion-channel screening and physiology. Nat. Rev. Drug Discov. 7, 358-368 (2008).
- Milligan, C. J., et al. Robotic multiwell planar patch-clamp for native and primary mammalian cells. Nat. Protoc. 4, 244-255 (2009).
- Soga, N., Watanabe, R., Noji, H. Attolitre-sized lipid bilayer chamber array for rapid detection of single transporters. Sci. Rep. 5, (2015).
- Kleefen, A., et al. Multiplexed parallel single transport recordings on nanopore arrays. Nano Lett. 10, 5080-5087 (2010).
- Wei, R., Gatterdam, V., Wieneke, R., Tampé, R., Rant, U. Stochastic sensing of proteins with receptor-modified solid-state nanopores. Nat. Nanotechnol. 7, 257-263 (2012).
- Urban, M., et al. Highly parallel transport recordings on a membrane-on-nanopore chip at single molecule resolution. Nano Lett. 14, 1674-1680 (2014).
- Kusters, I., Van Oijen, A. M., Driessen, A. J. Membrane-on-a-Chip: Microstructured Silicon/Silicon-Dioxide Chips for High-Throughput Screening of Membrane Transport and Viral Membrane Fusion. ACS Nano. 8, 3380-3392 (2014).
- Hansen, J. S., Thompson, J. R., Hélix-Nielsen, C., Malmstadt, N. Lipid directed intrinsic membrane protein segregation. J. Am. Chem. Soc. 135, 17294-17297 (2013).
- Heinemann, F., Schwille, P. Preparation of Micrometer-Sized Free-Standing Membranes. ChemPhysChem. 12, 2568-2571 (2011).
- Lazzara, T. D., Carnarius, C., Kocun, M., Janshoff, A., Steinem, C. Separating attoliter-sized compartments using fluid pore-spanning lipid bilayers. ACS nano. 5, 6935-6944 (2011).
- Winterhalter, M. Black lipid membranes. Curr. Opin. Colloid Interface Sci. 5, 250-255 (2000).
- Koçer, A., Walko, M., Feringa, B. L. Synthesis and utilization of reversible and irreversible light-activated nanovalves derived from the channel protein MscL. Nat. Protoc. 2, 1426-1437 (2007).

