Membran transportprosesser analysert av en Highly Parallel nanopore Chip Systemet ved enkelt Protein Oppløsning
Summary
The presented protocol describes the analysis of membrane protein mediated transport on the single transporter level using pore-spanning solvent-free lipid bilayers. This is achieved by the creation of bulk produced nanopore array chips, combined with highly parallel data acquisition and analysis, enabling the future establishment of membrane protein effector screenings.
Abstract
Membranprotein transport på den ene proteinnivået fortsatt omgår detaljert analyse, hvis underlaget translokert er ikke-electrogenic. Store anstrengelser har blitt gjort på dette felt, men teknikker som muliggjør automatisert high-throughput transport analyse i kombinasjon med løsemiddelfrie lipid-dobbeltlag-teknikker som er nødvendige for analyse av membran transportører er sjeldne. Denne klassen av transportører er imidlertid avgjørende i celle homeostase og derfor et viktig mål i utvikling av legemidler og metoder for å få ny innsikt desperat behov.
De her presenterte manuskriptet beskriver etablering og gjennomføring av en ny biochip for analyse av membranprotein mediert transportprosesser ved én transportør oppløsning. Den biochip består av mikrohulrom omsluttet av nanopores som er svært parallell i sin utforming og kan produseres i industriell karakter og kvantitet. Protein-husing liposomer kan direkte brukes tilchip overflaten danner selv montert pore spennende lipidbilagene bruker SSM-teknikker (solid støttet lipid membraner). Pore-spenner deler av membranen er frittstående, noe som gir grensesnittet til substratet translokasjon inn i eller ut av hulrommet plass, noe som kan være etterfulgt av multispektral fluorescerende avlesning i sanntid. Etablering av standard operasjonsprosedyrer (SOP) tillater enkel etablering av protein-husing lipidbilagene på brikken overflaten av nesten alle membranprotein som kan bli rekonstituert funksjonelt. Den eneste forutsetningen er etablering av et fluorescerende lese-out system for non-electrogenic transport underlag.
Høye-innhold screening programmer er accomplishable ved bruk av automatiserte invertert fluorescerende mikroskop opptak flere chips i parallell. Store datasett kan analyseres ved hjelp av fritt tilgjengelig spesialdesignede analyse programvare. Tre-farge multi spektral fluorescerenderead-out videre åpner for objektiv data diskriminering i ulike hendelses klasser, eliminere falske positive resultater.
Brikken teknologien er i dag basert på SiO 2 flater, men ytterligere funksjon hjelp gullbelagt chip overflater er også mulig.
Introduction
Analysen av membran proteiner har blitt av økende interesse for grunnleggende og farmasøytisk forskning de siste 20 årene. Utvikling av nye legemidler avhenger av identifisering og detaljert karakterisering av nye mål, som for tiden er en av de begrensende faktorer. Det faktum at omtrent 60% av alle drug targets er membranproteiner 1, gjør utvikling av teknikker for å klargjøre deres funksjon viktigst.
I det siste har teknikker for studiet av electrogenic kanaler og transportører er utviklet i folkemengden 2-4. Non-electrogenic substrater i strid presentere en mer utfordrende oppgave. De er imidlertid av spesiell interesse som prim stoffet mål, som de kontrollerer strømmen av oppløste stoffer og næringsstoffer over cellemembranen og funksjon som sentrale reseptorer i signaleringskaskader 5.
Betydelig innsats har blitt satt inn i utviklingen av techniques for å studere funksjonen av membranen transportproteiner 6, 7. Systemer som bruker faste-støttet membraner har dukket opp som mest lovende verktøy i dette feltet 8-10, inkludert solide støttet lipidbilagene, forankrede bilag 11, 12, microblack lipid membraner 13, 14 og innfødte vesikkel arrays 15, 16 for å nevne noen. Noen av dem er også tilgjengelig som kommersielle oppsett 17, 18. Noen eksempler er publisert som kombinerer evnen til å studere enkeltmembranproteiner i et sterkt parallell måte 14, 19, er en forutsetning for screening anvendelser. Men disse metodene sjelden bro fra grunnforskning til industrielle miljøet. De vanskeligheter som ofte ligge i systemets evne til å være automat, kostnadskrevende produksjon og / eller arbeidskrevende fremstilling. En tilnærming overcoming alle de ovennevnte hindringer er det endelige målet.
Teknikken presenteres her ble utviklet for å studere membran kanaler og transportører for in vitro i et kontrollert miljø på den eneste proteinnivået 20-22. Tilberedning av renset membran proteiner i LUV er mye mer etablert enn sammenlignbare tilnærminger for GUVs 23 – 26 eller svart lipid membraner 27. De kan direkte brukes til chip overflaten, hvor bilagsdannelse finner sted via en selvmonteringsprosessen. Den glassbunn utformingen av nanoporøse brikke (fig. 1) gjør det mulig for luft mikroskopi, som tillater enkel automatisering av systemet. I kombinasjon med en motorisert scene flere brikker kan måles samtidig, med hver synsfelt som inneholder tusenvis av forseglede hulrom for analyse.
<p class="jove_content" fo:keep-together.within-page= "En">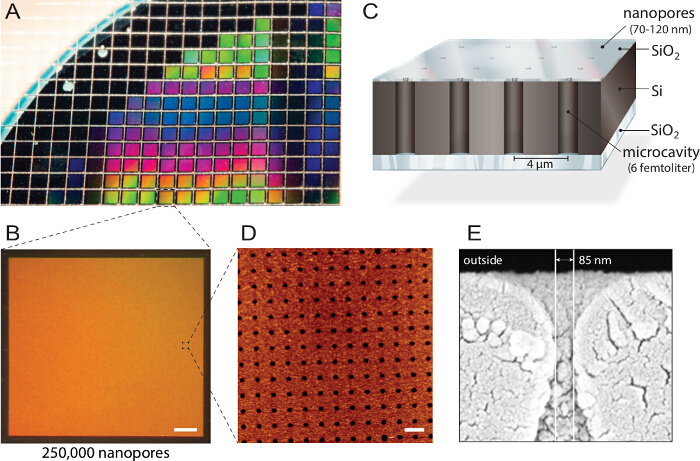
Figur 1. Utformingen av multipleksede nanopore biochips. A) en silisium-på-isolator (SOI) skive er strukturert ved reaktiv-ione-etsing. Omtrent 1150 individuelle chips er fabrikkert fra hver wafer med identiske egenskaper og kvalitet. B) Hver brikke består av 250.000 individuelle mikrohulrom med nano åpninger. Skala:. 200 mikrometer C) Hver hulrom er adresser via multispektrale fluorescens leses ut. En intransparent øverste laget blokker de fluorescerende signaler fra bufferreservoaret, noe som gjør det biochip forenlig med inverterte fluorescensmikroskoper. D) atomkraftmikroskopi (AFM) avbildning avslører jevnt anordnet poreåpninger og overflateruheten av de silisiumdioksidlag på 3,6 nm (n = 40) optimal for vesikkelfusjon. Skala:. 5 mikrometer E) Scanning elektron microscopy (SEM) bilde viser et tverrsnitt gjennom den nanopore gir tilgang til femtoliter hulrom inne i silisiumbrikke. Dette tallet ble brukt på nytt med tillatelse fra 21. Klikk her for å se en større versjon av denne figuren.
All dataanalyse er utført ved hjelp av freeware å garantere ubegrenset tilgang for sluttbrukere. Tidsserier er analysert ved hjelp av gratis bildebehandlingsprogram og en tilpasset bygge kurve analyse programvare muliggjør batch prosessering og grei korrelasjon av store datasett med flere fluorescerende kanaler og tusenvis av kurver.
Modellen protein som brukes i denne protokollen er den mechanosensitive kanal av stor ledningsevne (MsCl) kanal protein avledet fra E. coli. Det fungerer som en ventil for å frigjøre osmotisk sjokk i naturen, men ble modifisert på en slik måte at rasjonelt konstruert synthetic funksjonalitet kan kovalent festes til kanalene innsnevring side. Via kostnad-frastøting av kovalent bundet aktivator (MTSET) kanalen utløses for å åpne, og skaper en nano-ventil. Små molekyler som ioner, vann, små proteiner, men også små fluoroforer kan trenge gjennom kanalen. Her blir proteinet brukes som en modell for å demonstrere evnen av systemet for å påvise protein-mediert translokasjon.
Protocol
Representative Results
Discussion
Teknikken som presenteres her gir en svært parallell analyse av membranprotein transport. Rekonstituerte membranproteinsystemer kan direkte brukes til biochip, slik at tilpasning av teoretisk hver membrantransportøren eller kanal mulig. Transport analyse er bare begrenset av etableringen av et fluorescerende lese-out system, enten via direkte fluorescens endring (translokasjon av fluorophores eller fluorescensmerkede underlag) eller indirekte fluorescens endring (pH-følsomme fargestoffer, sekundære enzymatiske reaks…
Disclosures
The authors have nothing to disclose.
Acknowledgements
We thank Barbara Windschiegl for her help in establishing SOPs; Dennis Remme for his work on the NanoCalcFX software and Alina Kollmannsperger, Markus Braner and Milan Gerovac for helpful suggestions on the manuscript. The German-Israeli Project Cooperation (DIP) provided by the DFG and the Federal Ministry of Education and Research to R.T., as well as the Federal Ministry of Economics and Technology (ZIM R&D Project) to R.T. and Nanospot GmbH supported this work.
Materials
| Reagent | |||
| [2-(Trimethylammonium)ethyl] methanethiosulfonate |
Toronto Research Chemicals Inc. | T792900 | MTSET; hydrolized by water. Keep as dry pouder aliquot at -80 °C. Use immediately (30 minutes) after solubilization in buffer. |
| 1 ml gas-tight syringe | Hamilton | #1001 | |
| 10 ml round flask | Schott Duran | ||
| 2.7 mm glas beads | Roth | N032.1 | |
| 2-Propanole | Roth | 9866.5 | |
| 30 cm Luer-Lock Extension Tube | Sarstedt | 744304 | |
| Acetone | Roth | 5025.5 | |
| Bio-Beads SM-2 Adsorbent | Bio-Rad | 152-3920 | need to be activated before first use |
| CaCl2 Dihydrat | Roth | HN04.3 | |
| Calcein | Sigma | C0875 | store dark at -20 °C |
| Chloroform reagent grade | VWR Chemicals | 22711324 | |
| DOPEATTO390 | ATTO-TEC | AD 390-165 | store dark at -20 °C |
| Ethanol absolute | Sigma-Aldrich | 32205 | |
| Injekt Single-use syringe | Braun | 460 60 51V | |
| Injekt-F single-use syringe | Braun | 91 66 017V | |
| Keck clips | Schott | KC29 | |
| L-α-Phosphatidylcholine, 20% (Soy) | Avanti Polar Lipids | 5416016 | store under inert gas at -20 °C |
| NaCl 99.5% p.a. | Roth | 3957.2 | |
| Nanopore E100 wafer/chips | Micromotive (Mainz/Germany) | available on request | |
| Nucleopore Track-Etch Membrane 0.4 µm | Whatman | 800282 | |
| Oregon Green Dextran 488 (70 kDa) | life Technologies | D-7173 | store dark at -20 °C |
| Oy647 | Luminartis (Münster/Germany) | OY-647-T-1mg | store dark at -20 °C |
| Rotilabo-syringe filtration, unsterile, pore-size 0.22 µm | Roth | P 818.1 | |
| Sephadex G-50 | Sigma-Aldrich | G5080 | column material for size exclusion chromatography |
| Silastic MDX4-4210 | Dow Corning | curing agent for chip fixation onto cover glass support | |
| sticky-Slide 8-well | ibidi | 80828 | multi-well chamber for the mounting onto glass slides (chip holder) |
| Three-way stopcock blue | Sarstedt | 744410001 | |
| Tris Pufferan 99.9% Ultra Quality | Roth | 5429.2 | |
| Triton-X 100 | Roth | 6683.1 | |
| Whatman 0.2 µm cellulose nitrate membrane filter | Roth | NH69.1 | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Büchi 461 water bath | Büchi | ||
| Büchi Rotavapor RE 111 | Büchi | ||
| Cary Eclipse Fluorescence Spectrophtometer | Varian | ||
| LiposoFast Mini Extruder | Avestin | ||
| Membrane pump | Vaccubrand | 15430 | |
| Nanosight Nanoparticle Tracking Microscope | Malvern / Nanosight | LM 14C | |
| NyONE microscope | Synentec | available on request | |
| Pump control | Vaccubrand | CVC 2II | |
| Sonicator bath Sonorex RK100H | Brandelin electronic | 31200001107477 | |
| Vaccum pump RC5 | Vaccubrand | 1805400204 | |
| Water bath W13 | Haake | 002-9910 | |
| Plasma Cleaner PDC-37G | Harrick Plasma | PDC-37G | |
| Name | Company | Catalog Number | Comments |
| Software | |||
| ImageJ | Open Source | http://imagej.nih.gov/ij/ | scientific image processing software |
| NanoCalcFX | Freeware | http://sourceforge.net/projects/nanocalc/ | data analysis/evaluation software for massive transport kinetic datasets |
| NTA 2.3 Analytical Software | Nanosight | data acquisition and analysis software for nanoparticle tracking microscope | |
| NTA 2.3 Temperature Comms | Nanosight | temperature controle software for nanoparticle tracking microscope |
References
- Yildirim, M. A., Goh, K. I., Cusick, M. E., Barabasi, A. L., Vidal, M. Drug-target network. Nat Biotechnol. 25, 1119 (2007).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflugers Arch. 391, 85-100 (1981).
- Osaki, T., Suzuki, H., Le Pioufle, B., Takeuchi, S. Multichannel simultaneous measurements of single-molecule translocation in α-hemolysin nanopore array. Anal. Chem. 81, 9866-9870 (2009).
- Carrillo, L., et al. High-resolution membrane capacitance measurements for studying endocytosis and exocytosis in yeast. Traffic. , (2015).
- Giacomini, K. M., et al. Membrane transporters in drug development. Nat. Rev. Drug Discov. 9, 215-236 (2010).
- Castell, O. K., Berridge, J., Wallace, M. I. Quantification of membrane protein inhibition by optical ion flux in a droplet interface bilayer array. Angew. Chem. Int. Ed. 51, 3134-3138 (2012).
- Zollmann, T., et al. Single liposome analysis of peptide translocation by the ABC transporter TAPL. Proc. Natl. Acad. Sci. U.S.A. 112, 2046-2051 (2015).
- Tamm, L. K., McConnell, H. M. Supported phospholipid bilayers. Biophys. J. 47, 105-113 (1985).
- Sackmann, E. Supported membranes: scientific and practical applications. Science. 271, 43-48 (1996).
- Castellana, E. T., Cremer, P. S. Solid supported lipid bilayers: From biophysical studies to sensor design. Surf. Sci. Rep. 61, 429-444 (2006).
- Wagner, M. L., Tamm, L. K. Tethered polymer-supported planar lipid bilayers for reconstitution of integral membrane proteins: silane-polyethyleneglycol-lipid as a cushion and covalent linker. Biophys. J. 79, 1400-1414 (2000).
- Naumann, C. A., et al. The polymer-supported phospholipid bilayer: tethering as a new approach to substrate-membrane stabilization. Biomacromolecules. 3, 27-35 (2002).
- Weiskopf, D., Schmitt, E. K., Klühr, M. H., Dertinger, S. K., Steinem, C. Micro-BLMs on highly ordered porous silicon substrates: Rupture process and lateral mobility. Langmuir. 23, 9134-9139 (2007).
- Watanabe, R., et al. Arrayed lipid bilayer chambers allow single-molecule analysis of membrane transporter activity. Nat. Commun. 5, (2014).
- Stamou, D., Duschl, C., Delamarche, E., Vogel, H. Self-Assembled Microarrays of Attoliter Molecular Vessels. Angew. Chem. Int. Ed. 115, 5738-5741 (2003).
- Lohr, C., et al. Single Liposomes Used to Study the Activity of Individual Transporters. Biophysical Journal. 106, 229a (2014).
- Dunlop, J., Bowlby, M., Peri, R., Vasilyev, D., Arias, R. High-throughput electrophysiology: an emerging paradigm for ion-channel screening and physiology. Nat. Rev. Drug Discov. 7, 358-368 (2008).
- Milligan, C. J., et al. Robotic multiwell planar patch-clamp for native and primary mammalian cells. Nat. Protoc. 4, 244-255 (2009).
- Soga, N., Watanabe, R., Noji, H. Attolitre-sized lipid bilayer chamber array for rapid detection of single transporters. Sci. Rep. 5, (2015).
- Kleefen, A., et al. Multiplexed parallel single transport recordings on nanopore arrays. Nano Lett. 10, 5080-5087 (2010).
- Wei, R., Gatterdam, V., Wieneke, R., Tampé, R., Rant, U. Stochastic sensing of proteins with receptor-modified solid-state nanopores. Nat. Nanotechnol. 7, 257-263 (2012).
- Urban, M., et al. Highly parallel transport recordings on a membrane-on-nanopore chip at single molecule resolution. Nano Lett. 14, 1674-1680 (2014).
- Kusters, I., Van Oijen, A. M., Driessen, A. J. Membrane-on-a-Chip: Microstructured Silicon/Silicon-Dioxide Chips for High-Throughput Screening of Membrane Transport and Viral Membrane Fusion. ACS Nano. 8, 3380-3392 (2014).
- Hansen, J. S., Thompson, J. R., Hélix-Nielsen, C., Malmstadt, N. Lipid directed intrinsic membrane protein segregation. J. Am. Chem. Soc. 135, 17294-17297 (2013).
- Heinemann, F., Schwille, P. Preparation of Micrometer-Sized Free-Standing Membranes. ChemPhysChem. 12, 2568-2571 (2011).
- Lazzara, T. D., Carnarius, C., Kocun, M., Janshoff, A., Steinem, C. Separating attoliter-sized compartments using fluid pore-spanning lipid bilayers. ACS nano. 5, 6935-6944 (2011).
- Winterhalter, M. Black lipid membranes. Curr. Opin. Colloid Interface Sci. 5, 250-255 (2000).
- Koçer, A., Walko, M., Feringa, B. L. Synthesis and utilization of reversible and irreversible light-activated nanovalves derived from the channel protein MscL. Nat. Protoc. 2, 1426-1437 (2007).

