Мембранные процессы переноса анализироваться Высококвалифицированные параллельной системы нанопор чип Разрешение одного белка
Summary
The presented protocol describes the analysis of membrane protein mediated transport on the single transporter level using pore-spanning solvent-free lipid bilayers. This is achieved by the creation of bulk produced nanopore array chips, combined with highly parallel data acquisition and analysis, enabling the future establishment of membrane protein effector screenings.
Abstract
Мембранного белка транспорта на одном уровне белка все еще уклоняется детальный анализ, если субстрат транслоцируются не является электрогенный. Значительные усилия были предприняты в этой области, но методы, позволяющие автоматизированный анализ высокой пропускной способностью транспорта в сочетании с не содержащих растворителей методами двухслойных липидов, необходимых для анализа мембранных транспортеров являются редкими. Этот класс транспортеров однако имеет решающее значение в ячейке гомеостаза и, следовательно, ключевой целью в разработке и методологий, чтобы получить новое понимание наркотиков крайне необходимо.
Здесь представлена рукопись описывает создание и обработку нового биочипа для анализа процессов переноса белковых опосредованной мембраны при одной резолюции переносчика. Биочипа состоит из микрорезонаторах приложенных нанопор, что чрезвычайно параллельный в своей конструкции и могут быть произведены в промышленном сортности и количестве. Белково-укрывает Липосомы могут непосредственно применяться кчип поверхность формирования самоорганизующихся пор остовного бислоев с использованием ССМ-методов (твердый поддерживается липидные мембраны). Поры остовного части мембраны отдельно стоящая, обеспечивая интерфейс для транслокации субстрата в или из пространства полости, что может сопровождаться мультиспектрального флуоресцентного считывания в режиме реального времени. Создание стандартных операционных процедур (СОП) позволяет прямое создание белка-укрывает липидного бислоя на поверхности чипа практически каждого мембранного белка, который может быть восстановленным функционально. Единственным условием является создание люминесцентной системы считыванием для не электрогенных транспортных субстратов.
высокопроизводительных приложений содержание скрининга осуществимы за счет использования автоматизированных перевернутых флуоресцентных микроскопов записи нескольких чипов параллельно. Большие наборы данных могут быть проанализированы с помощью свободно доступных специально разработанный программного обеспечения для анализа. Трехцветный мульти спектральная люминесцентнаясчитывание, кроме того, позволяет непредвзято дискриминации данных на различные классы событий, исключая ложные положительные результаты.
Технологии чипа в настоящее время базируется на SiO 2 поверхностях, но дополнительно функционализации с использованием поверхности чипа с золотым покрытием также возможно.
Introduction
Анализ мембранных белков стал повышенный интерес к основной и фармацевтических исследований в течение последних 20 лет. Разработка новых лекарственных средств зависит от идентификации и детальной характеристики новых целей, в настоящее время является одним из факторов, ограничивающих. Тот факт , что около 60% всех лекарственных мишеней являются мембранными белками , 1, делает разработку методов для выяснения их функции наиболее важной.
В прошлом, методы для изучения электрогенных каналов и транспортеров, были разработаны во множестве 2 – 4. Non-электрогенных субстратов в наоборот представляют собой более сложную задачу. Они, однако , представляют особый интерес в качестве главных мишеней для лекарственных средств, поскольку они контролируют поток растворенных веществ и питательных веществ через клеточную мембрану и функции в качестве ключевых рецепторов в сигнальных каскадов 5.
Значительные усилия были введены в разработку тechniques изучить функцию мембранных транспортных белков 6, 7. Системы , использующие на твердой подложке мембран появились как наиболее перспективные инструменты в этой области 8 – 10, в том числе твердых поддерживаемых липидных бислоев, привязанные Бислои 11, 12, microblack липидные мембраны 13, 14 и родной везикул массивов 15, 16 , чтобы назвать несколько. Некоторые из них даже доступны в качестве коммерческих установок 17, 18. Некоторые примеры были опубликованы комбинируя возможность изучать одиночные мембранные белки в очень параллельно 14, 19, является необходимым условием для отбора заявок. Тем не менее, эти методы редко мост от фундаментальных исследований к промышленной среде. Трудности часто заключаются в способности системы, чтобы быть автоматизированы, дорогостоящем производства и / или кропотливой подготовки. Подход оvercoming все вышеперечисленные препятствия является конечной целью.
Методика представлена здесь была разработана для изучения мембранных каналов и транспортеров в пробирке в контролируемой среде на одном уровне белка 20 – 22. Воссоздание очищенных мембранных белков в БУВ гораздо более , чем установлено , сопоставимых подходов к GUVs 23 – 26 или черный липидные мембраны 27. Они могут быть непосредственно нанесена на поверхность чипа, где возможно образование бислой проходит через процесс самосборки. Со стеклянным дном конструкция нанопористых чипа (рис. 1) позволяет воздушной микроскопии другим , что обеспечивает простую автоматизацию системы. В сочетании с моторизованным этапе множественные чипы могут быть измерены в то же время, с каждым полем зрения, содержащих тысячи закрытых полостей для анализа.
<p class="jove_content" fo:keep-together.within-page= "1">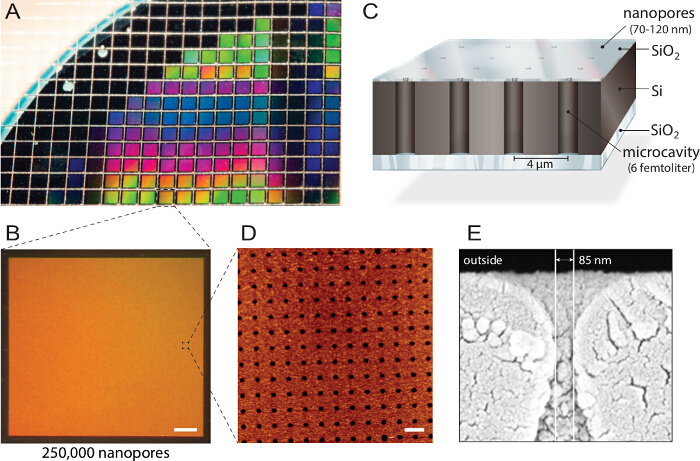
Рисунок 1. Дизайн мультиплексированных нанопористых биочипов. А) кремний на диэлектрике (КНД) пластина структурирована реактивно-ионное травление. Приблизительно 1,150 отдельные микросхемы изготавливаются из каждой пластины с одинаковыми свойствами и качеством. B) Каждый чип содержит отдельные 250000 микрорезонаторов с нано отверстиями. Шкала бар:. 200 мкм C) Каждая полость адресуется с помощью многоспектральная флуоресценции считывания. An непрозрачными блоки Верхний слой флуоресцентные сигналы от буферного резервуара, что делает биочип совместимым с перевернутыми микроскопов флуоресценции. D) атомно – силовой микроскопии (АСМ) изображений выявляет равномерно расположены отверстия пор и шероховатость поверхности слоя диоксида кремния 3,6 нм (п = 40) оптимальным для слияния пузырьков. Шкала бар:. 5 мкм E) Сканирующий электронный микрофонroscopy (СЭМ) изображение показывает поперечное сечение через нанопоры разрешение доступа к femtoliter полостей внутри кремниевого чипа. Эта цифра была повторно с разрешения 21. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Весь анализ данных осуществляется с помощью бесплатное программное обеспечение, чтобы гарантировать неограниченный доступ для конечных пользователей. Временные ряды анализируются с помощью бесплатного программного обеспечения для обработки изображений и пользовательской кривой сборки программного обеспечения для анализа, позволяющий пакетной обработки и прямой корреляции больших наборов данных с несколькими флуоресцентными каналами и тысячи кривых.
Протеин модель , используемая в данном протоколе является механочувствительных канал большой проводимости канала (MSCL) белка , полученного из E. палочки. Он функционирует как клапан, чтобы выпустить осмотический шок по своей природе, но был изменен таким образом, чтобы рационально разработанной Synthetic функциональность может быть ковалентно присоединен к стороне канала сдавливания. Через заряда-отталкивания, ковалентно связанного активатора (MTSET) канал запускается для открытия, создания нано-клапан. Малые молекулы, такие как ионы, вода, небольшие белки, но и небольшие флуорофоров могут проникать через канал. Здесь, белок используется в качестве модели для демонстрации способности системы выявлять белок-опосредованного транслокацию.
Protocol
Representative Results
Discussion
Методика представлена здесь позволяет высокопараллельной анализ мембранного транспорта белков. Восстановленные системы мембранного белка может быть непосредственно применен к биочипа, что делает приспособлении теоретически каждый мембранный переносчик или канал, это возможно….
Disclosures
The authors have nothing to disclose.
Acknowledgements
We thank Barbara Windschiegl for her help in establishing SOPs; Dennis Remme for his work on the NanoCalcFX software and Alina Kollmannsperger, Markus Braner and Milan Gerovac for helpful suggestions on the manuscript. The German-Israeli Project Cooperation (DIP) provided by the DFG and the Federal Ministry of Education and Research to R.T., as well as the Federal Ministry of Economics and Technology (ZIM R&D Project) to R.T. and Nanospot GmbH supported this work.
Materials
| Reagent | |||
| [2-(Trimethylammonium)ethyl] methanethiosulfonate |
Toronto Research Chemicals Inc. | T792900 | MTSET; hydrolized by water. Keep as dry pouder aliquot at -80 °C. Use immediately (30 minutes) after solubilization in buffer. |
| 1 ml gas-tight syringe | Hamilton | #1001 | |
| 10 ml round flask | Schott Duran | ||
| 2.7 mm glas beads | Roth | N032.1 | |
| 2-Propanole | Roth | 9866.5 | |
| 30 cm Luer-Lock Extension Tube | Sarstedt | 744304 | |
| Acetone | Roth | 5025.5 | |
| Bio-Beads SM-2 Adsorbent | Bio-Rad | 152-3920 | need to be activated before first use |
| CaCl2 Dihydrat | Roth | HN04.3 | |
| Calcein | Sigma | C0875 | store dark at -20 °C |
| Chloroform reagent grade | VWR Chemicals | 22711324 | |
| DOPEATTO390 | ATTO-TEC | AD 390-165 | store dark at -20 °C |
| Ethanol absolute | Sigma-Aldrich | 32205 | |
| Injekt Single-use syringe | Braun | 460 60 51V | |
| Injekt-F single-use syringe | Braun | 91 66 017V | |
| Keck clips | Schott | KC29 | |
| L-α-Phosphatidylcholine, 20% (Soy) | Avanti Polar Lipids | 5416016 | store under inert gas at -20 °C |
| NaCl 99.5% p.a. | Roth | 3957.2 | |
| Nanopore E100 wafer/chips | Micromotive (Mainz/Germany) | available on request | |
| Nucleopore Track-Etch Membrane 0.4 µm | Whatman | 800282 | |
| Oregon Green Dextran 488 (70 kDa) | life Technologies | D-7173 | store dark at -20 °C |
| Oy647 | Luminartis (Münster/Germany) | OY-647-T-1mg | store dark at -20 °C |
| Rotilabo-syringe filtration, unsterile, pore-size 0.22 µm | Roth | P 818.1 | |
| Sephadex G-50 | Sigma-Aldrich | G5080 | column material for size exclusion chromatography |
| Silastic MDX4-4210 | Dow Corning | curing agent for chip fixation onto cover glass support | |
| sticky-Slide 8-well | ibidi | 80828 | multi-well chamber for the mounting onto glass slides (chip holder) |
| Three-way stopcock blue | Sarstedt | 744410001 | |
| Tris Pufferan 99.9% Ultra Quality | Roth | 5429.2 | |
| Triton-X 100 | Roth | 6683.1 | |
| Whatman 0.2 µm cellulose nitrate membrane filter | Roth | NH69.1 | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Büchi 461 water bath | Büchi | ||
| Büchi Rotavapor RE 111 | Büchi | ||
| Cary Eclipse Fluorescence Spectrophtometer | Varian | ||
| LiposoFast Mini Extruder | Avestin | ||
| Membrane pump | Vaccubrand | 15430 | |
| Nanosight Nanoparticle Tracking Microscope | Malvern / Nanosight | LM 14C | |
| NyONE microscope | Synentec | available on request | |
| Pump control | Vaccubrand | CVC 2II | |
| Sonicator bath Sonorex RK100H | Brandelin electronic | 31200001107477 | |
| Vaccum pump RC5 | Vaccubrand | 1805400204 | |
| Water bath W13 | Haake | 002-9910 | |
| Plasma Cleaner PDC-37G | Harrick Plasma | PDC-37G | |
| Name | Company | Catalog Number | Comments |
| Software | |||
| ImageJ | Open Source | http://imagej.nih.gov/ij/ | scientific image processing software |
| NanoCalcFX | Freeware | http://sourceforge.net/projects/nanocalc/ | data analysis/evaluation software for massive transport kinetic datasets |
| NTA 2.3 Analytical Software | Nanosight | data acquisition and analysis software for nanoparticle tracking microscope | |
| NTA 2.3 Temperature Comms | Nanosight | temperature controle software for nanoparticle tracking microscope |
References
- Yildirim, M. A., Goh, K. I., Cusick, M. E., Barabasi, A. L., Vidal, M. Drug-target network. Nat Biotechnol. 25, 1119 (2007).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflugers Arch. 391, 85-100 (1981).
- Osaki, T., Suzuki, H., Le Pioufle, B., Takeuchi, S. Multichannel simultaneous measurements of single-molecule translocation in α-hemolysin nanopore array. Anal. Chem. 81, 9866-9870 (2009).
- Carrillo, L., et al. High-resolution membrane capacitance measurements for studying endocytosis and exocytosis in yeast. Traffic. , (2015).
- Giacomini, K. M., et al. Membrane transporters in drug development. Nat. Rev. Drug Discov. 9, 215-236 (2010).
- Castell, O. K., Berridge, J., Wallace, M. I. Quantification of membrane protein inhibition by optical ion flux in a droplet interface bilayer array. Angew. Chem. Int. Ed. 51, 3134-3138 (2012).
- Zollmann, T., et al. Single liposome analysis of peptide translocation by the ABC transporter TAPL. Proc. Natl. Acad. Sci. U.S.A. 112, 2046-2051 (2015).
- Tamm, L. K., McConnell, H. M. Supported phospholipid bilayers. Biophys. J. 47, 105-113 (1985).
- Sackmann, E. Supported membranes: scientific and practical applications. Science. 271, 43-48 (1996).
- Castellana, E. T., Cremer, P. S. Solid supported lipid bilayers: From biophysical studies to sensor design. Surf. Sci. Rep. 61, 429-444 (2006).
- Wagner, M. L., Tamm, L. K. Tethered polymer-supported planar lipid bilayers for reconstitution of integral membrane proteins: silane-polyethyleneglycol-lipid as a cushion and covalent linker. Biophys. J. 79, 1400-1414 (2000).
- Naumann, C. A., et al. The polymer-supported phospholipid bilayer: tethering as a new approach to substrate-membrane stabilization. Biomacromolecules. 3, 27-35 (2002).
- Weiskopf, D., Schmitt, E. K., Klühr, M. H., Dertinger, S. K., Steinem, C. Micro-BLMs on highly ordered porous silicon substrates: Rupture process and lateral mobility. Langmuir. 23, 9134-9139 (2007).
- Watanabe, R., et al. Arrayed lipid bilayer chambers allow single-molecule analysis of membrane transporter activity. Nat. Commun. 5, (2014).
- Stamou, D., Duschl, C., Delamarche, E., Vogel, H. Self-Assembled Microarrays of Attoliter Molecular Vessels. Angew. Chem. Int. Ed. 115, 5738-5741 (2003).
- Lohr, C., et al. Single Liposomes Used to Study the Activity of Individual Transporters. Biophysical Journal. 106, 229a (2014).
- Dunlop, J., Bowlby, M., Peri, R., Vasilyev, D., Arias, R. High-throughput electrophysiology: an emerging paradigm for ion-channel screening and physiology. Nat. Rev. Drug Discov. 7, 358-368 (2008).
- Milligan, C. J., et al. Robotic multiwell planar patch-clamp for native and primary mammalian cells. Nat. Protoc. 4, 244-255 (2009).
- Soga, N., Watanabe, R., Noji, H. Attolitre-sized lipid bilayer chamber array for rapid detection of single transporters. Sci. Rep. 5, (2015).
- Kleefen, A., et al. Multiplexed parallel single transport recordings on nanopore arrays. Nano Lett. 10, 5080-5087 (2010).
- Wei, R., Gatterdam, V., Wieneke, R., Tampé, R., Rant, U. Stochastic sensing of proteins with receptor-modified solid-state nanopores. Nat. Nanotechnol. 7, 257-263 (2012).
- Urban, M., et al. Highly parallel transport recordings on a membrane-on-nanopore chip at single molecule resolution. Nano Lett. 14, 1674-1680 (2014).
- Kusters, I., Van Oijen, A. M., Driessen, A. J. Membrane-on-a-Chip: Microstructured Silicon/Silicon-Dioxide Chips for High-Throughput Screening of Membrane Transport and Viral Membrane Fusion. ACS Nano. 8, 3380-3392 (2014).
- Hansen, J. S., Thompson, J. R., Hélix-Nielsen, C., Malmstadt, N. Lipid directed intrinsic membrane protein segregation. J. Am. Chem. Soc. 135, 17294-17297 (2013).
- Heinemann, F., Schwille, P. Preparation of Micrometer-Sized Free-Standing Membranes. ChemPhysChem. 12, 2568-2571 (2011).
- Lazzara, T. D., Carnarius, C., Kocun, M., Janshoff, A., Steinem, C. Separating attoliter-sized compartments using fluid pore-spanning lipid bilayers. ACS nano. 5, 6935-6944 (2011).
- Winterhalter, M. Black lipid membranes. Curr. Opin. Colloid Interface Sci. 5, 250-255 (2000).
- Koçer, A., Walko, M., Feringa, B. L. Synthesis and utilization of reversible and irreversible light-activated nanovalves derived from the channel protein MscL. Nat. Protoc. 2, 1426-1437 (2007).

