Membrantransportprocesser analyseras av en hög grad parallella nanopore Chip System på Single Protein Upplösning
Summary
The presented protocol describes the analysis of membrane protein mediated transport on the single transporter level using pore-spanning solvent-free lipid bilayers. This is achieved by the creation of bulk produced nanopore array chips, combined with highly parallel data acquisition and analysis, enabling the future establishment of membrane protein effector screenings.
Abstract
Membranprotein transport på den enda proteinnivå undviker fortfarande detaljerad analys, om substratet flyttad är icke-electrogenic. Betydande ansträngningar har gjorts på detta område, men tekniker som gör det möjligt automatiserad transportanalys med hög genomströmning i kombination med lösningsmedelsfria lipiddubbelskiktet teknik som krävs för analys av membrantransportörer är sällsynta. Denna klass av transportörer är dock avgörande för cell homeostas och därför en viktig mål inom läkemedelsutveckling och metoder för att få nya insikter desperat behov.
Den här presenterade manuskript beskriver upprättande och hantering av en ny biochip för analys av membranproteinmedierad transportprocesser vid enstaka transportör upplösning. Den biochip består av mikrokaviteter omges av nanoporer som är mycket parallellt i sin design och kan framställas i industriell kvalitet och kvantitet. Protein-hyser liposomer kan direkt appliceras påspånytan bildar själv monterade por överbryggande lipiddubbelskikt använder SSM-tekniker (fast stöd lipidmembran). Pore överbryggande delar av membranet är fristående, vilket ger det gränssnitt för substrat translokering in i eller ut ur håligheten utrymme, vilket kan följas av multispektralt fluorescerande avläsning i realtid. Inrättandet av standardrutiner (SOP) gör det möjligt att enkelt upprättande av protein hyser lipiddubbelskikt på spånytan av praktiskt taget varje membranprotein som kan beredas funktionellt. Den enda förutsättningen är att inrätta en fluorescerande avläsningssystem för icke-electrogenic transport substrat.
Hög-content screening program är accomplishable genom användning av automatiserade inverterade fluorescerande mikroskop inspelning flera chips parallellt. Stora datamängder kan analyseras med hjälp av fritt tillgängliga skräddarsydda analysprogram. Tre färger flera spektrala fluorescerandeutläsning dessutom möjliggör opartisk diskriminering data i olika händelseklasser, vilket eliminerar falska positiva resultat.
Chip-teknik är för närvarande baserad på SiO 2 ytor, men ytterligare funktionalisering med hjälp av guldbelagda spånytor är också möjligt.
Introduction
Analysen av membranproteiner har blivit av allt större intresse för grundläggande och läkemedelsforskning under de senaste 20 åren. Utvecklingen av nya läkemedel beror på identifiering och detaljerad karakterisering av nya mål, för närvarande är en av de begränsande faktorerna. Det faktum att omkring 60% av alla läkemedelsmål är membranproteiner 1, gör utvecklingen av tekniker för att belysa deras funktion viktigast.
I det förflutna, har tekniker för att studera electrogenic kanaler och transportörer utvecklats i många 2-4. Icke-electrogenic substrat i motsats presentera en mer utmanande uppgift. De är emellertid av speciellt intresse som de främsta läkemedelsmål, eftersom de kontrollerar flödet av upplösta ämnen och näringsämnen genom cellmembranet och fungerar som nyckel receptorer i signaleringskaskader 5.
Betydande ansträngningar har lagts på utveckling av techniques att studera funktionen av membrantransportproteiner 6, 7. System som använder fasta stödda membran har visat sig vara mest lovande verktyg inom detta område 8-10, inklusive fastfasbundna lipiddubbelskikt, förankrade biskikt 11, 12, microblack lipidmembran 13, 14 och nativa vesikel arrayer 15, 16 för att nämna några. Några av dem är även tillgängliga som kommersiella inställningar 17, 18. Några exempel har publicerats som kombinerar förmågan att studera enstaka membranproteiner på ett mycket parallellt sätt 14, 19, en förutsättning för screening program. Men dessa metoder sällan överbrygga från grundforskning till industriell miljö. Svårigheterna ligger ofta i systemets förmåga att vara automatiserade, kostnadsintensiv produktion och / eller mödosam beredning. Ett tillvägagångssätt overcoming alla ovan nämnda hinder är slutmålet.
Tekniken som presenteras här har utvecklats för att studera membrankanalerna och transportörer in vitro i en kontrollerad miljö på den enda proteinnivå 20-22. Beredning av renade membranproteiner i LUV är mycket mer etablerad än jämförbara metoder för GUVs 23 – 26 eller svart lipidmembran 27. De kan direkt appliceras på spånytan, där dubbelskiktsbildningen sker via en självorganiserande processen. Den glasbotten utformning av nanoporösa chip (1 Fig.) Gör det möjligt för luft mikroskopi, som medger enkel automatisering av systemet. I kombination med en motoriserad skede flera chips kan mätas samtidigt, med varje synfält som innehåller tusentals av slutna hålrum för analys.
<p class="jove_content" fo:keep-together.within-page= "1">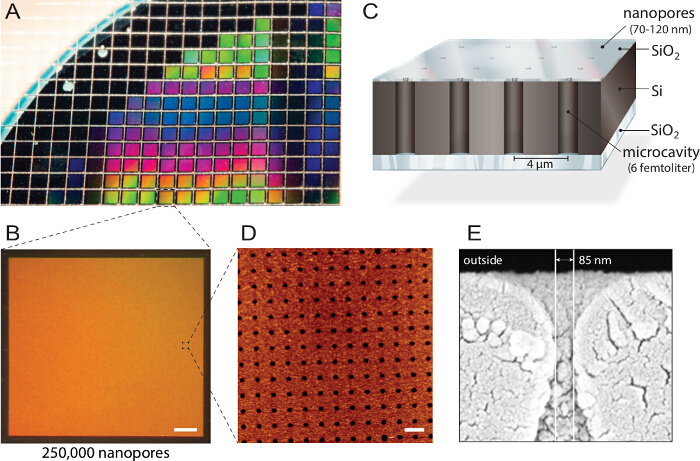
Figur 1. Design multiplexerade nanopore biochips. A) En kisel-på-isolator (SOI) skiva är uppbyggd av reaktiv jonetsning. Cirka 1150 enskilda chips tillverkas av varje skiva med samma egenskaper och kvalitet. B) Varje chip omfattar 250.000 enskilda mikrokaviteter med nano öppningar. Skala bar:. 200 um C) Varje hålrum är adresserbara via multispektrala fluorescens avläsning. En oklar topplagerblock de fluorescerande signalerna från buffertreservoaren, vilket gör biochip kompatibel med inverterat fluorescensmikroskop. D) atomkraftsmikroskopi (AFM) imaging avslöjar jämnt anordnade poröppningar och ytråheten hos kiseldioxidskiktet av 3,6 nm (n = 40) optimal för vesikelfusion. Skala bar. 5 pm E) Svepelektron microscopy (SEM) bild visar en tvärsektion genom nanopore som ger tillgång till de femtoliter håligheter inuti kiselchipset. Denna siffra används med tillstånd från 21. Klicka här för att se en större version av denna siffra.
Alla dataanalys utförs med hjälp av gratisprogram för att garantera obegränsat tillträde för slutanvändare. Tidsserier analyseras med fri programvara för bildbehandling och en anpassad bygga kurva analys mjukvara för batch-bearbetning och rättfram korrelation av stora datamängder med flera fluorescerande kanaler och tusentals kurvor.
Modellen protein som används i detta protokoll är mechanosensitive kanalen för stora konduktans (MsCl) kanal protein från E. coli. Den fungerar som en ventil för att frisätta osmotisk chock i naturen, men modifierades på ett sådant sätt att rationellt utformade synthetic funktionaliteter kan kovalent fästas på kanalerna sammandragning sidan. Via laddnings repulsion av den kovalent bundna aktivator (MTSET) kanalen triggas att öppna, vilket skapar en nano-ventil. Små molekyler som joner, vatten, små proteiner, men även små fluoroforer kan tränga igenom kanalen. Här, är det protein som används som modell för att visa förmågan hos systemet att detektera protein-förmedlad translokation.
Protocol
Representative Results
Discussion
Tekniken presenteras här medger en i hög grad parallell analys av membranproteintransport. Rekonstituerade membranproteinsystem kan direkt appliceras på biochip, vilket gör anpassningen av teoretiskt varje membran transportör eller kanal möjlig. Trafikanalys begränsas endast genom inrättandet av ett fluorescerande avläsningssystemet, antingen genom direkt fluorescensförändring (translokation av fluoroforer eller fluorescerande substrat) eller indirekt fluorescens förändring (pH-känsliga färgämnen, sekund…
Disclosures
The authors have nothing to disclose.
Acknowledgements
We thank Barbara Windschiegl for her help in establishing SOPs; Dennis Remme for his work on the NanoCalcFX software and Alina Kollmannsperger, Markus Braner and Milan Gerovac for helpful suggestions on the manuscript. The German-Israeli Project Cooperation (DIP) provided by the DFG and the Federal Ministry of Education and Research to R.T., as well as the Federal Ministry of Economics and Technology (ZIM R&D Project) to R.T. and Nanospot GmbH supported this work.
Materials
| Reagent | |||
| [2-(Trimethylammonium)ethyl] methanethiosulfonate |
Toronto Research Chemicals Inc. | T792900 | MTSET; hydrolized by water. Keep as dry pouder aliquot at -80 °C. Use immediately (30 minutes) after solubilization in buffer. |
| 1 ml gas-tight syringe | Hamilton | #1001 | |
| 10 ml round flask | Schott Duran | ||
| 2.7 mm glas beads | Roth | N032.1 | |
| 2-Propanole | Roth | 9866.5 | |
| 30 cm Luer-Lock Extension Tube | Sarstedt | 744304 | |
| Acetone | Roth | 5025.5 | |
| Bio-Beads SM-2 Adsorbent | Bio-Rad | 152-3920 | need to be activated before first use |
| CaCl2 Dihydrat | Roth | HN04.3 | |
| Calcein | Sigma | C0875 | store dark at -20 °C |
| Chloroform reagent grade | VWR Chemicals | 22711324 | |
| DOPEATTO390 | ATTO-TEC | AD 390-165 | store dark at -20 °C |
| Ethanol absolute | Sigma-Aldrich | 32205 | |
| Injekt Single-use syringe | Braun | 460 60 51V | |
| Injekt-F single-use syringe | Braun | 91 66 017V | |
| Keck clips | Schott | KC29 | |
| L-α-Phosphatidylcholine, 20% (Soy) | Avanti Polar Lipids | 5416016 | store under inert gas at -20 °C |
| NaCl 99.5% p.a. | Roth | 3957.2 | |
| Nanopore E100 wafer/chips | Micromotive (Mainz/Germany) | available on request | |
| Nucleopore Track-Etch Membrane 0.4 µm | Whatman | 800282 | |
| Oregon Green Dextran 488 (70 kDa) | life Technologies | D-7173 | store dark at -20 °C |
| Oy647 | Luminartis (Münster/Germany) | OY-647-T-1mg | store dark at -20 °C |
| Rotilabo-syringe filtration, unsterile, pore-size 0.22 µm | Roth | P 818.1 | |
| Sephadex G-50 | Sigma-Aldrich | G5080 | column material for size exclusion chromatography |
| Silastic MDX4-4210 | Dow Corning | curing agent for chip fixation onto cover glass support | |
| sticky-Slide 8-well | ibidi | 80828 | multi-well chamber for the mounting onto glass slides (chip holder) |
| Three-way stopcock blue | Sarstedt | 744410001 | |
| Tris Pufferan 99.9% Ultra Quality | Roth | 5429.2 | |
| Triton-X 100 | Roth | 6683.1 | |
| Whatman 0.2 µm cellulose nitrate membrane filter | Roth | NH69.1 | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Büchi 461 water bath | Büchi | ||
| Büchi Rotavapor RE 111 | Büchi | ||
| Cary Eclipse Fluorescence Spectrophtometer | Varian | ||
| LiposoFast Mini Extruder | Avestin | ||
| Membrane pump | Vaccubrand | 15430 | |
| Nanosight Nanoparticle Tracking Microscope | Malvern / Nanosight | LM 14C | |
| NyONE microscope | Synentec | available on request | |
| Pump control | Vaccubrand | CVC 2II | |
| Sonicator bath Sonorex RK100H | Brandelin electronic | 31200001107477 | |
| Vaccum pump RC5 | Vaccubrand | 1805400204 | |
| Water bath W13 | Haake | 002-9910 | |
| Plasma Cleaner PDC-37G | Harrick Plasma | PDC-37G | |
| Name | Company | Catalog Number | Comments |
| Software | |||
| ImageJ | Open Source | http://imagej.nih.gov/ij/ | scientific image processing software |
| NanoCalcFX | Freeware | http://sourceforge.net/projects/nanocalc/ | data analysis/evaluation software for massive transport kinetic datasets |
| NTA 2.3 Analytical Software | Nanosight | data acquisition and analysis software for nanoparticle tracking microscope | |
| NTA 2.3 Temperature Comms | Nanosight | temperature controle software for nanoparticle tracking microscope |
References
- Yildirim, M. A., Goh, K. I., Cusick, M. E., Barabasi, A. L., Vidal, M. Drug-target network. Nat Biotechnol. 25, 1119 (2007).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflugers Arch. 391, 85-100 (1981).
- Osaki, T., Suzuki, H., Le Pioufle, B., Takeuchi, S. Multichannel simultaneous measurements of single-molecule translocation in α-hemolysin nanopore array. Anal. Chem. 81, 9866-9870 (2009).
- Carrillo, L., et al. High-resolution membrane capacitance measurements for studying endocytosis and exocytosis in yeast. Traffic. , (2015).
- Giacomini, K. M., et al. Membrane transporters in drug development. Nat. Rev. Drug Discov. 9, 215-236 (2010).
- Castell, O. K., Berridge, J., Wallace, M. I. Quantification of membrane protein inhibition by optical ion flux in a droplet interface bilayer array. Angew. Chem. Int. Ed. 51, 3134-3138 (2012).
- Zollmann, T., et al. Single liposome analysis of peptide translocation by the ABC transporter TAPL. Proc. Natl. Acad. Sci. U.S.A. 112, 2046-2051 (2015).
- Tamm, L. K., McConnell, H. M. Supported phospholipid bilayers. Biophys. J. 47, 105-113 (1985).
- Sackmann, E. Supported membranes: scientific and practical applications. Science. 271, 43-48 (1996).
- Castellana, E. T., Cremer, P. S. Solid supported lipid bilayers: From biophysical studies to sensor design. Surf. Sci. Rep. 61, 429-444 (2006).
- Wagner, M. L., Tamm, L. K. Tethered polymer-supported planar lipid bilayers for reconstitution of integral membrane proteins: silane-polyethyleneglycol-lipid as a cushion and covalent linker. Biophys. J. 79, 1400-1414 (2000).
- Naumann, C. A., et al. The polymer-supported phospholipid bilayer: tethering as a new approach to substrate-membrane stabilization. Biomacromolecules. 3, 27-35 (2002).
- Weiskopf, D., Schmitt, E. K., Klühr, M. H., Dertinger, S. K., Steinem, C. Micro-BLMs on highly ordered porous silicon substrates: Rupture process and lateral mobility. Langmuir. 23, 9134-9139 (2007).
- Watanabe, R., et al. Arrayed lipid bilayer chambers allow single-molecule analysis of membrane transporter activity. Nat. Commun. 5, (2014).
- Stamou, D., Duschl, C., Delamarche, E., Vogel, H. Self-Assembled Microarrays of Attoliter Molecular Vessels. Angew. Chem. Int. Ed. 115, 5738-5741 (2003).
- Lohr, C., et al. Single Liposomes Used to Study the Activity of Individual Transporters. Biophysical Journal. 106, 229a (2014).
- Dunlop, J., Bowlby, M., Peri, R., Vasilyev, D., Arias, R. High-throughput electrophysiology: an emerging paradigm for ion-channel screening and physiology. Nat. Rev. Drug Discov. 7, 358-368 (2008).
- Milligan, C. J., et al. Robotic multiwell planar patch-clamp for native and primary mammalian cells. Nat. Protoc. 4, 244-255 (2009).
- Soga, N., Watanabe, R., Noji, H. Attolitre-sized lipid bilayer chamber array for rapid detection of single transporters. Sci. Rep. 5, (2015).
- Kleefen, A., et al. Multiplexed parallel single transport recordings on nanopore arrays. Nano Lett. 10, 5080-5087 (2010).
- Wei, R., Gatterdam, V., Wieneke, R., Tampé, R., Rant, U. Stochastic sensing of proteins with receptor-modified solid-state nanopores. Nat. Nanotechnol. 7, 257-263 (2012).
- Urban, M., et al. Highly parallel transport recordings on a membrane-on-nanopore chip at single molecule resolution. Nano Lett. 14, 1674-1680 (2014).
- Kusters, I., Van Oijen, A. M., Driessen, A. J. Membrane-on-a-Chip: Microstructured Silicon/Silicon-Dioxide Chips for High-Throughput Screening of Membrane Transport and Viral Membrane Fusion. ACS Nano. 8, 3380-3392 (2014).
- Hansen, J. S., Thompson, J. R., Hélix-Nielsen, C., Malmstadt, N. Lipid directed intrinsic membrane protein segregation. J. Am. Chem. Soc. 135, 17294-17297 (2013).
- Heinemann, F., Schwille, P. Preparation of Micrometer-Sized Free-Standing Membranes. ChemPhysChem. 12, 2568-2571 (2011).
- Lazzara, T. D., Carnarius, C., Kocun, M., Janshoff, A., Steinem, C. Separating attoliter-sized compartments using fluid pore-spanning lipid bilayers. ACS nano. 5, 6935-6944 (2011).
- Winterhalter, M. Black lipid membranes. Curr. Opin. Colloid Interface Sci. 5, 250-255 (2000).
- Koçer, A., Walko, M., Feringa, B. L. Synthesis and utilization of reversible and irreversible light-activated nanovalves derived from the channel protein MscL. Nat. Protoc. 2, 1426-1437 (2007).

