생성 CRISPR은 / Cas9 중재 Monoallelic 삭제할 경우는 마우스 배아 줄기 세포의 증강 기능을 연구하는
Summary
Experimental validation of enhancer activity is best approached by loss-of-function analysis. Presented here is an efficient protocol that uses CRISPR/Cas9 mediated deletion to study allele-specific regulation of gene transcription in F1 ES cells which contain a hybrid genome (Mus musculus129 x Mus castaneus).
Abstract
Enhancers control cell identity by regulating tissue-specific gene expression in a position and orientation independent manner. These enhancers are often located distally from the regulated gene in intergenic regions or even within the body of another gene. The position independent nature of enhancer activity makes it difficult to match enhancers with the genes they regulate. Deletion of an enhancer region provides direct evidence for enhancer activity and is the gold standard to reveal an enhancer’s role in endogenous gene transcription. Conventional homologous recombination based deletion methods have been surpassed by recent advances in genome editing technology which enable rapid and precisely located changes to the genomes of numerous model organisms. CRISPR/Cas9 mediated genome editing can be used to manipulate the genome in many cell types and organisms rapidly and cost effectively, due to the ease with which Cas9 can be targeted to the genome by a guide RNA from a bespoke expression plasmid. Homozygous deletion of essential gene regulatory elements might lead to lethality or alter cellular phenotype whereas monoallelic deletion of transcriptional enhancers allows for the study of cis-regulation of gene expression without this confounding issue. Presented here is a protocol for CRISPR/Cas9 mediated deletion in F1 mouse embryonic stem (ES) cells (Mus musculus129 x Mus castaneus). Monoallelic deletion, screening and expression analysis is facilitated by single nucleotide polymorphisms (SNP) between the two alleles which occur on average every 125 bp in these cells.
Introduction
전사 조절 요소에 의한 비정상적인 유전자 발현이 질병을 초래할 수있다 이러한 요소 개발 1 변형시 유전자 발현 시공간 미세 조정이 중요하다. 게놈 넓은 협회 연구에 의해 확인 된 많은 질병 관련 지역 비 코딩 지역에 있고 전사 증강 3-4의 기능을 가지고 있습니다. 강화제를 파악하고 그들이 자주 몇 킬로베이스 거리가 조절하는 유전자의 위치와 조직 – 특이 적 방식으로 5-6으로 활성화 될 수 있으므로 복잡 조절하는 유전자로 일치. 증강 예측은 일반적으로 히스톤 수정 마크, 중재자-cohesin 단지를 기반으로 세포 유형 특정 전사의 결합은 7-10 요인 있습니다. 예측 증강의 유효성 검사는 가장 자주 인핸서는 리포터 유전자 11 ~ 12의 발현을 활성화하는 벡터 기반의 분석을 통해 이루어집니다. 이러한 데이터는 V를 제공추정 인핸서 서열의 규제 가능성에 대한 aluable 정보는하지만 자신의 내생 게놈 맥락에서 그 기능을 공개하거나 조절하는 유전자를 식별하지 않습니다. 게놈 편집 기능 상실 분석에 의해 자신의 내생 적 맥락에서 전사 조절 인자의 기능을 연구하는 강력한 도구 역할을한다.
게놈 편집, 즉 CRISPR / Cas9 게놈 편집 시스템의 최근의 진보는, 게놈 기능의 조사를 용이하게한다. CRISPR / Cas9 시스템은 많은 생물학적 시스템에 사용하기 쉽고 적용 할 수 있습니다. Cas9 단백질 가이드 RNA (gRNA) (13)에 의해 게놈의 특정 사이트를 대상으로합니다. SpCas9 / gRNA 단지는 protospacer 인접 모티브 (PAM) 시퀀스, NGG 14 ~ 15에 '5이어야 목표 게놈 시퀀스의 게놈을 스캔합니다. 목표에 gRNA의 gRNA에 상보적인 20 뉴클레오티드 (NT) 시퀀스의 염기쌍는 doubl 결과 SpCas9 클레아 활동을 활성화전자 가닥 브레이크 (DSB)가 PAM 시퀀스의 상류 3 염기쌍. 특이도가 gRNA 종자 지역의 전체 염기 쌍을 통해 달성되면, 6-12은 PAM에 인접한 NT; 반대로, 종자의 보통 16-17을 허용하는 '5 불일치. 가입 비 동종 말 (NHEJ)의 DNA 수리 또는 상동 감독 수리 (HDR) mechanisms.NHEJ의 DNA 수리가 종종 방해 할 수있는 대상 사이트에서 몇 bp의 삽입 / 삭제 (삽입과 삭제)을 작성 중 하나를 소개 DSB는 복구 할 수 있습니다 유전자의 오픈 리딩 프레임 (ORF). 관심 영역의 측면 게놈 두 gRNAs에서 큰 결실을 생성하기 위해, 18 ~ 19을 사용할 수있다. 이 접근법은 궤적 제어 영역 또는 종래 증진제 9,18,20-22보다 큰 수퍼 증강제로 클러스터 전사 인핸서의 연구에 유용하다.
Monoallelic 삭제는 전사의 시스 -regulation 연구를위한 귀중한 모델입니다. 관찰 장증강의 monoallelic 삭제 후 성적 수준에서 전자는 두 대립 유전자의 전사가 세포 적합성에 영향을 미치는 잠재적 영향을 때 발생할 수있는 혼란 효과없이 유전자 조절에서 해당 증강의 역할에 상관 관계. 감소 된 발현을 평가하기 그러나, 야생형 대립 유전자에서 삭제를 구별하는 능력없이 어렵다. 또한, 두 개의 대립 유전자를 구별하는 능력없이 각 대립 유전자의 결실을 유전형 특히이 PCR에 의해 전체 야생형 영역을 증폭하기 어렵다되는 1 메가 23> 10킬로바이트 큰 결실에 대한 도전이다. 뮤스 castaneus으로 건너 뮤스의 musculus (129)에 의해 생성 된 F1 ES 세포의 사용은 두 가지 대립 유전자가 대립 유전자 특이 PCR 18,24에 의해 구별 할 수 있습니다. 이러한 세포의 하이브리드 유전자는 대립 유전자 특정 삭제 검사 및 발현 분석을 용이하게한다. 평균적으로이 두 게놈 사이의 모든 125 BP는 SNP에게있다, 표현과 유전자형에 대한 프라이머 설계 유연성을 제공하는 분석한다. 하나의 SNP의 존재는 프라이머 융해 온도 (Tm)에 영향을 미치는 두 대립 (25)의 식별을 허용 실시간 정량 PCR (qPCR에) 증폭 특이성을 타겟팅 할 수있다. 또한, 프라이머의 3 '말단 내의 불일치 크게 원하지 대립 타겟 (26)의 증폭을 방지 프라이머로부터 연장하는 DNA 폴리머 라 아제의 능력에 영향을 미친다. CRISPR / Cas9 게놈 편집 시스템 (도 1)를 사용하여보다 큰 1킬로바이트의 특정 대립 유전자 인핸서 삭제 이후 발현 분석 F1 ES 세포의 사용은 다음의 프로토콜에 설명한다.
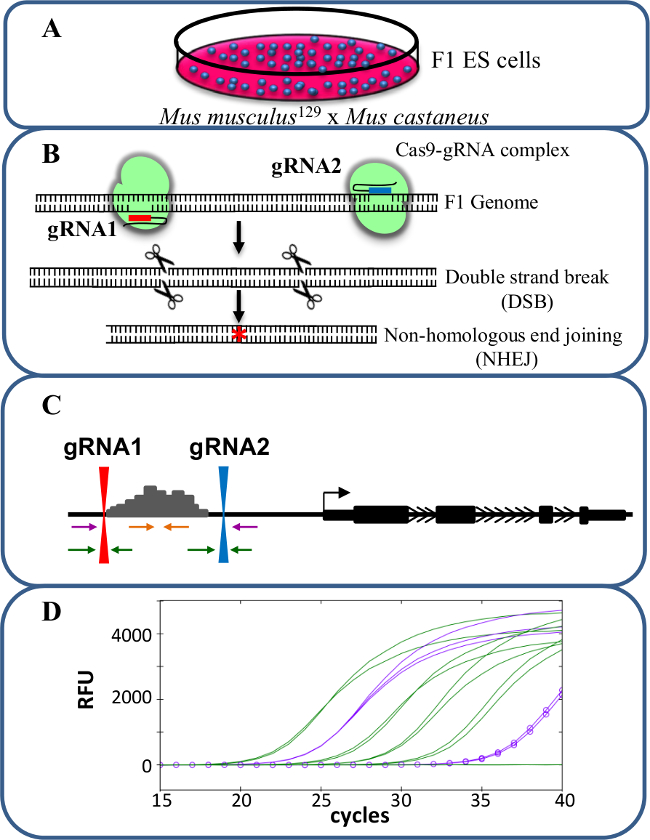
시스 -reg을 연구하는 CRISPR / Cas9를 사용하여 그림 1. 증강 삭제유전자 발현의 위험률. 뮤스의 musculus 129 뮤스 castaneus 사이의 교차에 의해 생성 (A) F1 ES 세포는 대립 유전자 특정 삭제를 허용하는 데 사용됩니다. (B)는 두 개의 RNA를 가이드 (gRNA)는 인핸서 영역의 큰 Cas9 매개 결실을 유도하기 위해 사용된다. (C) 프라이머 세트가 많은 모노 – 및 이중 대립 유전자 결실을 식별하는 데 사용된다. 오렌지 프라이머 내부 프라이머이며, 보라색 프라이머는 외부 프라이머 및 녹색 프라이머는 gRNA 측면 프라이머되어 있습니다. 유전자 발현의 (D)의 변화는 대립 유전자 특정 qPCR에를 사용하여 모니터링됩니다. RFU 상대 형광 단위를 의미한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Protocol
Representative Results
Discussion
CRISPR / Cas9 매개 게놈 편집 기술은 게놈 수정에 대한 간단 빠르고 저렴한 방법을 제공한다. 기능 증강 특성에 대한 monoallelic 증강 삭제를 생성하고 분석하기 위해 여기에 설명 된 방법은 F1 마우스 세포에서 SNP를 활용합니다. 이러한 유형의 접근법의 이점은 : 1) monoallelic 인핸서 삭제가 중요한 증강제, 즉 두 대립 유전자에서 치사 셀에 이르는 조절 유전자의 단백질 수준에서 큰 감소를 삭제하…
Disclosures
The authors have nothing to disclose.
Acknowledgements
We would like to thank all the members of the Mitchell lab for helpful discussions. This work was supported by the Canadian Institutes of Health Research, the Canada Foundation for Innovation and the Ontario Ministry of Research and Innovation (operating and infrastructure grants held by JAM).
Materials
| Phusion High-Fidelity DNA Polymerase | NEB | M0530S | high fidelity DNA polymerase used in gRNA assembly |
| Gibson Assembly Master Mix | NEB | E2611L | |
| gRNA_Cloning Vector | Addgene | 41824 | A target sequence is cloned into this vector to create the gRNA plasmid |
| pCas9_GFP | Addgene | 44719 | Codon-optimized SpCas9 and EGFP co-expression plasmid |
| AflII | NEB | R0520S | |
| EcoRI | NEB | R3101S | |
| Neon Transfection System 100 µL Kit | Life Technologies | MPK10096 | Microporator transfection technology |
| prepGEM | ZyGEM | PT10500 | genomic DNA extraction reagent |
| Nucleo Spin Gel & PCR Clean-up | Macherey-Nagel | 740609.5 | |
| High-Speed Plasmid Mini Kit | Geneaid | PD300 | |
| Maxi Plasmid Kit Endotoxin Free | Geneaid | PME25 | |
| SYBR select mix for CFX | Life Technologies | 4472942 | qPCR reagent |
| iScript cDNA synthesis kit | Bio-rad | 170-8891 | Reverse transcription reagent |
| 0.25% Trypsin with EDTA | Life Technologies | 25200072 | |
| PBS without Ca/Mg2+ | Sigma | D8537 | |
| 0.5M EDTA | Bioshop | EDT111.500 | |
| HBSS | Life Technologies | 14175095 | |
| 1M HEPES | Life Technologies | 13630080 | |
| BSA fraction V (7.5%) | Life Technologies | 15260037 | |
| Max Efficiency DH5α competent cells | Invitrogen | 18258012 | |
| FBS | ES cell qualified | FBS is subjected to a prior testing in mouse ES cells for pluripotency | |
| DMSO | Sigma | D2650 | |
| Glutamax | Invitrogen | 35050 | |
| DMEM | Life Technologies | 11960069 | |
| Pencillin/Streptomycin | Invitrogen | 15140 | |
| Sodium pyruvate | Invitrogen | 11360 | |
| Non-essential aminoacid | Invitrogen | 11140 | |
| β-mercaptoethanol | Sigma | M7522 | |
| 96-well plate | Sarstedt | 83.3924 | |
| Sealing tape | Sarstedt | 95.1994 | |
| CoolCell LX | Biocision | BCS-405 | alcohol-free cell freezing container |
| CHIR99021 | Biovision | 1748-5 | Inhibitor for F1 ES cell culture |
| PD0325901 | Invivogen | inh-pd32 | Inhibitor for F1 ES cell culture |
| LIF | Chemicon | ESG1107 | Inhibitor for F1 ES cell culture |
References
- Sagai, T., Hosoya, M., Mizushina, Y., Tamura, M., Shiroishi, T. Elimination of a long-range cis-regulatory module causes complete loss of limb-specific Shh expression and truncation of the mouse limb. Development. 132 (4), 797-803 (2005).
- Kleinjan, D. A., Lettice, L. A. Long-range gene control and genetic disease. Adv Genet. 61, 339-388 (2008).
- Visel, A., Rubin, E. M., Pennacchio, L. A. Genomic views of distant-acting enhancers. Nature. 461 (7261), 199-205 (2009).
- Maurano, M. T., et al. Systematic localization of common disease-associated variation in regulatory DNA. Science. 337 (6099), 1190-1195 (2012).
- Heintzman, N. D., et al. Histone modifications at human enhancers reflect global cell-type-specific gene expression. Nature. 459 (7243), 108-112 (2009).
- Shen, Y., et al. A map of the cis-regulatory sequences in the mouse genome. Nature. 488 (7409), 116-120 (2012).
- Johnson, D. S., Mortazavi, A., Myers, R. M., Wold, B. Genome-wide mapping of in vivo protein-DNA interactions. Science. 316 (5830), 1497-1502 (2007).
- Rhee, H. S., Pugh, B. F. Comprehensive genome-wide protein-DNA interactions detected at single-nucleotide resolution. Cell. 147 (6), 1408-1419 (2011).
- Whyte, W. A., et al. Master transcription factors and mediator establish super-enhancers at key cell identity genes. Cell. 153 (2), 307-319 (2013).
- Chen, C. Y., Morris, Q., Mitchell, J. A. Enhancer identification in mouse embryonic stem cells using integrative modeling of chromatin and genomic features. BMC Genomics. 13 (1), 152 (2012).
- Patwardhan, R. P., et al. Massively parallel functional dissection of mammalian enhancers in vivo. Nat Biotechnol. 30 (3), 265-270 (2012).
- Melnikov, A., et al. Systematic dissection and optimization of inducible enhancers in human cells using a massively parallel reporter assay. Nat Biotechnol. 30 (3), 271-277 (2012).
- Jinek, M., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Cong, L., et al. Multiplex genome engineering using CRISPR/Cas systems. Science. 339 (6121), 819-823 (2013).
- Mali, P., et al. RNA-guided human genome engineering via Cas9. Science. 339 (6121), 823-826 (2013).
- Hsu, P. D., et al. DNA targeting specificity of RNA-guided Cas9 nucleases. Nat Biotechnol. 31 (9), 827-832 (2013).
- Cho, S. W., et al. Analysis of off-target effects of CRISPR/Cas-derived RNA-guided endonucleases and nickases. Genome Res. 24 (1), 132-141 (2014).
- Zhou, H. Y., et al. A Sox2 distal enhancer cluster regulates embryonic stem cell differentiation potential. Genes Dev. 28 (24), 2699-2711 (2014).
- Fujii, W., Kawasaki, K., Sugiura, K., Naito, K. Efficient generation of large-scale genome-modified mice using gRNA and CAS9 endonuclease. Nucleic Acids Res. 41 (20), e187 (2013).
- Tuan, D. Y., Solomon, W. B., London, I. M., Lee, D. P. An erythroid-specific, developmental-stage-independent enhancer far upstream of the human ‘beta-like globin’ genes. Proc Natl Acad Sci U S A. 86 (8), 2554-2558 (1989).
- Amano, T., et al. Chromosomal dynamics at the Shh locus: limb bud-specific differential regulation of competence and active transcription. Dev Cell. 16 (1), 47-57 (2009).
- Li, Y., et al. CRISPR reveals a distal super-enhancer required for Sox2 expression in mouse embryonic stem cells. PLoS One. 9 (12), e114485 (2014).
- Canver, M. C., et al. Characterization of genomic deletion efficiency mediated by clustered regularly interspaced palindromic repeats (CRISPR)/Cas9 nuclease system in mammalian cells. J Biol Chem. 289 (31), 21312-21324 (2014).
- Mlynarczyk-Evans, S., et al. X chromosomes alternate between two states prior to random X-inactivation. PLoS Biol. 4 (6), e159 (2006).
- Lefever, S., Pattyn, F., Hellemans, J., Vandesompele, J. Single-nucleotide polymorphisms and other mismatches reduce performance of quantitative PCR assays. Clin Chem. 59 (10), 1470-1480 (2013).
- Huang, M. M., Arnheim, N., Goodman, M. F. Extension of base mispairs by Taq DNA polymerase: implications for single nucleotide discrimination in PCR. Nucleic Acids Res. 20 (17), 4567-4573 (1992).
- Keane, T. M., et al. Mouse genomic variation and its effect on phenotypes and gene regulation. Nature. 477 (7364), 289-294 (2011).
- Yalcin, B., et al. Sequence-based characterization of structural variation in the mouse genome. Nature. 477 (7364), 326-329 (2011).
- Gibson, D. G., et al. Enzymatic assembly of DNA molecules up to several hundred kilobases. Nat Methods. 6 (5), 343-345 (2009).
- Gibson, D. G., Smith, H. O., Hutchison, C. A., Venter, J. C., Merryman, C. Chemical synthesis of the mouse mitochondrial genome. Nat Methods. 7 (11), 901-903 (2010).
- Ding, Q., et al. Enhanced efficiency of human pluripotent stem cell genome editing through replacing TALENs with CRISPRs. Cell Stem Cell. 12 (4), 393-394 (2013).
- Basu, S., Campbell, H. M., Dittel, B. N., Ray, A. Purification of specific cell population by fluorescence activated cell sorting (FACS). J Vis Exp. (41), (2010).
- Forlenza, M., Kaiser, T., Savelkoul, H. F., Wiegertjes, G. F. The use of real-time quantitative PCR for the analysis of cytokine mRNA levels. Methods Mol Biol. 820, 7-23 (2012).
- Wu, J. H., Hong, P. Y., Liu, W. T. Quantitative effects of position and type of single mismatch on single base primer extension. J Microbiol Methods. 77 (3), 267-275 (2009).
- Sanyal, A., Lajoie, B. R., Jain, G., Dekker, J. The long-range interaction landscape of gene promoters. Nature. 489 (7414), 109-113 (2012).

