본래 식물을 표백제로 또는 추출물의 열처리에 의한 담배 숙주 세포 단백질 제거 방법의 비교
Summary
효과적으로 담배에서 숙주 세포 단백질 (HCP가)의 90 % 이상을 제거 침전 방법 나타난 세 개의 열은 다른 정제 단계 이전에 추출한다. 공장 HCP가이 비가 역적으로 60 ° C 이상의 온도에서 집계.
Abstract
식물은 인간 식품, 사료 원료를 제공 할뿐만 아니라, 항체, 백신 후보로서 바이오 효소 단백질에 대한 경제적 인 생산 시스템으로 개발되었다 아닙니다. 이들은 식물 바이오 매스로부터 정제해야하지만, 크로마토 그래피 단계는 식물 추출물의 숙주 세포 단백질 (HCP가)의 높은 농도에 의해 방해된다. 그러나, 대부분의 HCP가 비가 역적 목적 단백질의 정제를 용이 이후 60 ° C 이상의 온도에서 응집. 여기에, 세 가지 방법은 그대로 잎 또는 추출물 중 하나에서 담배 HCP가의 열 침전을 달성하기 위해 제공됩니다. 그대로 잎의 창백 쉽게 기존 프로세스에 통합 될 수 있지만, 이후 여과 단계에 부정적인 영향을 미칠 수있다. 반대의 경우와 같은 처리 장치의 설계에 큰 변화 불구 하류 작업의 성능을 향상시킬 수있는 교반 용기 잎 추출물의 열 침전 사실이다균질 형상. 마지막으로, 열교환 기 설치 잘 열전달 조건의 관점에서 특성화 스케일 쉽지만 세정 어려울 수 있고, 필터의 용량에 부정적인 영향이있을 수있다. 디자인 수준의 실험 방법을 HCP 제거 및 생성물 회수에 영향을 미치는 가장 중요한 공정 매개 변수를 식별하는데 사용될 수있다. 이것은 다른 식 플랫폼의 각 방법 및 주어진 정제 전략을위한 최적의 방법의 식별의 적용을 용이하게한다.
Introduction
현대 의료 시스템은 점점 바이오 단백질 (1)에 따라 달라집니다. 식물에서 이들 단백질을 생산하는 통상의 발현 시스템 2-4에 비해 낮기 때문에 병원체 부담 더 확장하는 것이 유리하다. 파괴적 추출 절차 탁도 5,000 혼탁 탁도 유닛 (NTUs)를 초과하고, 숙주 세포 단백질 (HCP)의 농도는 종종 95을 초과하는, 높은 입자 부담을 초래하기 때문에, 식물 유래 의약품의 하류 처리 (DSP)가 어려울 수 %의 [m / m] 5,6.
정교한 정화 절차 분산 입자 7-9를 제거하기 위해 필요하지만 크로마토 그래피 장비 HCP에 10,11의 효율적인 제거에 대한 이전 단계가있는 경우 초기 생성물 회수 중에 바인드 – 및 – 용출 모드로 동작하도록 저렴된다. 이것은 floccul를 이용하여 표적 단백질을 침전에 의해 하나를 달성 할 수있다개미 12 낮은 pH 13, 14,뿐만 아니라 HCP가 집계하도록하여. 불로 오스 -1,5- 비스 포스페이트 카르 복실 / 시게나 (RUBISCO), 담배 (된 담배)으로 녹색 식물에서 가장 풍부한 HCP의 선택적 응집은 폴리에틸렌 글리콜 (15)을 첨가하여 촉진하지만, 이것은 고가이고 대형과 양립 할 수있다 -scale 제조. 열처리는 예컨대 Vax8 같은 단백질 말라리아 백신 후보 솔루션 16-18에서 안정적으로 유지하면서, 변성 및 담배 HCP가 95 % 이상을 침전하는 것으로 나타났다.
온도 조절은 혈관을 교반 (II) (I) 희게, 즉 고온의 액체는 그대로 잎의 침지, 및 (iii) 열교환 기 (세 가지 접근법은 담배 HCP에의 열 유도 된 침전을 달성하기 위해 사용 된 그림 1) 16. 그대로 잎의 경우, HCP가의 신속하고 효율적인 침전을 달성하고도 쉬웠다 희게확장 및 식물 바이오 매스 (19)를 세척하는 초기 단계를 포함 기존의 대규모 제조 공정과 호환합니다. 대조적으로, 온도 조절 용기 이미 일부 공정에 사용할 수 있으며 탱크의 표면 대 부피 비율이 점차 감소되기 때문에 식물의 열처리 (20)를 추출하지만, 그 확장 성 및 에너지 전송 속도가 제한되어 사용될 수 있으며 프로세스 규모에 적합하게된다. 열교환 교반 용기를 가열 할 수있는 기술적으로 잘 정의 된 대안이지만 가열 및 냉각 매체, 예를 들면 증기와 냉수의 풍부한 공급뿐만 아니라, 열 교환기 형상에 적응되는 엄격하게 제어 체적 유량을 필요 매체 특성, 예를 들면., 비열. 이 문서는 세 가지 방법이 일반적으로 담배 HCP가, 식물 HCP가의 가열에 의한 침전에 사용할 수있는 방법을 보여줍니다. 설립 및 EAC의 동작실험실 환경에서 H 방식은 대규모 프로세스의 적합성을 평가하기 위해 사용될 수있다. 주요 과제는 공정 규모의 제조시 사용되는 장치 및 조건을 닮은 각 작업에 대한 적절한 스케일 다운 모델과 실행 조건을 확인하는 것입니다. 여기에 제시된 데이터는 DsRed 16 말라리아 백신 후보 Vax8 형광 단백질을 발현하는 형질 전환 담배 식물 실시한 실험을 참조하지만,이 방법은 성공적 N.에 적용된 benthamiana 식물 일시적 다른 바이오 21 단백질 발현.
디자인의-실험 (DOE는) 공정 개발을 용이하게 할 수있다 (22)에 접근, 이전 8 설명한 바와 같이 (23)는이 상황에서 도움이 될 수 있습니다 응집제. 창백 가열 용기 및 열교환 기의 주요 차이점은 창백 구약 반면 프로세스 초기에 그대로 잎에 적용된다그녀는 식물 추출물 (그림 1)에 적용됩니다.
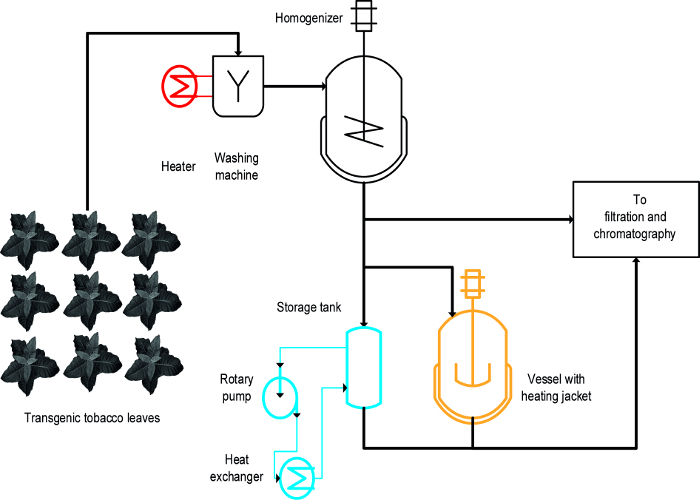
그림 1 :. 담배 HCP 열 강수량에 대한 세 가지 다른 방법의 구현을 설명 프로세스 흐름 방식은 식물 재료 세척 및 정화 및 정화 전에 균질화한다. 희게 단계 (적색) 용 장비를 쉽게 기존의 장치에 추가 될 수있다. 대조적으로, 교반 용기 (오렌지) 특히 열교환 기 (파란색)를 사용하여 하나 또는 여러 개의 추가 장치 및 배관을 필요로한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Protocol
Representative Results
Discussion
상기 열 강수량의 세 가지 방법을 효과적으로 모든 크로마토 그래피 정제 단계 (16, 17) 이전에 담배 HCP가 제거 할 수 있습니다. 그들은 예를 들어, 초기 제품 순도, guttation (29), 분비 단백질로 제한됩니다 모두 rhizosecretion 30 원심 추출 (31, 32)을, 증가하는 것을 목표로 다른 전략을 보완합니다. 표적 단백질은 1 개 이상의 분 ~ 60 ° C의 최소의 석출 온도를 ?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
We would like to acknowledge Dr. Thomas Rademacher, Alexander Boes and Veronique Beiß for providing the transgenic tobacco seeds, and Ibrahim Al Amedi for cultivating the tobacco plants. The authors wish to thank Dr. Richard M. Twyman for editorial assistance as well as Güven Edgü for providing the MSP1-19 reference. This work was funded in part by the European Research Council Advanced Grant ”Future-Pharma”, proposal number 269110, the Fraunhofer-Zukunftsstiftung (Fraunhofer Future Foundation) and Fraunhofer-Gesellschaft Internal Programs under Grant No. Attract 125-600164.
Materials
| 2100P Portable Turbidimeter | Hach | 4650000 | Turbidimeter |
| Amine Coupling Kit | GE Healthcare | BR100050 | SPR chip coupling kit |
| Autoclaving basket | Nalgene | 6917-0230 | Basket for leaf blanching |
| Biacore T200 | GE Healthcare | 28-9750-01 | SPR device |
| Bio Cell Analyser BCA 003 R&D with 3D ORM | Sequip | n.a. | Particle size analyzer |
| Blender | Waring | 800EG | Blender |
| BP-410 | Furh | 2632410001 | Bag filter |
| Centrifuge 5415D | Eppendorf | 5424 000.410 | Centrifuge |
| Centrifuge tube 15 mL | Labomedic | 2017106 | Reaction tube |
| Centrifuge tube 50 mL self-standing | Labomedic | 1110504 | Reaction tube |
| CM5 chip | GE Healthcare | BR100012 | Chip for SPR measurements |
| Cuvette 10x10x45 | Sarsted | 67.754 | Cuvette for Zetasizer Nano ZS |
| Design-Expert(R) 8 | Stat-Ease, Inc. | n.a. | DoE software |
| Disodium phosphate | Carl Roth GmbH | 4984.3 | Media component |
| Ferty 2 Mega | Kammlott | 5.220072 | Fertilizer |
| Forma -86C ULT freezer | ThermoFisher | 88400 | Freezer |
| Greenhouse | n.a. | n.a. | For plant cultivation |
| Grodan Rockwool Cubes 10x10cm | Grodan | 102446 | Rockwool block |
| Twentey-loop heat exchanger (4.8 m length) | n.a. (custom design) | n.a. | Heat exchanger |
| HEPES | Carl Roth GmbH | 9105.3 | Media component |
| K200P 60D | Pall | 5302303 | Depth filter layer |
| KS50P 60D | Pall | B12486 | Depth filter layer |
| Lauda E300 | Lauda Dr Wobser GmbH | Z90010 | Water bath thermostat |
| L/S 24 | Masterflex | SN-06508-24 | Tubing |
| mAb 5.2 | American Type Culture Collection | HB-9148 | Vax8 specific antibody |
| Masterflex L/S | Masterflex | HV-77921-75 | Peristaltic pump |
| Miracloth | Labomedic | 475855-1R | Filter cloth |
| MultiLine Multi 3410 IDS | WTW | WTW_2020 | pH meter / conductivity meter |
| Osram cool white 36 W | Osram | 4930440 | Light source |
| Phytotron | Ilka Zell | n.a. | For plant cultivation |
| Sodium disulfit | Carl Roth GmbH | 8554.1 | Media component |
| Sodium chloride | Carl Roth GmbH | P029.2 | Media component |
| Stainless-steel vessel; 0.7-kg 2.0-L; height 180 mm; diameter 120 mm | n.a. (custom design) | n.a. | Container for heat precipitation |
| Synergy HT | BioTek | SIAFRT | Fluorescence and spectrometric plate reader |
| VelaPad 60 | Pall | VP60G03KNH4 | Filter housing |
| Zetasizer Nano ZS | Malvern | ZEN3600 | DLS particle size distribution measurement |
| Zetasizer Software v7.11 | Malvern | n.a. | Software to operate the Zetasizer Nano ZS device |
References
- PhRMA. . 2013 Report: Medicines in Development – Biologics. , (2013).
- Buyel, J. F. Process development strategies in plant molecular farming. Curr. Pharm. Biotechnol. 16, 966-982 (2015).
- Stoger, E., Fischer, R., Moloney, M., Ma, J. K. C. Plant molecular pharming for the treatment of chronic and infectious diseases. Annu. Rev. Plant Biol. 65, 743-768 (2014).
- Melnik, S., Stoger, E. Green factories for biopharmaceuticals. Curr. Med. Chem. 20, 1038-1046 (2013).
- Buyel, J. F., Twyman, R. M., Fischer, R. Extraction and downstream processing of plant-derived recombinant proteins. Biotechnol. Adv. 33, 902-913 (2015).
- Wilken, L. R., Nikolov, Z. L. Recovery and purification of plant-made recombinant proteins. Biotechnol. Adv. 30, 419-433 (2012).
- Buyel, J. F., Fischer, R. Scale-down models to optimize a filter train for the downstream purification of recombinant pharmaceutical proteins produced in tobacco leaves. Biotechnol. J. 9, 415-425 (2014).
- Buyel, J. F., Fischer, R. Flocculation increases the efficacy of depth filtration during the downstream processing of recombinant pharmaceutical proteins produced in tobacco. Plant Biotechnol. J. 12, 240-252 (2014).
- Buyel, J. F., Opdensteinen, P., Fischer, R. Cellulose-based filter aids increase the capacity of depth filters during the downstream processing of plant-derived biopharmaceutical proteins. Biotechnol. J. 10, 584-591 (2014).
- Buyel, J. F., Fischer, R. Generic chromatography-based purification strategies accelerate the development of downstream processes for biopharmaceutical proteins produced in plants. Biotechnol. J. 9, 566-577 (2014).
- Buyel, J. F., Woo, J. A., Cramer, S. M., Fischer, R. The use of quantitative structure-activity relationship models to develop optimized processes for the removal of tobacco host cell proteins during biopharmaceutical production. J. Chromatogr. A. 1322, 18-28 (2013).
- Holler, C., Vaughan, D., Zhang, C. M. Polyethyleneimine precipitation versus anion exchange chromatography in fractionating recombinant beta-glucuronidase from transgenic tobacco extract. J. Chromatogr. A. 1142, 98-105 (2007).
- Buyel, J. F., Fischer, R. Downstream processing of biopharmaceutical proteins produced in plants: the pros and cons of flocculants. Bioengineered. 5, 138-142 (2014).
- Hassan, S., van Dolleweerd, C. J., Ioakeimidis, F., Keshavarz-Moore, E., Ma, J. K. Considerations for extraction of monoclonal antibodies targeted to different subcellular compartments in transgenic tobacco plants. Plant Biotechnol. J. 6, 733-748 (2008).
- Arfi, Z. A., Drossard, J., Hellwig, S., Fischer, R., Buyel, J. F. Polyclonal antibodies can effectively detect tobacco host cell proteins after RuBisCO depletion and endotoxin removal. Biotechnol. J. , (2015).
- Buyel, J. F., Gruchow, H. M., Boes, A., Fischer, R. Rational design of a host cell protein heat precipitation step simplifies the subsequent purification of recombinant proteins from tobacco. Biochem. Eng. J. 88, 162-170 (2014).
- Buyel, J. F., Fischer, R. A juice extractor can simplify the downstream processing of plant-derived biopharmaceutical proteins compared to blade-based homogenizers. Process Biochem. 50, 859-866 (2014).
- Beiss, V., et al. Heat-precipitation allows the efficient purification of a functional plant-derived malaria transmission-blocking vaccine candidate fusion protein. Biotechnol. Bioeng. 112, 1297-1305 (2015).
- Ma, J. K., et al. Regulatory approval and a first-in-human phase I clinical trial of a monoclonal antibody produced in transgenic tobacco plants. Plant Biotechnol. J. 13, 1106-1120 (2015).
- Mahajan, P. V., Caleb, O. J., Singh, Z., Watkins, C. B., Geyer, M. Postharvest treatments of fresh produce. Philos T R Soc A. 372, (2014).
- Menzel, S., et al. Optimized blanching reduces the host cell protein content and substantially enhances the recovery and stability of two plant derived malaria vaccine candidates. Front. Plant Sci. , (2015).
- Buyel, J. F., Fischer, R. Characterization of complex systems using the design of experiments approach: transient protein expression in tobacco as a case study. J. Vis. Exp. , e51216 (2014).
- Buyel, J. F. Procedure to evaluate the efficiency of flocculants for the removal of dispersed particles from plant extracts. J. Vis. Exp. , e53940 (2016).
- Simonian, M. H., Smith, J. A. Spectrophotometric and colorimetric determination of protein concentration. Curr. Protoc. Mol. Biol. 76, (2006).
- Buyel, J. F., Kaever, T., Buyel, J. J., Fischer, R. Predictive models for the accumulation of a fluorescent marker protein in tobacco leaves according to the promoter/5’UTR combination. Biotechnol. Bioeng. 110, 471-482 (2013).
- Piliarik, M., Vaisocherova, H., Homola, J. Surface plasmon resonance biosensing. Methods Mol. Biol. 503, 65-88 (2009).
- Kim, T. D., Ryu, H. J., Cho, H. I., Yang, C. H., Kim, J. Thermal behavior of proteins: Heat-resistant proteins and their heat-induced secondary structural changes. Biochemistry-Us. 39, 14839-14846 (2000).
- Kwon, S., Jung, Y., Lim, D. Proteomic analysis of heat-stable proteins in Escherichia coli. Bmb Rep. 41, 108-111 (2008).
- Komarnytsky, S., Borisjuk, N. V., Borisjuk, L. G., Alam, M. Z., Raskin, I. Production of recombinant proteins in tobacco guttation fluid. Plant Physiol. 124, 927-933 (2000).
- Drake, P. M. W., et al. Development of rhizosecretion as a production system for recombinant proteins from hydroponic cultivated tobacco. FASEB J. 23, 3581-3589 (2009).
- Turpen, T. H. Tobacco mosaic virus and the virescence of biotechnology. Philos. Trans. R. Soc. Lond., Ser. B: Biol. Sci. 354, 665-673 (1999).
- Kingsbury, N. J., McDonald, K. A. Quantitative Evaluation of E1 Endoglucanase Recovery from Tobacco Leaves Using the Vacuum Infiltration-Centrifugation Method. Biomed. Res. Int. , (2014).
- Buyel, J. F. Numeric simulation can be used to predict heat transfer during the blanching of leaves and intact. Biochem. Eng. J. , (2015).
- Mandal, M. K., Fischer, R., Schillberg, S., Schiermeyer, A. Inhibition of protease activity by antisense RNA improves recombinant protein production in Nicotiana tabacum cv. Bright Yellow 2 (BY-2) suspension cells. Biotechnol. J. 9, 1065-1073 (2014).
- Welty, J. R., Wicks, C. E., Wilson, R. E. . Fundamentals of momentum, heat, and mass transfer. , (1976).
- Lowe, D., et al. Aggregation, stability, and formulation of human antibody therapeutics. Advances in protein chemistry and structural biology. 84, 41-61 (2011).
- Gong, R., et al. Engineered human antibody constant domains with increased stability. J. Biol. Chem. 284, 14203-14210 (2009).
- Rouet, R., Lowe, D., Christ, D. Stability engineering of the human antibody repertoire. FEBS Lett. 588, 269-277 (2014).
- Stabel, J. R., Lambertz, A. Efficacy of pasteurization conditions for the inactivation of Mycobacterium avium subsp paratuberculosis in milk. J. Food Prot. 67, 2719-2726 (2004).
- Wichers, H., Mills, C., Wichers, H., Hoffmann-Sommergruber, K. Ch. 12. Managing Allergens in Food. , 336 (2006).
- Davis, P. J., Williams, S. C. Protein modification by thermal processing. Allergy. 53, 102-105 (1998).
- Dubois, M. F., Hovanessian, A. G., Bensaude, O. Heat-shock-induced denaturation of proteins. Characterization of the insolubilization of the interferon-induced p68 kinase. J. Biol. Chem. 266, 9707-9711 (1991).

