Vergelijking van de Tabak Host Cell Protein methode voor het verwijderen van blancheren intacte planten of door een warmtebehandeling van Extracten
Summary
Drie warmte precipitatiewerkwijzen gepresenteerd die effectief meer dan 90% van gastheerceleiwitten (HCP) van tabak extracten te verwijderen vóór alle andere zuiveringsstap. De plant HCPs irreversibel aggregeren bij temperaturen boven 60 ° C.
Abstract
Planten bieden niet alleen voedsel, voer en grondstoffen voor de mens, maar ook ontwikkeld als voordelig productieplatform voor biofarmaceutische eiwitten, zoals antilichamen, vaccin kandidaten en enzymen. Deze moeten worden gezuiverd uit de plantaardige biomassa, maar chromatografie stappen worden belemmerd door de hoge concentraties van de gastheercel eiwitten (HCPs) in plantenextracten. De meeste HCPs irreversibel aggregeren bij temperaturen boven 60 ° C vervolgens gemakkelijker zuivering van het doeleiwit. Hier worden drie methoden voorgesteld om de warmte precipitatie van tabak HCPs bereiken hetzij intacte bladeren of extracten. Het blancheren van intacte bladeren kunnen gemakkelijk in bestaande processen worden opgenomen, maar kan een negatief effect hebben op de daaropvolgende filtratie stappen te hebben. Het tegenovergestelde geldt voor de warmte het neerslaan van blad extracten in een geroerd vat, die de prestaties van de downstream-activiteiten te verbeteren, zij het met grote veranderingen in het proces van het ontwerp van apparatuur, zoalshomogenisator geometrie. Tenslotte wordt een warmtewisselaar setup goed gekarakteriseerd in termen van warmteoverdracht omstandigheden en gemakkelijk op schaal, maar reiniging kan moeilijk zijn en er kan een negatief effect op filter capaciteit. Het ontwerp-of-experimenten benadering kan worden gebruikt om de meest relevante procesparameters invloed HCP verwijdering en productwinning identificeren. Dit vergemakkelijkt de toepassing van elke methode andere expressie en het ter bepaling van de meest geschikte methode voor een bepaalde zuiveringsstrategie.
Introduction
Moderne systemen in de gezondheidszorg steeds meer afhankelijk van biofarmaceutische eiwitten 1. De productie van deze eiwitten in planten is voordelig vanwege de lage pathogeen last en grotere schaalbaarheid in vergelijking met conventionele expressiesystemen 2-4. Echter, de stroomafwaartse verwerking (DSP) van plantaardige geneesmiddelen uitdagend omdat de verstorende extractieprocedures resulteren in een hoge deeltjes belasting met troebelingen dan 5000 nefelometrische troebelingseenheden (NTUs), en eiwitten van de gastheercel (HCP) concentraties die vaak meer dan 95 % [m / m] 5,6.
Uitgebreide verduidelijkingsprocedures moeten 7-9 verspreide deeltjes te verwijderen, maar vloeistofchromatograaf is goedkoper om in-binden en elueren stand tijdens uitgangsproduct herstel of er een eerdere stap voor het effectief verwijderen van HCPs 10,11. Dit kan worden bereikt door het precipiteren van het doeleiwit via floccul12 mieren of lage pH 13,14, en door het veroorzaken van de HCPs te aggregeren. De selectieve aggregatie van ribulose-1,5-bisfosfaat carboxylase / oxygenase (RuBisCO), de meest voorkomende HCP in groene planten zoals tabak (Nicotiana tabacum), kan worden bevorderd door het toevoegen van polyethyleenglycol 15, maar dit is duur en onverenigbaar met grote -schaal productie. Warmtebehandeling is aangetoond dat het denatureren en precipiteren meer dan 95% van tabak HCP, terwijl eiwit malaria vaccin kandidaten zoals Vax8 stabiel in oplossing blijven 16-18.
Drie verschillende benaderingen werden gebruikt om de warmte-geïnduceerde precipitatie van tabak HCPs bereiken: (i) blancheren, dat wil zeggen, het onderdompelen van intacte bladeren in hete vloeistof, (ii) een thermisch geïsoleerde geroerd vat, en (iii) een warmtewisselaar ( figuur 1) 16. Voor intact bladeren, blancheren bereikte de snelle en efficiënte neerslaan van HCPs en was ook gemakkelijkopschalen en compatibel met bestaande grootschalige productieprocessen die een eerste stap om de plant biomassa 19 wassen omvatten. Daarentegen-geïsoleerde vaten, reeds op bepaalde werkwijzen en kan worden gebruikt voor de thermische behandeling van plantenextracten 20, maar de schaalbaarheid en energie overdrachtssnelheid beperkt omdat de oppervlakte-volumeverhouding van de tank geleidelijk verlaagd en ongeschikt wordt op procesniveau schaal. Een warmtewisselaar is een technisch goed gedefinieerde alternatief roervaten verhit maar vereist een overvloedige toevoer van verwarmings- en koelmiddelen zoals stoom en koud water, evenals een strak volumestroom die geschikt is om de warmtewisselaar geometrie en media eigenschappen, bijv., de soortelijke warmte. Dit artikel laat zien hoe alle drie methoden voor de warmte-geïnduceerde precipitatie van tabak HCPs en planten HCPs in het algemeen. De oprichting en de werking van each werkwijze in een laboratoriumomgeving worden gebruikt om hun geschiktheid voor grootschalige processen te evalueren. De grote uitdaging is om een adequate schaal-down modellen en actief voorwaarden te identificeren voor elke operatie die de apparaten en voorwaarden gebruikt tijdens proces-grootschalige productie lijken. De hier gepresenteerde gegevens hebben betrekking op experimenten met transgene tabaksplanten expressie het malariavaccin Vax8 en fluorescerend eiwit DsRed 16, maar de methode is ook met succes toegepast op N. benthamiana planten transient expressie andere biofarmaceutische eiwitten 21.
Een ontwerp-of-experimenten (DoE) benaderen 22 kan procesontwikkeling vergemakkelijken en flocculatoren 23 kan ook nuttig in deze context zijn zoals eerder beschreven 8. Het belangrijkste verschil tussen blancheren verwarmde tanks en warmtewisselaars is dat blancheren wordt toegepast op intacte bladeren vroeg in het proces, terwijl de others toegepast op plantenextracten (figuur 1).
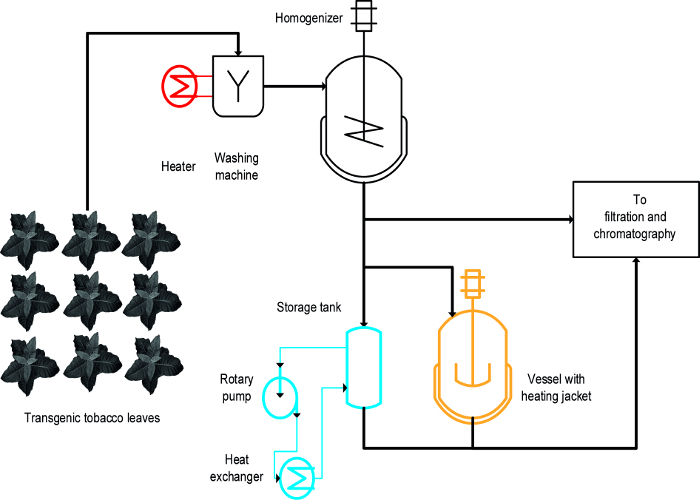
Figuur 1:. Process Flow Scheme Ter illustratie van de uitvoering van drie verschillende methoden voor tabak HCP Heat Neerslag Het plantmateriaal wordt gewassen en gehomogeniseerd voor verduidelijking en zuivering. Apparatuur voor het blancheren stap (rood) kan eenvoudig aan de bestaande machines worden toegevoegd. In tegenstelling tot het gebruik van een geroerd vat (oranje) en in het bijzonder een warmtewisselaar (blauw) vereist een of meerdere extra apparatuur en leidingen. Klik hier om een grotere versie van deze figuur te bekijken.
Protocol
Representative Results
Discussion
De drie methoden voor warmte-precipitatie hierboven beschreven effectief verwijderen tabak HCPs voorafgaand aan een chromatografische zuiveringsstap 16,17. Zij vullen andere strategieën die gericht zijn oorspronkelijke product zuiverheid, bijvoorbeeld guttatie 29, rhizosecretion 30 of centrifugale extractie 31,32, die beperkt zijn tot uitgescheiden eiwitten verhogen. Echter, de warmte gebaseerde methoden alleen gebruikt op een zinvolle wijze als het doeleiwit te zuiv…
Disclosures
The authors have nothing to disclose.
Acknowledgements
We would like to acknowledge Dr. Thomas Rademacher, Alexander Boes and Veronique Beiß for providing the transgenic tobacco seeds, and Ibrahim Al Amedi for cultivating the tobacco plants. The authors wish to thank Dr. Richard M. Twyman for editorial assistance as well as Güven Edgü for providing the MSP1-19 reference. This work was funded in part by the European Research Council Advanced Grant ”Future-Pharma”, proposal number 269110, the Fraunhofer-Zukunftsstiftung (Fraunhofer Future Foundation) and Fraunhofer-Gesellschaft Internal Programs under Grant No. Attract 125-600164.
Materials
| 2100P Portable Turbidimeter | Hach | 4650000 | Turbidimeter |
| Amine Coupling Kit | GE Healthcare | BR100050 | SPR chip coupling kit |
| Autoclaving basket | Nalgene | 6917-0230 | Basket for leaf blanching |
| Biacore T200 | GE Healthcare | 28-9750-01 | SPR device |
| Bio Cell Analyser BCA 003 R&D with 3D ORM | Sequip | n.a. | Particle size analyzer |
| Blender | Waring | 800EG | Blender |
| BP-410 | Furh | 2632410001 | Bag filter |
| Centrifuge 5415D | Eppendorf | 5424 000.410 | Centrifuge |
| Centrifuge tube 15 mL | Labomedic | 2017106 | Reaction tube |
| Centrifuge tube 50 mL self-standing | Labomedic | 1110504 | Reaction tube |
| CM5 chip | GE Healthcare | BR100012 | Chip for SPR measurements |
| Cuvette 10x10x45 | Sarsted | 67.754 | Cuvette for Zetasizer Nano ZS |
| Design-Expert(R) 8 | Stat-Ease, Inc. | n.a. | DoE software |
| Disodium phosphate | Carl Roth GmbH | 4984.3 | Media component |
| Ferty 2 Mega | Kammlott | 5.220072 | Fertilizer |
| Forma -86C ULT freezer | ThermoFisher | 88400 | Freezer |
| Greenhouse | n.a. | n.a. | For plant cultivation |
| Grodan Rockwool Cubes 10x10cm | Grodan | 102446 | Rockwool block |
| Twentey-loop heat exchanger (4.8 m length) | n.a. (custom design) | n.a. | Heat exchanger |
| HEPES | Carl Roth GmbH | 9105.3 | Media component |
| K200P 60D | Pall | 5302303 | Depth filter layer |
| KS50P 60D | Pall | B12486 | Depth filter layer |
| Lauda E300 | Lauda Dr Wobser GmbH | Z90010 | Water bath thermostat |
| L/S 24 | Masterflex | SN-06508-24 | Tubing |
| mAb 5.2 | American Type Culture Collection | HB-9148 | Vax8 specific antibody |
| Masterflex L/S | Masterflex | HV-77921-75 | Peristaltic pump |
| Miracloth | Labomedic | 475855-1R | Filter cloth |
| MultiLine Multi 3410 IDS | WTW | WTW_2020 | pH meter / conductivity meter |
| Osram cool white 36 W | Osram | 4930440 | Light source |
| Phytotron | Ilka Zell | n.a. | For plant cultivation |
| Sodium disulfit | Carl Roth GmbH | 8554.1 | Media component |
| Sodium chloride | Carl Roth GmbH | P029.2 | Media component |
| Stainless-steel vessel; 0.7-kg 2.0-L; height 180 mm; diameter 120 mm | n.a. (custom design) | n.a. | Container for heat precipitation |
| Synergy HT | BioTek | SIAFRT | Fluorescence and spectrometric plate reader |
| VelaPad 60 | Pall | VP60G03KNH4 | Filter housing |
| Zetasizer Nano ZS | Malvern | ZEN3600 | DLS particle size distribution measurement |
| Zetasizer Software v7.11 | Malvern | n.a. | Software to operate the Zetasizer Nano ZS device |
References
- PhRMA. . 2013 Report: Medicines in Development – Biologics. , (2013).
- Buyel, J. F. Process development strategies in plant molecular farming. Curr. Pharm. Biotechnol. 16, 966-982 (2015).
- Stoger, E., Fischer, R., Moloney, M., Ma, J. K. C. Plant molecular pharming for the treatment of chronic and infectious diseases. Annu. Rev. Plant Biol. 65, 743-768 (2014).
- Melnik, S., Stoger, E. Green factories for biopharmaceuticals. Curr. Med. Chem. 20, 1038-1046 (2013).
- Buyel, J. F., Twyman, R. M., Fischer, R. Extraction and downstream processing of plant-derived recombinant proteins. Biotechnol. Adv. 33, 902-913 (2015).
- Wilken, L. R., Nikolov, Z. L. Recovery and purification of plant-made recombinant proteins. Biotechnol. Adv. 30, 419-433 (2012).
- Buyel, J. F., Fischer, R. Scale-down models to optimize a filter train for the downstream purification of recombinant pharmaceutical proteins produced in tobacco leaves. Biotechnol. J. 9, 415-425 (2014).
- Buyel, J. F., Fischer, R. Flocculation increases the efficacy of depth filtration during the downstream processing of recombinant pharmaceutical proteins produced in tobacco. Plant Biotechnol. J. 12, 240-252 (2014).
- Buyel, J. F., Opdensteinen, P., Fischer, R. Cellulose-based filter aids increase the capacity of depth filters during the downstream processing of plant-derived biopharmaceutical proteins. Biotechnol. J. 10, 584-591 (2014).
- Buyel, J. F., Fischer, R. Generic chromatography-based purification strategies accelerate the development of downstream processes for biopharmaceutical proteins produced in plants. Biotechnol. J. 9, 566-577 (2014).
- Buyel, J. F., Woo, J. A., Cramer, S. M., Fischer, R. The use of quantitative structure-activity relationship models to develop optimized processes for the removal of tobacco host cell proteins during biopharmaceutical production. J. Chromatogr. A. 1322, 18-28 (2013).
- Holler, C., Vaughan, D., Zhang, C. M. Polyethyleneimine precipitation versus anion exchange chromatography in fractionating recombinant beta-glucuronidase from transgenic tobacco extract. J. Chromatogr. A. 1142, 98-105 (2007).
- Buyel, J. F., Fischer, R. Downstream processing of biopharmaceutical proteins produced in plants: the pros and cons of flocculants. Bioengineered. 5, 138-142 (2014).
- Hassan, S., van Dolleweerd, C. J., Ioakeimidis, F., Keshavarz-Moore, E., Ma, J. K. Considerations for extraction of monoclonal antibodies targeted to different subcellular compartments in transgenic tobacco plants. Plant Biotechnol. J. 6, 733-748 (2008).
- Arfi, Z. A., Drossard, J., Hellwig, S., Fischer, R., Buyel, J. F. Polyclonal antibodies can effectively detect tobacco host cell proteins after RuBisCO depletion and endotoxin removal. Biotechnol. J. , (2015).
- Buyel, J. F., Gruchow, H. M., Boes, A., Fischer, R. Rational design of a host cell protein heat precipitation step simplifies the subsequent purification of recombinant proteins from tobacco. Biochem. Eng. J. 88, 162-170 (2014).
- Buyel, J. F., Fischer, R. A juice extractor can simplify the downstream processing of plant-derived biopharmaceutical proteins compared to blade-based homogenizers. Process Biochem. 50, 859-866 (2014).
- Beiss, V., et al. Heat-precipitation allows the efficient purification of a functional plant-derived malaria transmission-blocking vaccine candidate fusion protein. Biotechnol. Bioeng. 112, 1297-1305 (2015).
- Ma, J. K., et al. Regulatory approval and a first-in-human phase I clinical trial of a monoclonal antibody produced in transgenic tobacco plants. Plant Biotechnol. J. 13, 1106-1120 (2015).
- Mahajan, P. V., Caleb, O. J., Singh, Z., Watkins, C. B., Geyer, M. Postharvest treatments of fresh produce. Philos T R Soc A. 372, (2014).
- Menzel, S., et al. Optimized blanching reduces the host cell protein content and substantially enhances the recovery and stability of two plant derived malaria vaccine candidates. Front. Plant Sci. , (2015).
- Buyel, J. F., Fischer, R. Characterization of complex systems using the design of experiments approach: transient protein expression in tobacco as a case study. J. Vis. Exp. , e51216 (2014).
- Buyel, J. F. Procedure to evaluate the efficiency of flocculants for the removal of dispersed particles from plant extracts. J. Vis. Exp. , e53940 (2016).
- Simonian, M. H., Smith, J. A. Spectrophotometric and colorimetric determination of protein concentration. Curr. Protoc. Mol. Biol. 76, (2006).
- Buyel, J. F., Kaever, T., Buyel, J. J., Fischer, R. Predictive models for the accumulation of a fluorescent marker protein in tobacco leaves according to the promoter/5’UTR combination. Biotechnol. Bioeng. 110, 471-482 (2013).
- Piliarik, M., Vaisocherova, H., Homola, J. Surface plasmon resonance biosensing. Methods Mol. Biol. 503, 65-88 (2009).
- Kim, T. D., Ryu, H. J., Cho, H. I., Yang, C. H., Kim, J. Thermal behavior of proteins: Heat-resistant proteins and their heat-induced secondary structural changes. Biochemistry-Us. 39, 14839-14846 (2000).
- Kwon, S., Jung, Y., Lim, D. Proteomic analysis of heat-stable proteins in Escherichia coli. Bmb Rep. 41, 108-111 (2008).
- Komarnytsky, S., Borisjuk, N. V., Borisjuk, L. G., Alam, M. Z., Raskin, I. Production of recombinant proteins in tobacco guttation fluid. Plant Physiol. 124, 927-933 (2000).
- Drake, P. M. W., et al. Development of rhizosecretion as a production system for recombinant proteins from hydroponic cultivated tobacco. FASEB J. 23, 3581-3589 (2009).
- Turpen, T. H. Tobacco mosaic virus and the virescence of biotechnology. Philos. Trans. R. Soc. Lond., Ser. B: Biol. Sci. 354, 665-673 (1999).
- Kingsbury, N. J., McDonald, K. A. Quantitative Evaluation of E1 Endoglucanase Recovery from Tobacco Leaves Using the Vacuum Infiltration-Centrifugation Method. Biomed. Res. Int. , (2014).
- Buyel, J. F. Numeric simulation can be used to predict heat transfer during the blanching of leaves and intact. Biochem. Eng. J. , (2015).
- Mandal, M. K., Fischer, R., Schillberg, S., Schiermeyer, A. Inhibition of protease activity by antisense RNA improves recombinant protein production in Nicotiana tabacum cv. Bright Yellow 2 (BY-2) suspension cells. Biotechnol. J. 9, 1065-1073 (2014).
- Welty, J. R., Wicks, C. E., Wilson, R. E. . Fundamentals of momentum, heat, and mass transfer. , (1976).
- Lowe, D., et al. Aggregation, stability, and formulation of human antibody therapeutics. Advances in protein chemistry and structural biology. 84, 41-61 (2011).
- Gong, R., et al. Engineered human antibody constant domains with increased stability. J. Biol. Chem. 284, 14203-14210 (2009).
- Rouet, R., Lowe, D., Christ, D. Stability engineering of the human antibody repertoire. FEBS Lett. 588, 269-277 (2014).
- Stabel, J. R., Lambertz, A. Efficacy of pasteurization conditions for the inactivation of Mycobacterium avium subsp paratuberculosis in milk. J. Food Prot. 67, 2719-2726 (2004).
- Wichers, H., Mills, C., Wichers, H., Hoffmann-Sommergruber, K. Ch. 12. Managing Allergens in Food. , 336 (2006).
- Davis, P. J., Williams, S. C. Protein modification by thermal processing. Allergy. 53, 102-105 (1998).
- Dubois, M. F., Hovanessian, A. G., Bensaude, O. Heat-shock-induced denaturation of proteins. Characterization of the insolubilization of the interferon-induced p68 kinase. J. Biol. Chem. 266, 9707-9711 (1991).

