השוואת שיטות להסרת Cell חלבון מארח טבק ידי לבנת צמחים שלמים או על ידי טיפול בחום של תמציות
Summary
שלושה חום שיטות ממטרים מוצגות ביעילות להסיר יותר מ -90% של חלבוני תא מארח (HCPs) מטבק תמציות לפני כל צעד טיהור אחר. המפעל HCPs לצבור באופן בלתי הפיך בטמפרטורות מעל 60 מעלות צלזיוס.
Abstract
צמחים לא רק לספק מזון, מזון וחומר גלם עבור בני אדם, אלא גם פותחו כמערכת ייצור חסכונית עבור חלבונים הביו-פרמצבטיקה, כגון נוגדנים, מועמדי חיסון ואנזימים. חייבים להיות מטוהרים אלה מן ביומסה במפעל אבל צעדים כרומטוגרפיה הם הפריעו ידי הריכוזים הגבוהים של חלבוני תא מארח (HCPs) תמציות צמחים. עם זאת, רוב HCPs לצבור באופן בלתי הפיך בטמפרטורות מעל 60 מעלות צלזיוס הקלת הטיהור הבאה של חלבון המטרה. הנה, שלוש שיטות מוצגות כדי להשיג את המשקעים בלהט HCPs טבק או שלמי עלים או תמציות. מבצע לבנת עלים שלמים ניתן לשלב בקלות לתוך תהליכים קיימים אך עשויה להיות השפעה שלילית על צעדי סינון הבאים. ההפך הוא נכון עבור משקעים חומים של תמציות עלו בתוך כלי בחש, אשר יכול לשפר את הביצועים של פעולות במורד זרם אמנם עם שינויים משמעותיים בעיצוב מכשור הטכנולוגי, כגוןגיאומטרית homogenizer. לבסוף, התקנה מחליפה חום מאופיין גם מבחינת תנאי העברת חום קל מידה, אבל ניקוי יכול להיות קשה ולא תיתכן השפעה שלילית על יכולת סינון. העיצוב-של-ניסויי הגישה יכולה לשמש כדי לזהות את הפרמטרים של תהליך הרלוונטיים ביותר משפיעי הסרת HCP והתאוששות מוצר. זה מקל על היישום של כל שיטה בפלטפורמות ביטוי אחרות וזיהוי של השיטה המתאימה ביותר עבור אסטרטגיה לטיהור נתונה.
Introduction
מערכות בריאות מודרניות תלויות יותר ויותר על חלבונים ביולוגיים 1. הפקת חלבונים אלה בצמחים יש יתרון בגלל הנטל הפתוגן נמוך מדרוג גבוה יותר בהשוואה למערכות ביטוי קונבנציונאלי 2-4. עם זאת, העיבוד במורד הזרם (DSP) של תרופות צמחיות יכול להיות מאתגר, מכיוון שתהליך החילוץ משבש לגרום לניטל חלקיקים גבוה, עם turbidities העולה על 5,000 יחידות עכירות nephelometric (NTUs), וחלבון תא מארח (HCP) ריכוזים לעתים קרובות עולים על 95 % [מ '/ מ'] 5,6.
נהלי הבהרה משוכללים נדרשים להסיר התפזרו חלקיקים 7-9, אבל ציוד כרומטוגרפיה הוא פחות יקר לפעול במצב לאגד-ו-elute במהלך ההתאוששות ראשונית של מוצר אם יש שלב מוקדם להסרת יעיל של HCPs 10,11. זו יכולה להיות מושגת גם על ידי מזרז חלבון המטרה באמצעות flocculנמלים 12 או pH נמוך 13,14, כמו גם על ידי גורם HCPs לצבור. ההצטברות סלקטיבית של ribulose-1,5-bisphosphate carboxylase / oxygenase (RuBisCO), את HCP הנפוץ ביותר בצמחים ירוקים כגון טבק (טבק), ניתן לקדם באמצעות הוספת פוליאתילן גליקול 15, אבל זה יקר עולה בקנה אחד עם גדול ייצור -scale. עיבוד תרמי הוכח לפגל משקע יותר מ -95% של HCPs טבק, בעוד מועמדי חיסון חלבון מלריה כגון Vax8 להישאר יציבים בתמיסה 16-18.
שלוש גישות שונות שימשו כדי להשיג את המשקעים הנגרמת בלהט HCPs טבק: (i) הלבנה, כלומר, טבילה של עלים שלמים נוזל חם, (ii) בטמפרטורה מבוקרת עוררה כלי, וכן (iii) מחליף חום ( איור 1) 16. לקבלת עלים שלמים, לבנה השיג את המשקעים המהירים ויעילים של HCPs והיה גם קלבהיקף של עד ועומד בקנה אחד עם תהליכי ייצור בקנה מידה גדול הקיימים הכוללים צעד ראשון לשטוף את ביומסה במפעל 19. לעומת זאת, כלי בקרת טמפרטורה כבר זמין בתהליכים מסוימים וניתן להשתמש בו לטיפול התרמי של תמציות צמחים 20, אבל מדרגיות אנרגית קצב העברה שלהם מוגבלות בגלל היחס שטחו פן לנפח של הטנקים מצטמצם בהדרגה הופך מתאים בקנה מידה תהליך. מחליף חום הוא אלטרנטיבה מוגדרת היטב מבחינה טכנית מחוממת כלי עוררה אבל דורש שפע של חימום ומדיה קירור, למשל, קיטור ומים קרים, כמו גם ספיקה בחוזקה מבוקרת ומותאמת הגיאומטריה המחליפה חום נכסי מדיה, למשל., קיבולת החום הסגולית. מאמר זה מראה כיצד כל שלוש שיטות יכולות לשמש עבור הממטרים החומים הנגרמת של HCPs הטבק, HCPs צמח בכלל. הקמה והפעלה של EACשיטת h במעבדה הגדרה שניתן להשתמש בהם כדי להעריך את מידת התאמתם תהליכים בקנה מידה גדול יותר. האתגר העיקרי הוא לזהות מודלים בקנה מידה למטה נאותים ותנאי פועל עבור כל פעולה דומה ההתקנים ותנאי שימוש במהלך תהליך ייצור בקנה מידה. הנתונים המוצגים כאן מתייחסים ניסויים שנערכו עם צמחי טבק מהונדסים מבטא מועמד חיסון למלריה Vax8 ו חלבון פלואורסצנטי DsRed 16, אבל השיטה גם יושמה בהצלחת נ צמחי benthamiana לבטא חלבונים ביולוגיים אחרים זמן 21.
עיצוב-של-ניסויים (DOE) להתקרב 22 יכול להקל על פיתוח תהליך, flocculants 23 יכול גם להיות מועיל בהקשר זה כפי שתואר לעיל 8. ההבדל העיקרי בין הלבנה, כלי מחומם מחליפי חום הוא הלבנה מוחלת על עלים שלמים מוקדם בתהליך ואילו otשלה מוחלים תמציות צמחים (איור 1).
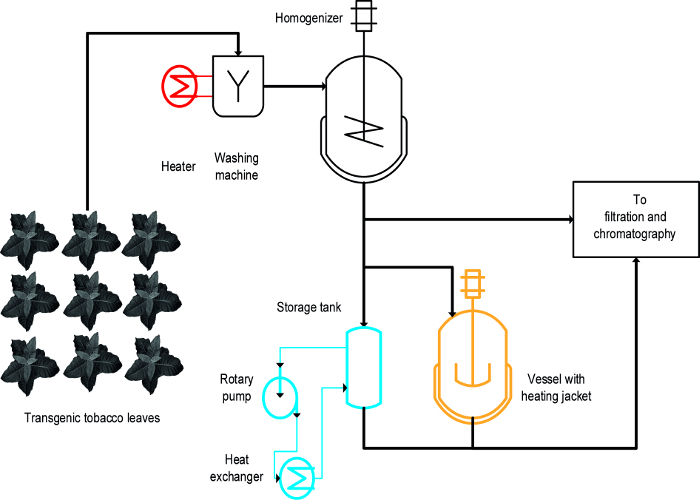
איור 1:. תהליך Scheme הזרימה הממחיש את היישום בשלוש שיטות שונות עבור משקעי חום הטבק HCP החומר הצמחי נשטף הומוגני לפני ההבהרה וטיהור. הציוד עבור השלב הלבן (אדום) ניתן להוסיף בקלות על המכונות הקיימות. לעומת זאת, מתוך כלי בחש (כתומה) ובמיוחד מחליף חום (כחול) דורש אחד או מספר התקנים נוספים צינורות. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Protocol
Representative Results
Discussion
שלוש השיטות עבור משקעים חום המתואר לעיל ניתן להסיר ביעילות HCPs טבק לפני כל צעד טיהור chromatographic 16,17. הם משלימים אסטראטגי אחרים שמטרתן להגדיל טוהר מוצר ראשוני, למשל, guttation 29, rhizosecretion 30 או צנטריפוגלי חילוץ 31,32, שכולן מוגבלי חלבונים מופרשים. עם זא?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
We would like to acknowledge Dr. Thomas Rademacher, Alexander Boes and Veronique Beiß for providing the transgenic tobacco seeds, and Ibrahim Al Amedi for cultivating the tobacco plants. The authors wish to thank Dr. Richard M. Twyman for editorial assistance as well as Güven Edgü for providing the MSP1-19 reference. This work was funded in part by the European Research Council Advanced Grant ”Future-Pharma”, proposal number 269110, the Fraunhofer-Zukunftsstiftung (Fraunhofer Future Foundation) and Fraunhofer-Gesellschaft Internal Programs under Grant No. Attract 125-600164.
Materials
| 2100P Portable Turbidimeter | Hach | 4650000 | Turbidimeter |
| Amine Coupling Kit | GE Healthcare | BR100050 | SPR chip coupling kit |
| Autoclaving basket | Nalgene | 6917-0230 | Basket for leaf blanching |
| Biacore T200 | GE Healthcare | 28-9750-01 | SPR device |
| Bio Cell Analyser BCA 003 R&D with 3D ORM | Sequip | n.a. | Particle size analyzer |
| Blender | Waring | 800EG | Blender |
| BP-410 | Furh | 2632410001 | Bag filter |
| Centrifuge 5415D | Eppendorf | 5424 000.410 | Centrifuge |
| Centrifuge tube 15 mL | Labomedic | 2017106 | Reaction tube |
| Centrifuge tube 50 mL self-standing | Labomedic | 1110504 | Reaction tube |
| CM5 chip | GE Healthcare | BR100012 | Chip for SPR measurements |
| Cuvette 10x10x45 | Sarsted | 67.754 | Cuvette for Zetasizer Nano ZS |
| Design-Expert(R) 8 | Stat-Ease, Inc. | n.a. | DoE software |
| Disodium phosphate | Carl Roth GmbH | 4984.3 | Media component |
| Ferty 2 Mega | Kammlott | 5.220072 | Fertilizer |
| Forma -86C ULT freezer | ThermoFisher | 88400 | Freezer |
| Greenhouse | n.a. | n.a. | For plant cultivation |
| Grodan Rockwool Cubes 10x10cm | Grodan | 102446 | Rockwool block |
| Twentey-loop heat exchanger (4.8 m length) | n.a. (custom design) | n.a. | Heat exchanger |
| HEPES | Carl Roth GmbH | 9105.3 | Media component |
| K200P 60D | Pall | 5302303 | Depth filter layer |
| KS50P 60D | Pall | B12486 | Depth filter layer |
| Lauda E300 | Lauda Dr Wobser GmbH | Z90010 | Water bath thermostat |
| L/S 24 | Masterflex | SN-06508-24 | Tubing |
| mAb 5.2 | American Type Culture Collection | HB-9148 | Vax8 specific antibody |
| Masterflex L/S | Masterflex | HV-77921-75 | Peristaltic pump |
| Miracloth | Labomedic | 475855-1R | Filter cloth |
| MultiLine Multi 3410 IDS | WTW | WTW_2020 | pH meter / conductivity meter |
| Osram cool white 36 W | Osram | 4930440 | Light source |
| Phytotron | Ilka Zell | n.a. | For plant cultivation |
| Sodium disulfit | Carl Roth GmbH | 8554.1 | Media component |
| Sodium chloride | Carl Roth GmbH | P029.2 | Media component |
| Stainless-steel vessel; 0.7-kg 2.0-L; height 180 mm; diameter 120 mm | n.a. (custom design) | n.a. | Container for heat precipitation |
| Synergy HT | BioTek | SIAFRT | Fluorescence and spectrometric plate reader |
| VelaPad 60 | Pall | VP60G03KNH4 | Filter housing |
| Zetasizer Nano ZS | Malvern | ZEN3600 | DLS particle size distribution measurement |
| Zetasizer Software v7.11 | Malvern | n.a. | Software to operate the Zetasizer Nano ZS device |
References
- PhRMA. . 2013 Report: Medicines in Development – Biologics. , (2013).
- Buyel, J. F. Process development strategies in plant molecular farming. Curr. Pharm. Biotechnol. 16, 966-982 (2015).
- Stoger, E., Fischer, R., Moloney, M., Ma, J. K. C. Plant molecular pharming for the treatment of chronic and infectious diseases. Annu. Rev. Plant Biol. 65, 743-768 (2014).
- Melnik, S., Stoger, E. Green factories for biopharmaceuticals. Curr. Med. Chem. 20, 1038-1046 (2013).
- Buyel, J. F., Twyman, R. M., Fischer, R. Extraction and downstream processing of plant-derived recombinant proteins. Biotechnol. Adv. 33, 902-913 (2015).
- Wilken, L. R., Nikolov, Z. L. Recovery and purification of plant-made recombinant proteins. Biotechnol. Adv. 30, 419-433 (2012).
- Buyel, J. F., Fischer, R. Scale-down models to optimize a filter train for the downstream purification of recombinant pharmaceutical proteins produced in tobacco leaves. Biotechnol. J. 9, 415-425 (2014).
- Buyel, J. F., Fischer, R. Flocculation increases the efficacy of depth filtration during the downstream processing of recombinant pharmaceutical proteins produced in tobacco. Plant Biotechnol. J. 12, 240-252 (2014).
- Buyel, J. F., Opdensteinen, P., Fischer, R. Cellulose-based filter aids increase the capacity of depth filters during the downstream processing of plant-derived biopharmaceutical proteins. Biotechnol. J. 10, 584-591 (2014).
- Buyel, J. F., Fischer, R. Generic chromatography-based purification strategies accelerate the development of downstream processes for biopharmaceutical proteins produced in plants. Biotechnol. J. 9, 566-577 (2014).
- Buyel, J. F., Woo, J. A., Cramer, S. M., Fischer, R. The use of quantitative structure-activity relationship models to develop optimized processes for the removal of tobacco host cell proteins during biopharmaceutical production. J. Chromatogr. A. 1322, 18-28 (2013).
- Holler, C., Vaughan, D., Zhang, C. M. Polyethyleneimine precipitation versus anion exchange chromatography in fractionating recombinant beta-glucuronidase from transgenic tobacco extract. J. Chromatogr. A. 1142, 98-105 (2007).
- Buyel, J. F., Fischer, R. Downstream processing of biopharmaceutical proteins produced in plants: the pros and cons of flocculants. Bioengineered. 5, 138-142 (2014).
- Hassan, S., van Dolleweerd, C. J., Ioakeimidis, F., Keshavarz-Moore, E., Ma, J. K. Considerations for extraction of monoclonal antibodies targeted to different subcellular compartments in transgenic tobacco plants. Plant Biotechnol. J. 6, 733-748 (2008).
- Arfi, Z. A., Drossard, J., Hellwig, S., Fischer, R., Buyel, J. F. Polyclonal antibodies can effectively detect tobacco host cell proteins after RuBisCO depletion and endotoxin removal. Biotechnol. J. , (2015).
- Buyel, J. F., Gruchow, H. M., Boes, A., Fischer, R. Rational design of a host cell protein heat precipitation step simplifies the subsequent purification of recombinant proteins from tobacco. Biochem. Eng. J. 88, 162-170 (2014).
- Buyel, J. F., Fischer, R. A juice extractor can simplify the downstream processing of plant-derived biopharmaceutical proteins compared to blade-based homogenizers. Process Biochem. 50, 859-866 (2014).
- Beiss, V., et al. Heat-precipitation allows the efficient purification of a functional plant-derived malaria transmission-blocking vaccine candidate fusion protein. Biotechnol. Bioeng. 112, 1297-1305 (2015).
- Ma, J. K., et al. Regulatory approval and a first-in-human phase I clinical trial of a monoclonal antibody produced in transgenic tobacco plants. Plant Biotechnol. J. 13, 1106-1120 (2015).
- Mahajan, P. V., Caleb, O. J., Singh, Z., Watkins, C. B., Geyer, M. Postharvest treatments of fresh produce. Philos T R Soc A. 372, (2014).
- Menzel, S., et al. Optimized blanching reduces the host cell protein content and substantially enhances the recovery and stability of two plant derived malaria vaccine candidates. Front. Plant Sci. , (2015).
- Buyel, J. F., Fischer, R. Characterization of complex systems using the design of experiments approach: transient protein expression in tobacco as a case study. J. Vis. Exp. , e51216 (2014).
- Buyel, J. F. Procedure to evaluate the efficiency of flocculants for the removal of dispersed particles from plant extracts. J. Vis. Exp. , e53940 (2016).
- Simonian, M. H., Smith, J. A. Spectrophotometric and colorimetric determination of protein concentration. Curr. Protoc. Mol. Biol. 76, (2006).
- Buyel, J. F., Kaever, T., Buyel, J. J., Fischer, R. Predictive models for the accumulation of a fluorescent marker protein in tobacco leaves according to the promoter/5’UTR combination. Biotechnol. Bioeng. 110, 471-482 (2013).
- Piliarik, M., Vaisocherova, H., Homola, J. Surface plasmon resonance biosensing. Methods Mol. Biol. 503, 65-88 (2009).
- Kim, T. D., Ryu, H. J., Cho, H. I., Yang, C. H., Kim, J. Thermal behavior of proteins: Heat-resistant proteins and their heat-induced secondary structural changes. Biochemistry-Us. 39, 14839-14846 (2000).
- Kwon, S., Jung, Y., Lim, D. Proteomic analysis of heat-stable proteins in Escherichia coli. Bmb Rep. 41, 108-111 (2008).
- Komarnytsky, S., Borisjuk, N. V., Borisjuk, L. G., Alam, M. Z., Raskin, I. Production of recombinant proteins in tobacco guttation fluid. Plant Physiol. 124, 927-933 (2000).
- Drake, P. M. W., et al. Development of rhizosecretion as a production system for recombinant proteins from hydroponic cultivated tobacco. FASEB J. 23, 3581-3589 (2009).
- Turpen, T. H. Tobacco mosaic virus and the virescence of biotechnology. Philos. Trans. R. Soc. Lond., Ser. B: Biol. Sci. 354, 665-673 (1999).
- Kingsbury, N. J., McDonald, K. A. Quantitative Evaluation of E1 Endoglucanase Recovery from Tobacco Leaves Using the Vacuum Infiltration-Centrifugation Method. Biomed. Res. Int. , (2014).
- Buyel, J. F. Numeric simulation can be used to predict heat transfer during the blanching of leaves and intact. Biochem. Eng. J. , (2015).
- Mandal, M. K., Fischer, R., Schillberg, S., Schiermeyer, A. Inhibition of protease activity by antisense RNA improves recombinant protein production in Nicotiana tabacum cv. Bright Yellow 2 (BY-2) suspension cells. Biotechnol. J. 9, 1065-1073 (2014).
- Welty, J. R., Wicks, C. E., Wilson, R. E. . Fundamentals of momentum, heat, and mass transfer. , (1976).
- Lowe, D., et al. Aggregation, stability, and formulation of human antibody therapeutics. Advances in protein chemistry and structural biology. 84, 41-61 (2011).
- Gong, R., et al. Engineered human antibody constant domains with increased stability. J. Biol. Chem. 284, 14203-14210 (2009).
- Rouet, R., Lowe, D., Christ, D. Stability engineering of the human antibody repertoire. FEBS Lett. 588, 269-277 (2014).
- Stabel, J. R., Lambertz, A. Efficacy of pasteurization conditions for the inactivation of Mycobacterium avium subsp paratuberculosis in milk. J. Food Prot. 67, 2719-2726 (2004).
- Wichers, H., Mills, C., Wichers, H., Hoffmann-Sommergruber, K. Ch. 12. Managing Allergens in Food. , 336 (2006).
- Davis, P. J., Williams, S. C. Protein modification by thermal processing. Allergy. 53, 102-105 (1998).
- Dubois, M. F., Hovanessian, A. G., Bensaude, O. Heat-shock-induced denaturation of proteins. Characterization of the insolubilization of the interferon-induced p68 kinase. J. Biol. Chem. 266, 9707-9711 (1991).

