Développement et maintenance d'une tumeur du patient Préclinique dérivé modèle de xénogreffe de l'enquête de Novel Anti-Cancer Therapies
Summary
Utilisant des tumeurs provenant de patients dans un modèle préclinique sous-cutanée est une excellente façon d'étudier l'efficacité de nouvelles thérapies, la découverte de biomarqueurs prédictifs et les voies résistantes aux médicaments. Ce modèle, dans le processus de développement de médicaments, est essentielle pour déterminer le sort de nombreuses thérapies anticancéreuses avant investigation clinique.
Abstract
Patient derived tumor xenograft (PDTX) models provide a necessary platform in facilitating anti-cancer drug development prior to human trials. Human tumor pieces are injected subcutaneously into athymic nude mice (immunocompromised, T cell deficient) to create a bank of tumors and subsequently are passaged into different generations of mice in order to maintain these tumors from patients. Importantly, cellular heterogeneity of the original tumor is closely emulated in this model, which provides a more clinically relevant model for evaluation of drug efficacy studies (single agent and combination), biomarker analysis, resistant pathways and cancer stem cell biology. Some limitations of the PDTX model include the replacement of the human stroma with mouse stroma after the first generation in mice, inability to investigate treatment effects on metastasis due to the subcutaneous injections of the tumors, and the lack of evaluation of immunotherapies due to the use of immunocompromised mice. However, even with these limitations, the PDTX model provides a powerful preclinical platform in the drug discovery process.
Introduction
Le cancer colorectal (CRC) est un facteur important de décès par cancer aux États-Unis. En 2015, il y avait environ 132,700 nouveaux cas de CRC avec 49.700 décès 1. Bien que le pronostic chez les patients présentant une maladie localisée est excellente, les patients ayant une maladie avancée ont des résultats médiocres, ce qui en fait une priorité majeure dans le développement de nouvelles thérapies. Malgré le niveau de régimes de soins de chimiothérapie et les produits biologiques plus récents qui sont déployés contre cette maladie, il y a eu seulement une augmentation progressive de la survie globale. Par conséquent, il existe un effort significatif dans la compréhension des voies pilotes impliqués dans la facilitation de la croissance tumorale dans cette maladie. L'Atlas Réseau Cancer Genome a récemment identifié de nombreuses voies principales qui sont impliqués dans CRC dysrégulation et comprennent: WNT, phosphoinositide 3-kinase (PI3K), RAS, facteur de croissance transformant β (TGF – β) et TP53 2. Ensemble, les enquêtes décrivant otses voies qui potentialisent la croissance des CRC ont enflammé le développement de nouvelles thérapies visant à améliorer de manière significative la survie dans cette population de patients 3-5. Utilisant des modèles précliniques en oncologie développement de médicaments ont joué un rôle essentiel dans ce processus pour prédire l'activité clinique de ces nouveaux composés.
Différents modèles pré-cliniques ont été utilisés dans le processus de développement de médicaments. Considérant que les modèles animaux transgéniques précliniques et des lignées cellulaires immortalisées ont échoué dans la détermination de l'activité clinique de nouvelles thérapies en oncologie, en grande partie en raison de leur incapacité à refléter la complexité des tumeurs humaines, xénogreffe de tumeur du patient dérivés (PDTX) modèles ont été établis. Le plus grand avantage de ce modèle est que l' hétérogénéité de la tumeur reste intacte et reflète étroitement les caractéristiques moléculaires et clonalité de l'origine de la tumeur du patient 6-9. Modèles PDTX fournissent un excellent in vivoplateforme préclinique pour l' étude de nouveaux agents, les voies de résistance aux médicaments, les stratégies combinatoires, et souches du cancer de la biologie cellulaire 10.
Un aperçu général du processus PDTX est illustrée à la figure 1. Il commence dans la clinique, des patients consentants pour permettre une partie de leur tissu tumoral en excès doit être utilisé pour cette recherche. Ensuite, à la chirurgie, un morceau de la tumeur est majoré par un pathologiste et mis en médias pour être transportés au personnel de recherche. Immédiatement après cela, une partie de la tumeur est découpée en petits morceaux et transplantés par voie sous- cutanée dans des souris immunodéficientes. Une fois que la tumeur se développe, elle est soumise à un passage dans les différentes générations de souris afin de maintenir la tumeur 10. En règle générale, après la génération F3 de la tumeur peut être étendue dans une étude de traitement, où de nouveaux composés et / ou des thérapies combinatoires sont évaluées. Utilisant des biomarqueurs prédictifs potentiels Next Gen Seq (Exome Seq, ARN Seq et SNP array) sont découvrired qui aident à la sélection des patients qui peuvent tirer profit d'un traitement particulier.
Les objectifs généraux de l'utilisation de modèles de PDTX sont: 1) évaluer l'efficacité de nouveaux traitements en monothérapie ou en association et 2) identifier des biomarqueurs prédictifs de la sensibilité ou de la résistance avant investigation clinique. Dans ce manuscrit, nous fournissons la méthodologie dans l'initiation et le maintien d'une banque CRC PDTX et de fournir les avantages et les limites de ce modèle dans la découverte de développement de médicaments.
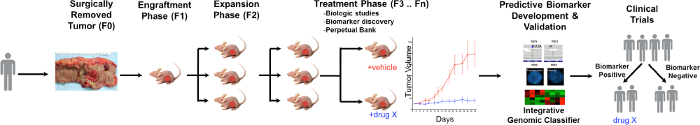
Figure 1. Vue d' ensemble du modèle de protocole CRC PDTX. Un patient tumeur dérivé est reçu de la chirurgie et immédiatement injecté dans des souris nude athymiques sous – cutanée. Une fois que la tumeur se développe, il est élargi dans les générations suivantes et finalement élargi pour les études de traitement. Traitement respoNSE sont évalués et biomarqueurs prédictifs sont identifiés qui peuvent aider à la sélection des patients. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Protocol
Representative Results
Discussion
La PDTX plate-forme de découverte de médicaments offre un modèle amélioré aux insuffisances des autres modèles précliniques qui sont peu fiables pour prédire l'activité clinique des nouveaux composés. Fait important, les tumeurs de ce modèle sont biologiquement stable, conservent un potentiel métastatique, et présentent la même réactivité médicaments de génération en génération. Dans ce modèle, dérivées patient tumeurs sont injectées dans des souris nude athymiques, repiquées, et ensuite ut…
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was supported by grant 1R01CA152303-01.
Materials
| RPMI or DMEM | Corning | 10-040-CV | |
| Penicillin-Streptomycin | Corning | 30-002-CI | |
| Non-essential Amino Acids | Corning | 25-025-CI | |
| Fetal Bovine Serum | Corning | 35-010-CV | Thaw in -4 °C, then activate for 30 minutes at 60 °C water bath |
| CPT blood tube | BD vacutainer | 362761 | |
| Microcentrifuge tube | Surelock | A-7002 | |
| Phospate-Buffered Saline | Corning | 21-040-CV | |
| Cyrogenic vials | Cyroking | C0732901 | |
| Plastic tumor cutting dish | Trueline | TR4001 | |
| Scissors | Roboz | RS-5881 | |
| Forceps | Roboz | RS-5135 | |
| Matrigel (gelatinous protein mixture) | Corning | 354234 | Store at -20 or -80 °C, then thaw on ice, do not leave at room temperature |
| 10% Formalin cups | Protocol | 032-059 | |
| Liquid Nitrogen Dewar Storage | Thermolyne | CY50900 | |
| Portable liquid nitrogen dewar | Nalgene | 4150-2000 | |
| Dimethyl Sulfoxide | Fischer | 67-68-5 | |
| Freezing container: Mr Frosty | Nalgene | 5100-0001 | |
| Isopropyl Alcohol | Decon | 64-17-5 | |
| Trocars | Innovative Research of America | MP-182 | |
| Anesthesia machine | Patterson Veterinary | none | |
| Anesthesia box | Patterson Veterinary | none | |
| Isoflurane | Vet one | 1038005 | |
| F-Air Canister | Bickford Omnicon | 80120 | |
| Meloxicam | Vet one | 5182-90C | |
| Calipers | Fowler | 54-100-167 | |
| Weight scale | Ohaus | Scout Pro SP601 |
References
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics. 2015. CA Cancer J Clin. 65 (1), 5-29 (2015).
- . Comprehensive molecular characterization of human colon and rectal cancer. Nature. 487 (7407), 330-337 (2012).
- Arcaroli, J. J., et al. Tumours with elevated levels of the Notch and Wnt pathways exhibit efficacy to PF-03084014, a gamma-secretase inhibitor, in a preclinical colorectal explant model. Br J Cancer. 109 (3), 667-675 (2013).
- Hubbard, J., Grothey, A. Antiangiogenesis agents in colorectal cancer. Curr Opin Oncol. 22 (4), 374-380 (2010).
- van Es, J. H., et al. Notch/gamma-secretase inhibition turns proliferative cells in intestinal crypts and adenomas into goblet cells. Nature. 435 (7044), 959-963 (2005).
- Cassidy, J. W., Caldas, C., Bruna, A. Maintaining Tumor Heterogeneity in Patient-Derived Tumor Xenografts. Cancer Res. 75 (15), 2963-2968 (2015).
- Jin, K., et al. Patient-derived human tumour tissue xenografts in immunodeficient mice: a systematic review. Clin Transl Oncol. 12 (7), 473-480 (2010).
- Julien, S., et al. Characterization of a large panel of patient-derived tumor xenografts representing the clinical heterogeneity of human colorectal cancer. Clin Cancer Res. 18 (19), 5314-5328 (2012).
- Siolas, D., Hannon, G. J. Patient-derived tumor xenografts: transforming clinical samples into mouse models. Cancer Res. 73 (17), 5315-5319 (2013).
- Tentler, J. J., et al. Patient-derived tumour xenografts as models for oncology drug development. Nat Rev Clin Oncol. 9 (6), 338-350 (2012).
- Carson, F. L. . Histotechnology: A Self-Assessment Workbook. , (1996).
- Arcaroli, J. J., et al. Common PIK3CA mutants and a novel 3′ UTR mutation are associated with increased sensitivity to saracatinib. Clin Cancer Res. 18 (9), 2704-2714 (2012).
- Arcaroli, J. J., et al. A NOTCH1 gene copy number gain is a prognostic indicator of worse survival and a predictive biomarker to a Notch1 targeting antibody in colorectal cancer. Int J Cancer. 138 (1), 195-205 (2016).
- Arcaroli, J. J., et al. Gene array and fluorescence in situ hybridization biomarkers of activity of saracatinib (AZD0530), a Src inhibitor, in a preclinical model of colorectal cancer. Clin Cancer Res. 16 (16), 4165-4177 (2010).
- Lieu, C. H., et al. Antitumor activity of a potent MEK inhibitor, TAK-733, against colorectal cancer cell lines and patient derived xenografts. Oncotarget. 6 (33), 34561-34572 (2015).
- Pitts, T. M., et al. Association of the epithelial-to-mesenchymal transition phenotype with responsiveness to the p21-activated kinase inhibitor, PF-3758309, in colon cancer models. Front Pharmacol. 4, 35 (2013).
- Song, E. K., et al. Potent antitumor activity of cabozantinib, a c-MET and VEGFR2 inhibitor, in a colorectal cancer patient-derived tumor explant model. Int J Cancer. 136 (8), 1967-1975 (2015).
- Tentler, J. J., et al. Identification of predictive markers of response to the MEK1/2 inhibitor selumetinib (AZD6244) in K-ras-mutated colorectal cancer. Mol Cancer Ther. 9 (12), 3351-3362 (2010).
- Bardelli, A., et al. Amplification of the MET receptor drives resistance to anti-EGFR therapies in colorectal cancer. Cancer Discov. 3 (6), 658-673 (2013).
- Bertotti, A., et al. A molecularly annotated platform of patient-derived xenografts (“xenopatients”) identifies HER2 as an effective therapeutic target in cetuximab-resistant colorectal cancer. Cancer Discov. 1 (6), 508-523 (2011).
- Davis, S. L., et al. Combined inhibition of MEK and Aurora A kinase in KRAS/PIK3CA double-mutant colorectal cancer models. Front Pharmacol. 6, 120 (2015).
- Morelli, M. P., et al. Preclinical activity of the rational combination of selumetinib (AZD6244) in combination with vorinostat in KRAS-mutant colorectal cancer models. Clin Cancer Res. 18 (4), 1051-1062 (2012).
- Pitts, T. M., et al. Dual pharmacological targeting of the MAP kinase and PI3K/mTOR pathway in preclinical models of colorectal cancer. PLoS One. 9 (11), e113037 (2014).
- Spreafico, A., et al. Rational combination of a MEK inhibitor, selumetinib, and the Wnt/calcium pathway modulator, cyclosporin A, in preclinical models of colorectal cancer. Clin Cancer Res. 19 (15), 4149-4162 (2013).
- Arcaroli, J. J., et al. ALDH+ tumor-initiating cells exhibiting gain in NOTCH1 gene copy number have enhanced regrowth sensitivity to a gamma-secretase inhibitor and irinotecan in colorectal cancer. Mol Oncol. 6 (3), 370-381 (2012).
- Hoey, T., et al. DLL4 blockade inhibits tumor growth and reduces tumor-initiating cell frequency. Cell Stem Cell. 5 (2), 168-177 (2009).
- Ikebuchi, F., et al. Dissociation of c-Met phosphotyrosine sites in human cells in response to mouse hepatocyte growth factor but not human hepatocyte growth factor: the possible roles of different amino acids in different species. Cell Biochem Funct. 31 (4), 298-304 (2013).
- Zhang, Y. W., et al. Enhanced growth of human met-expressing xenografts in a new strain of immunocompromised mice transgenic for human hepatocyte growth factor/scatter factor. Oncogene. 24 (1), 101-106 (2005).

