Desarrollo y mantenimiento de un tumor del paciente preclínicos Derivado modelo de xenoinjerto para la Investigación de Novela Anti-Cancer Therapies
Summary
La utilización de los tumores derivados del paciente en un modelo preclínico subcutánea es una manera excelente para estudiar la eficacia de nuevas terapias, el descubrimiento de biomarcadores predictivos y vías resistentes a los fármacos. Este modelo, en el proceso de desarrollo de fármacos, es fundamental para determinar el destino de muchas nuevas terapias contra el cáncer antes de la investigación clínica.
Abstract
Patient derived tumor xenograft (PDTX) models provide a necessary platform in facilitating anti-cancer drug development prior to human trials. Human tumor pieces are injected subcutaneously into athymic nude mice (immunocompromised, T cell deficient) to create a bank of tumors and subsequently are passaged into different generations of mice in order to maintain these tumors from patients. Importantly, cellular heterogeneity of the original tumor is closely emulated in this model, which provides a more clinically relevant model for evaluation of drug efficacy studies (single agent and combination), biomarker analysis, resistant pathways and cancer stem cell biology. Some limitations of the PDTX model include the replacement of the human stroma with mouse stroma after the first generation in mice, inability to investigate treatment effects on metastasis due to the subcutaneous injections of the tumors, and the lack of evaluation of immunotherapies due to the use of immunocompromised mice. However, even with these limitations, the PDTX model provides a powerful preclinical platform in the drug discovery process.
Introduction
El cáncer colorrectal (CCR) es un importante contribuyente a las muertes por cáncer en los Estados Unidos. En 2015, había un estimado de 132.700 nuevos casos de CCR con 49.700 muertes 1. Aunque el pronóstico en pacientes con enfermedad localizada es excelente, los pacientes con enfermedad avanzada tienen resultados pobres, haciendo de esta una de las principales prioridades en el desarrollo de nuevas terapias. A pesar de los regímenes estándar de cuidado quimioterapéuticos y biológicos más nuevos que se implementan contra esta enfermedad, sólo ha habido un aumento gradual en la supervivencia global. En consecuencia, hay un esfuerzo significativo en la comprensión de las vías conductor implicado en facilitar el crecimiento del tumor en esta enfermedad. La Red Atlas del Genoma del Cáncer ha identificado recientemente numerosas vías principales que están implicados en la desregulación y CRC incluyen: WNT, fosfoinosítido 3-quinasa (PI3K), RAS, factor de crecimiento transformante-β (TGF-β) y TP53 2. Juntos, con la descripción de las investigaciones otsus vías que potencien el crecimiento en el CCR han encendido el desarrollo de nuevas terapias destinadas a mejorar significativamente la supervivencia en esta población de pacientes 3-5. Utilizando modelos preclínicos en el desarrollo de fármacos oncológicos han sido esenciales en este proceso en la predicción de la actividad clínica de estos nuevos compuestos.
Varios modelos preclínicos se han utilizado en el proceso de desarrollo de fármacos. Teniendo en cuenta que los modelos animales preclínicos transgénicas y líneas celulares inmortalizadas no han tenido éxito en la determinación de la actividad clínica de nuevas terapias de oncología, en gran parte debido a su incapacidad para reflejar la complejidad de los tumores humanos, se han establecido derivado del paciente de xenoinjertos de tumores (PDTX) modelos. La mayor ventaja de este modelo es que la heterogeneidad del tumor se mantiene intacto y refleja fielmente las características moleculares y clonalidad del tumor del paciente 6-9 originario. PDTX modelos proporcionan una excelente in vivoplataforma preclínico para el estudio de nuevos agentes, las vías de resistencia a fármacos, estrategias combinatorias, y la biología de células madre del cáncer 10.
Una visión general del proceso de PDTX se ilustra en la Figura 1. Se inicia en la clínica, consintiendo pacientes para permitir que parte de su exceso de tejido tumoral que se utilizará para esta investigación. A continuación, en la cirugía, un pedazo del tumor se ganó en total por un patólogo y puesto en los medios de comunicación para ser transportado a personal de investigación. Inmediatamente después de esto, una sección del tumor se corta en trozos pequeños y trasplantado en ratones inmunodeficientes subcutáneamente. Una vez que el tumor crece, es pasado en diferentes generaciones de ratones con el fin de mantener el tumor 10. Normalmente, después de la generación F3 del tumor se puede ampliar en un estudio de tratamiento donde se evalúan nuevos compuestos y / o terapias combinadas. Utilizando Next Gen SEQ (Exoma Seq, ARN SEQ y SNP array) potenciales biomarcadores predictivos son descubrired que ayudan en la selección de pacientes que podrían beneficiarse de la de un tratamiento particular.
Los objetivos generales de la utilización de modelos PDTX son los siguientes: 1) evaluar la eficacia de las terapias innovadoras como agente único o en combinación y 2) identificar biomarcadores predictivos de sensibilidad o resistencia antes de la investigación clínica. En este manuscrito, proporcionamos la metodología en la iniciación y mantenimiento de un banco CRC PDTX y proporcionar las ventajas y limitaciones de este modelo de desarrollo descubrimiento de fármacos.
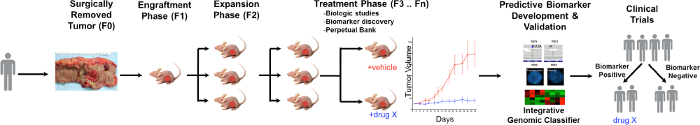
Figura 1. Descripción general del modelo de protocolo CRC PDTX. Un tumor derivado del paciente se recibe de la cirugía e inmediatamente se inyecta en ratones desnudos atímicos por vía subcutánea. Una vez que el tumor crece, se expande en las generaciones posteriores y, finalmente, se expandió por los estudios de tratamiento. tratamiento RESPOns son evaluados y biomarcadores predictivos son identificados que pueden ayudar en la selección de los pacientes. Haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
La plataforma de descubrimiento de fármacos PDTX ofrece un modelo mejorado de las deficiencias de otros modelos preclínicos que son poco fiables para predecir la actividad clínica de nuevos compuestos. Es importante destacar que los tumores en este modelo son biológicamente estable, retener potencial metastásico, y muestran la capacidad de respuesta droga similar de generación en generación. En este modelo, los tumores de pacientes derivada se inyectan en ratones desnudos atímicos, pases, y posteriormente utiliz…
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was supported by grant 1R01CA152303-01.
Materials
| RPMI or DMEM | Corning | 10-040-CV | |
| Penicillin-Streptomycin | Corning | 30-002-CI | |
| Non-essential Amino Acids | Corning | 25-025-CI | |
| Fetal Bovine Serum | Corning | 35-010-CV | Thaw in -4 °C, then activate for 30 minutes at 60 °C water bath |
| CPT blood tube | BD vacutainer | 362761 | |
| Microcentrifuge tube | Surelock | A-7002 | |
| Phospate-Buffered Saline | Corning | 21-040-CV | |
| Cyrogenic vials | Cyroking | C0732901 | |
| Plastic tumor cutting dish | Trueline | TR4001 | |
| Scissors | Roboz | RS-5881 | |
| Forceps | Roboz | RS-5135 | |
| Matrigel (gelatinous protein mixture) | Corning | 354234 | Store at -20 or -80 °C, then thaw on ice, do not leave at room temperature |
| 10% Formalin cups | Protocol | 032-059 | |
| Liquid Nitrogen Dewar Storage | Thermolyne | CY50900 | |
| Portable liquid nitrogen dewar | Nalgene | 4150-2000 | |
| Dimethyl Sulfoxide | Fischer | 67-68-5 | |
| Freezing container: Mr Frosty | Nalgene | 5100-0001 | |
| Isopropyl Alcohol | Decon | 64-17-5 | |
| Trocars | Innovative Research of America | MP-182 | |
| Anesthesia machine | Patterson Veterinary | none | |
| Anesthesia box | Patterson Veterinary | none | |
| Isoflurane | Vet one | 1038005 | |
| F-Air Canister | Bickford Omnicon | 80120 | |
| Meloxicam | Vet one | 5182-90C | |
| Calipers | Fowler | 54-100-167 | |
| Weight scale | Ohaus | Scout Pro SP601 |
References
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics. 2015. CA Cancer J Clin. 65 (1), 5-29 (2015).
- . Comprehensive molecular characterization of human colon and rectal cancer. Nature. 487 (7407), 330-337 (2012).
- Arcaroli, J. J., et al. Tumours with elevated levels of the Notch and Wnt pathways exhibit efficacy to PF-03084014, a gamma-secretase inhibitor, in a preclinical colorectal explant model. Br J Cancer. 109 (3), 667-675 (2013).
- Hubbard, J., Grothey, A. Antiangiogenesis agents in colorectal cancer. Curr Opin Oncol. 22 (4), 374-380 (2010).
- van Es, J. H., et al. Notch/gamma-secretase inhibition turns proliferative cells in intestinal crypts and adenomas into goblet cells. Nature. 435 (7044), 959-963 (2005).
- Cassidy, J. W., Caldas, C., Bruna, A. Maintaining Tumor Heterogeneity in Patient-Derived Tumor Xenografts. Cancer Res. 75 (15), 2963-2968 (2015).
- Jin, K., et al. Patient-derived human tumour tissue xenografts in immunodeficient mice: a systematic review. Clin Transl Oncol. 12 (7), 473-480 (2010).
- Julien, S., et al. Characterization of a large panel of patient-derived tumor xenografts representing the clinical heterogeneity of human colorectal cancer. Clin Cancer Res. 18 (19), 5314-5328 (2012).
- Siolas, D., Hannon, G. J. Patient-derived tumor xenografts: transforming clinical samples into mouse models. Cancer Res. 73 (17), 5315-5319 (2013).
- Tentler, J. J., et al. Patient-derived tumour xenografts as models for oncology drug development. Nat Rev Clin Oncol. 9 (6), 338-350 (2012).
- Carson, F. L. . Histotechnology: A Self-Assessment Workbook. , (1996).
- Arcaroli, J. J., et al. Common PIK3CA mutants and a novel 3′ UTR mutation are associated with increased sensitivity to saracatinib. Clin Cancer Res. 18 (9), 2704-2714 (2012).
- Arcaroli, J. J., et al. A NOTCH1 gene copy number gain is a prognostic indicator of worse survival and a predictive biomarker to a Notch1 targeting antibody in colorectal cancer. Int J Cancer. 138 (1), 195-205 (2016).
- Arcaroli, J. J., et al. Gene array and fluorescence in situ hybridization biomarkers of activity of saracatinib (AZD0530), a Src inhibitor, in a preclinical model of colorectal cancer. Clin Cancer Res. 16 (16), 4165-4177 (2010).
- Lieu, C. H., et al. Antitumor activity of a potent MEK inhibitor, TAK-733, against colorectal cancer cell lines and patient derived xenografts. Oncotarget. 6 (33), 34561-34572 (2015).
- Pitts, T. M., et al. Association of the epithelial-to-mesenchymal transition phenotype with responsiveness to the p21-activated kinase inhibitor, PF-3758309, in colon cancer models. Front Pharmacol. 4, 35 (2013).
- Song, E. K., et al. Potent antitumor activity of cabozantinib, a c-MET and VEGFR2 inhibitor, in a colorectal cancer patient-derived tumor explant model. Int J Cancer. 136 (8), 1967-1975 (2015).
- Tentler, J. J., et al. Identification of predictive markers of response to the MEK1/2 inhibitor selumetinib (AZD6244) in K-ras-mutated colorectal cancer. Mol Cancer Ther. 9 (12), 3351-3362 (2010).
- Bardelli, A., et al. Amplification of the MET receptor drives resistance to anti-EGFR therapies in colorectal cancer. Cancer Discov. 3 (6), 658-673 (2013).
- Bertotti, A., et al. A molecularly annotated platform of patient-derived xenografts (“xenopatients”) identifies HER2 as an effective therapeutic target in cetuximab-resistant colorectal cancer. Cancer Discov. 1 (6), 508-523 (2011).
- Davis, S. L., et al. Combined inhibition of MEK and Aurora A kinase in KRAS/PIK3CA double-mutant colorectal cancer models. Front Pharmacol. 6, 120 (2015).
- Morelli, M. P., et al. Preclinical activity of the rational combination of selumetinib (AZD6244) in combination with vorinostat in KRAS-mutant colorectal cancer models. Clin Cancer Res. 18 (4), 1051-1062 (2012).
- Pitts, T. M., et al. Dual pharmacological targeting of the MAP kinase and PI3K/mTOR pathway in preclinical models of colorectal cancer. PLoS One. 9 (11), e113037 (2014).
- Spreafico, A., et al. Rational combination of a MEK inhibitor, selumetinib, and the Wnt/calcium pathway modulator, cyclosporin A, in preclinical models of colorectal cancer. Clin Cancer Res. 19 (15), 4149-4162 (2013).
- Arcaroli, J. J., et al. ALDH+ tumor-initiating cells exhibiting gain in NOTCH1 gene copy number have enhanced regrowth sensitivity to a gamma-secretase inhibitor and irinotecan in colorectal cancer. Mol Oncol. 6 (3), 370-381 (2012).
- Hoey, T., et al. DLL4 blockade inhibits tumor growth and reduces tumor-initiating cell frequency. Cell Stem Cell. 5 (2), 168-177 (2009).
- Ikebuchi, F., et al. Dissociation of c-Met phosphotyrosine sites in human cells in response to mouse hepatocyte growth factor but not human hepatocyte growth factor: the possible roles of different amino acids in different species. Cell Biochem Funct. 31 (4), 298-304 (2013).
- Zhang, Y. W., et al. Enhanced growth of human met-expressing xenografts in a new strain of immunocompromised mice transgenic for human hepatocyte growth factor/scatter factor. Oncogene. 24 (1), 101-106 (2005).

