Entwicklung und Wartung eines Präklinische Patienten gewonnen Tumorxenotransplantates Modell für die Untersuchung von neuartigen Anti-Krebs-Therapien
Summary
Unter Verwendung Patienten stammenden Tumoren in einem subkutanen präklinischen Modell ist eine hervorragende Möglichkeit, die Wirksamkeit neuer Therapien, prädiktive Biomarker Entdeckung und arzneimittelresistente Wege zu untersuchen. Dieses Modell, das in der Arzneimittelentwicklung wesentlich ist, das Schicksal vieler neuartiger Krebstherapien vor der klinischen Untersuchung zu bestimmen.
Abstract
Patient derived tumor xenograft (PDTX) models provide a necessary platform in facilitating anti-cancer drug development prior to human trials. Human tumor pieces are injected subcutaneously into athymic nude mice (immunocompromised, T cell deficient) to create a bank of tumors and subsequently are passaged into different generations of mice in order to maintain these tumors from patients. Importantly, cellular heterogeneity of the original tumor is closely emulated in this model, which provides a more clinically relevant model for evaluation of drug efficacy studies (single agent and combination), biomarker analysis, resistant pathways and cancer stem cell biology. Some limitations of the PDTX model include the replacement of the human stroma with mouse stroma after the first generation in mice, inability to investigate treatment effects on metastasis due to the subcutaneous injections of the tumors, and the lack of evaluation of immunotherapies due to the use of immunocompromised mice. However, even with these limitations, the PDTX model provides a powerful preclinical platform in the drug discovery process.
Introduction
Das kolorektale Karzinom (CRC) ist ein wichtiger Faktor für die Todesfälle durch Krebs in den Vereinigten Staaten. Im Jahr 2015 gab es schätzungsweise 132.700 neue Fälle von CRC mit 49.700 Todesfälle 1. Obwohl die Prognose bei Patienten mit lokalisierter Erkrankung ausgezeichnet ist, Patienten mit fortgeschrittener Erkrankung schlechte Ergebnisse haben, ist dies eine wichtige Priorität in der Entwicklung neuartiger Therapien zu machen. Trotz Standard der Versorgung Chemotherapien und neueren Biologics, die gegen diese Krankheit eingesetzt werden, hat es nur eine inkrementelle Erhöhung des Gesamtüberlebens. Dementsprechend gibt es einen signifikanten Aufwand die Treiber Wege zum Verständnis des Tumorwachstums bei dieser Krankheit zu erleichtern. Cancer Genome Atlas Network hat kürzlich zahlreiche Hauptpfade identifiziert , die in CRC Dysregulation beteiligt sind und umfassen: WNT, Phosphoinositid – 3-Kinase (PI3K), RAS, transformierenden Wachstumsfaktor-β (TGF- β) und TP53 2. Zusammen mit den Untersuchungen beschreibt otihre Wege , die das Wachstum in CRC potenzieren haben die Entwicklung der neueren bei deutlich verbessert das Überleben in dieser Patientenpopulation 3-5 richtet Therapien gezündet. Unter Verwendung präklinischen Modellen in Entwicklung onkologischer Arzneimittel haben in diesem Prozess die klinische Wirksamkeit dieser neuen Verbindungen bei der Vorhersage wesentlich gewesen.
Verschiedene präklinische Modelle wurden in der Arzneimittelentwicklung eingesetzt. Bedenkt man, dass die präklinische transgenen Tiermodellen und wurden Zelllinien bei der Bestimmung der klinischen Aktivität von neuen Krebstherapien erfolglos unsterblich gemacht, vor allem wegen ihrer Unfähigkeit, gegründet, um die Komplexität der menschlichen Tumoren, Patienten stamm Tumorxenotransplantates (PDTX) Modelle wurden zu reflektieren. Der größte Vorteil dieses Modells ist , dass die Tumorheterogenität intakt bleibt und spiegelt genau die molekularen Eigenschaften und der Klonalität des Ursprungspatiententumor 6-9. PDTX Modelle bieten eine ausgezeichnete in vivopräklinische Plattform neue Mittel, Arzneimittelresistenzpfade, kombinatorische Strategien und Krebs Stammzellbiologie 10 zu studieren.
Eine allgemeine Übersicht über die PDTX Verfahren ist in Abbildung 1 veranschaulicht. Es beginnt in der Klinik, zustimmenden Patienten einige ihrer überschüssigen Tumorgewebe zu ermöglichen , für diese Untersuchung verwendet werden. Als nächstes wird bei der Operation wird ein Stück des Tumors durch einen Pathologen und in Medien einspielte zu Forschungspersonal transportiert werden. Unmittelbar danach wird ein Abschnitt des Tumors in kleine Stücke geschnitten und subkutan in immundefiziente Mäuse transplantiert. Sobald der Tumor wächst, wird es in verschiedene Generationen von Mäusen , um agierten den Tumor 10 aufrechtzuerhalten. Typischerweise wird nach dem F3-Generation kann der Tumor in eine Behandlungsstudie erweitert werden, wenn neue Verbindungen und / oder Kombinationstherapien bewertet werden. Unter Verwendung Next Gen Seq (Exome Seq, RNA Seq und SNP-Array) potentielle prädiktive Biomarker zu entdeckened, die bei der Auswahl von Patienten helfen, die Nutzen aus einer bestimmten Behandlung ableiten kann.
Die übergeordneten Ziele der PDTX Modellen sind: 1) Bewertung der Wirksamkeit neuer Therapien als Monotherapie oder in Kombination und 2) identifizieren prädiktive Biomarker der Empfindlichkeit oder Resistenz vor der klinischen Untersuchung. In diesem Manuskript, bieten wir die Methodik bei der Initiierung und Aufrechterhaltung einer Bank CRC PDTX und bieten die Vorteile und Grenzen dieses Modells in der Medikamentenentwicklung Entdeckung.
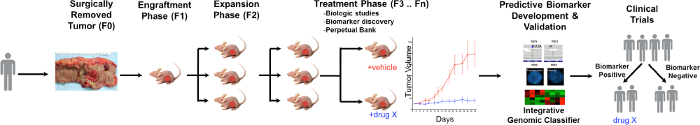
Figure 1. Überblick über das CRC PDTX Modell Protocol. Ein Patient abgeleiteten Tumor wird von der Operation erhalten und sofort in athymischen Nacktmäusen subkutan injiziert. Sobald der Tumor wächst wird es in den nachfolgenden Generationen erweitert und schließlich für Therapiestudien erweitert. Die Behandlung respoNSEs werden bewertet und prädiktive Biomarker identifiziert werden, die in die Auswahl der Patienten helfen können. Bitte klicken Sie hier um eine größere Version dieser Figur zu sehen.
Protocol
Representative Results
Discussion
Die PDTX Drug Discovery-Plattform bietet ein verbessertes Modell auf die Unzulänglichkeiten anderer präklinischen Modellen, die bei der Vorhersage der klinischen Aktivität von neuen Verbindungen unzuverlässig sind. Wichtig ist biologisch stabil sind, Tumoren in diesem Modell behalten metastatischen Potential und zeigen ähnliche Droge Ansprechbarkeit von Generation zu Generation weitergegeben. In diesem Modell Patienten abgeleiteten Tumoren in athymische Nacktmäuse injiziert, passagiert und anschließend in therape…
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was supported by grant 1R01CA152303-01.
Materials
| RPMI or DMEM | Corning | 10-040-CV | |
| Penicillin-Streptomycin | Corning | 30-002-CI | |
| Non-essential Amino Acids | Corning | 25-025-CI | |
| Fetal Bovine Serum | Corning | 35-010-CV | Thaw in -4 °C, then activate for 30 minutes at 60 °C water bath |
| CPT blood tube | BD vacutainer | 362761 | |
| Microcentrifuge tube | Surelock | A-7002 | |
| Phospate-Buffered Saline | Corning | 21-040-CV | |
| Cyrogenic vials | Cyroking | C0732901 | |
| Plastic tumor cutting dish | Trueline | TR4001 | |
| Scissors | Roboz | RS-5881 | |
| Forceps | Roboz | RS-5135 | |
| Matrigel (gelatinous protein mixture) | Corning | 354234 | Store at -20 or -80 °C, then thaw on ice, do not leave at room temperature |
| 10% Formalin cups | Protocol | 032-059 | |
| Liquid Nitrogen Dewar Storage | Thermolyne | CY50900 | |
| Portable liquid nitrogen dewar | Nalgene | 4150-2000 | |
| Dimethyl Sulfoxide | Fischer | 67-68-5 | |
| Freezing container: Mr Frosty | Nalgene | 5100-0001 | |
| Isopropyl Alcohol | Decon | 64-17-5 | |
| Trocars | Innovative Research of America | MP-182 | |
| Anesthesia machine | Patterson Veterinary | none | |
| Anesthesia box | Patterson Veterinary | none | |
| Isoflurane | Vet one | 1038005 | |
| F-Air Canister | Bickford Omnicon | 80120 | |
| Meloxicam | Vet one | 5182-90C | |
| Calipers | Fowler | 54-100-167 | |
| Weight scale | Ohaus | Scout Pro SP601 |
References
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics. 2015. CA Cancer J Clin. 65 (1), 5-29 (2015).
- . Comprehensive molecular characterization of human colon and rectal cancer. Nature. 487 (7407), 330-337 (2012).
- Arcaroli, J. J., et al. Tumours with elevated levels of the Notch and Wnt pathways exhibit efficacy to PF-03084014, a gamma-secretase inhibitor, in a preclinical colorectal explant model. Br J Cancer. 109 (3), 667-675 (2013).
- Hubbard, J., Grothey, A. Antiangiogenesis agents in colorectal cancer. Curr Opin Oncol. 22 (4), 374-380 (2010).
- van Es, J. H., et al. Notch/gamma-secretase inhibition turns proliferative cells in intestinal crypts and adenomas into goblet cells. Nature. 435 (7044), 959-963 (2005).
- Cassidy, J. W., Caldas, C., Bruna, A. Maintaining Tumor Heterogeneity in Patient-Derived Tumor Xenografts. Cancer Res. 75 (15), 2963-2968 (2015).
- Jin, K., et al. Patient-derived human tumour tissue xenografts in immunodeficient mice: a systematic review. Clin Transl Oncol. 12 (7), 473-480 (2010).
- Julien, S., et al. Characterization of a large panel of patient-derived tumor xenografts representing the clinical heterogeneity of human colorectal cancer. Clin Cancer Res. 18 (19), 5314-5328 (2012).
- Siolas, D., Hannon, G. J. Patient-derived tumor xenografts: transforming clinical samples into mouse models. Cancer Res. 73 (17), 5315-5319 (2013).
- Tentler, J. J., et al. Patient-derived tumour xenografts as models for oncology drug development. Nat Rev Clin Oncol. 9 (6), 338-350 (2012).
- Carson, F. L. . Histotechnology: A Self-Assessment Workbook. , (1996).
- Arcaroli, J. J., et al. Common PIK3CA mutants and a novel 3′ UTR mutation are associated with increased sensitivity to saracatinib. Clin Cancer Res. 18 (9), 2704-2714 (2012).
- Arcaroli, J. J., et al. A NOTCH1 gene copy number gain is a prognostic indicator of worse survival and a predictive biomarker to a Notch1 targeting antibody in colorectal cancer. Int J Cancer. 138 (1), 195-205 (2016).
- Arcaroli, J. J., et al. Gene array and fluorescence in situ hybridization biomarkers of activity of saracatinib (AZD0530), a Src inhibitor, in a preclinical model of colorectal cancer. Clin Cancer Res. 16 (16), 4165-4177 (2010).
- Lieu, C. H., et al. Antitumor activity of a potent MEK inhibitor, TAK-733, against colorectal cancer cell lines and patient derived xenografts. Oncotarget. 6 (33), 34561-34572 (2015).
- Pitts, T. M., et al. Association of the epithelial-to-mesenchymal transition phenotype with responsiveness to the p21-activated kinase inhibitor, PF-3758309, in colon cancer models. Front Pharmacol. 4, 35 (2013).
- Song, E. K., et al. Potent antitumor activity of cabozantinib, a c-MET and VEGFR2 inhibitor, in a colorectal cancer patient-derived tumor explant model. Int J Cancer. 136 (8), 1967-1975 (2015).
- Tentler, J. J., et al. Identification of predictive markers of response to the MEK1/2 inhibitor selumetinib (AZD6244) in K-ras-mutated colorectal cancer. Mol Cancer Ther. 9 (12), 3351-3362 (2010).
- Bardelli, A., et al. Amplification of the MET receptor drives resistance to anti-EGFR therapies in colorectal cancer. Cancer Discov. 3 (6), 658-673 (2013).
- Bertotti, A., et al. A molecularly annotated platform of patient-derived xenografts (“xenopatients”) identifies HER2 as an effective therapeutic target in cetuximab-resistant colorectal cancer. Cancer Discov. 1 (6), 508-523 (2011).
- Davis, S. L., et al. Combined inhibition of MEK and Aurora A kinase in KRAS/PIK3CA double-mutant colorectal cancer models. Front Pharmacol. 6, 120 (2015).
- Morelli, M. P., et al. Preclinical activity of the rational combination of selumetinib (AZD6244) in combination with vorinostat in KRAS-mutant colorectal cancer models. Clin Cancer Res. 18 (4), 1051-1062 (2012).
- Pitts, T. M., et al. Dual pharmacological targeting of the MAP kinase and PI3K/mTOR pathway in preclinical models of colorectal cancer. PLoS One. 9 (11), e113037 (2014).
- Spreafico, A., et al. Rational combination of a MEK inhibitor, selumetinib, and the Wnt/calcium pathway modulator, cyclosporin A, in preclinical models of colorectal cancer. Clin Cancer Res. 19 (15), 4149-4162 (2013).
- Arcaroli, J. J., et al. ALDH+ tumor-initiating cells exhibiting gain in NOTCH1 gene copy number have enhanced regrowth sensitivity to a gamma-secretase inhibitor and irinotecan in colorectal cancer. Mol Oncol. 6 (3), 370-381 (2012).
- Hoey, T., et al. DLL4 blockade inhibits tumor growth and reduces tumor-initiating cell frequency. Cell Stem Cell. 5 (2), 168-177 (2009).
- Ikebuchi, F., et al. Dissociation of c-Met phosphotyrosine sites in human cells in response to mouse hepatocyte growth factor but not human hepatocyte growth factor: the possible roles of different amino acids in different species. Cell Biochem Funct. 31 (4), 298-304 (2013).
- Zhang, Y. W., et al. Enhanced growth of human met-expressing xenografts in a new strain of immunocompromised mice transgenic for human hepatocyte growth factor/scatter factor. Oncogene. 24 (1), 101-106 (2005).

