Sviluppo e manutenzione di un tumore del paziente preclinici Derivato dello xenotrapianto modello per il Controllo delle Novel Anti-Cancer Therapies
Summary
Utilizzando i tumori derivati da pazienti in un modello preclinico per via sottocutanea è un ottimo modo per studiare l'efficacia di nuove terapie, scoperta di biomarcatori predittivi, e percorsi resistenti ai farmaci. Questo modello, nel processo di sviluppo di un farmaco, è essenziale nel determinare il destino di molte nuove terapie anti-cancro prima indagine clinica.
Abstract
Patient derived tumor xenograft (PDTX) models provide a necessary platform in facilitating anti-cancer drug development prior to human trials. Human tumor pieces are injected subcutaneously into athymic nude mice (immunocompromised, T cell deficient) to create a bank of tumors and subsequently are passaged into different generations of mice in order to maintain these tumors from patients. Importantly, cellular heterogeneity of the original tumor is closely emulated in this model, which provides a more clinically relevant model for evaluation of drug efficacy studies (single agent and combination), biomarker analysis, resistant pathways and cancer stem cell biology. Some limitations of the PDTX model include the replacement of the human stroma with mouse stroma after the first generation in mice, inability to investigate treatment effects on metastasis due to the subcutaneous injections of the tumors, and the lack of evaluation of immunotherapies due to the use of immunocompromised mice. However, even with these limitations, the PDTX model provides a powerful preclinical platform in the drug discovery process.
Introduction
Il cancro colorettale (CRC) è un contributo significativo ai decessi per cancro negli Stati Uniti. Nel 2015, sono stati stimati 132.700 nuovi casi di CRC con 49,700 morti 1. Anche se la prognosi nei pazienti con malattia localizzata è eccellente, i pazienti con malattia avanzata hanno scarsi risultati, rendendo questo una delle principali priorità nello sviluppo di nuove terapie. Nonostante livello di regimi di cura chemioterapici e biologici più recenti che vengono distribuite contro questa malattia, c'è stato solo un aumento incrementale della sopravvivenza globale. Di conseguenza, vi è un notevole sforzo nella comprensione delle vie pilota coinvolto nel facilitare la crescita tumorale in questa malattia. L'Atlante rete Cancer Genome ha recentemente identificato numerosi sentieri principali che sono implicati nella disregolazione CRC e comprendono: WNT, phosphoinositide 3-chinasi (PI3K), RAS, fattore di crescita trasformante-β (TGF-β) e TP53 2. Insieme, con le indagini che descrivono oti suoi percorsi che potenziano la crescita in CRC hanno acceso lo sviluppo di nuove terapie volte a migliorare in modo significativo la sopravvivenza in questa popolazione di pazienti 3-5. Utilizzando modelli preclinici di sviluppo di farmaci oncologici sono stati fondamentali in questo processo nel predire l'attività clinica di questi nuovi composti.
Vari modelli preclinici sono stati utilizzati nel processo di sviluppo dei farmaci. Considerando che i modelli animali transgenici preclinici e immortalati linee cellulari non hanno avuto successo nel determinare l'attività clinica di nuove terapie oncologiche, in gran parte a causa della loro incapacità di riflettere la complessità dei tumori umani, sono stati stabiliti i modelli paziente di derivazione tumorale xenotrapianto (PDTX). Il grande vantaggio di questo modello è che l'eterogeneità del tumore rimane intatto e rispecchia da vicino le caratteristiche molecolari e clonalità della originario del tumore del paziente 6-9. Modelli PDTX forniscono un eccellente in vivopiattaforma preclinico per studiare nuovi agenti, percorsi di resistenza ai farmaci, strategie combinatori e biologia delle cellule staminali del cancro 10.
Una panoramica generale del processo PDTX è illustrato in Figura 1. Inizia nella clinica, pazienti consenzienti permettere alcune loro tessuto tumorale in eccesso da utilizzare per questa ricerca. Poi, a un intervento chirurgico, un pezzo del tumore viene incassato da un patologo e messo in media per essere trasportati al personale di ricerca. Subito dopo, una sezione del tumore viene tagliato in piccoli pezzi e trapiantato in topi immunodeficienti sottocutanea. Una volta che il tumore cresce, si diversi passaggi in diverse generazioni di topi per mantenere il tumore 10. Tipicamente, dopo la generazione F3 il tumore può essere espansa in uno studio di trattamento in cui vengono valutate nuovi composti e / o terapie combinatorie. Utilizzando Next Gen Seq (exome Seq, RNA-Seq e SNP array) potenziali biomarcatori predittivi sono scoprireEd che assistono nella selezione dei pazienti che possono trarre benefici da un particolare trattamento.
Gli obiettivi generali di utilizzo di modelli PDTX sono: 1) valutare l'efficacia di nuove terapie come monoterapia o in combinazione e 2) identificare biomarcatori predittivi di sensibilità o di resistenza prima indagine clinica. In questo manoscritto, mettiamo a disposizione la metodologia l'avvio e il mantenimento di una banca CRC PDTX e fornire i vantaggi ei limiti di questo modello nella scoperta lo sviluppo di farmaci.
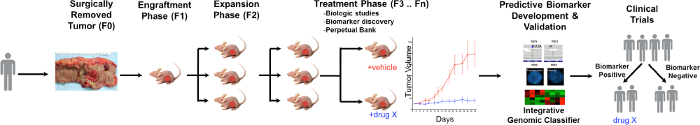
Figura 1. Panoramica del CRC PDTX modello di protocollo. Un tumore derivato paziente viene ricevuto da un intervento chirurgico e subito iniettato in topi nudi atimici per via sottocutanea. Una volta che il tumore cresce si espande in generazioni successive e, infine, ampliato per studi di trattamento. RESPO trattamentons vengono valutati e biomarcatori predittivi vengono identificati che possono aiutare nella selezione dei pazienti. Cliccate qui per vedere una versione più grande di questa figura.
Protocol
Representative Results
Discussion
La piattaforma di scoperta di nuovi farmaci PDTX offre un modello migliorato per le carenze di altri modelli preclinici che sono inaffidabili nel predire attività clinica di nuovi composti. È importante sottolineare che i tumori in questo modello sono biologicamente stabile, mantenere potenziale metastatico, e mostrano simili reattività di droga di generazione in generazione. In questo modello, i tumori paziente derivato vengono iniettate in topi nudi atimici, diversi passaggi, e successivamente utilizzati nella valu…
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was supported by grant 1R01CA152303-01.
Materials
| RPMI or DMEM | Corning | 10-040-CV | |
| Penicillin-Streptomycin | Corning | 30-002-CI | |
| Non-essential Amino Acids | Corning | 25-025-CI | |
| Fetal Bovine Serum | Corning | 35-010-CV | Thaw in -4 °C, then activate for 30 minutes at 60 °C water bath |
| CPT blood tube | BD vacutainer | 362761 | |
| Microcentrifuge tube | Surelock | A-7002 | |
| Phospate-Buffered Saline | Corning | 21-040-CV | |
| Cyrogenic vials | Cyroking | C0732901 | |
| Plastic tumor cutting dish | Trueline | TR4001 | |
| Scissors | Roboz | RS-5881 | |
| Forceps | Roboz | RS-5135 | |
| Matrigel (gelatinous protein mixture) | Corning | 354234 | Store at -20 or -80 °C, then thaw on ice, do not leave at room temperature |
| 10% Formalin cups | Protocol | 032-059 | |
| Liquid Nitrogen Dewar Storage | Thermolyne | CY50900 | |
| Portable liquid nitrogen dewar | Nalgene | 4150-2000 | |
| Dimethyl Sulfoxide | Fischer | 67-68-5 | |
| Freezing container: Mr Frosty | Nalgene | 5100-0001 | |
| Isopropyl Alcohol | Decon | 64-17-5 | |
| Trocars | Innovative Research of America | MP-182 | |
| Anesthesia machine | Patterson Veterinary | none | |
| Anesthesia box | Patterson Veterinary | none | |
| Isoflurane | Vet one | 1038005 | |
| F-Air Canister | Bickford Omnicon | 80120 | |
| Meloxicam | Vet one | 5182-90C | |
| Calipers | Fowler | 54-100-167 | |
| Weight scale | Ohaus | Scout Pro SP601 |
References
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics. 2015. CA Cancer J Clin. 65 (1), 5-29 (2015).
- . Comprehensive molecular characterization of human colon and rectal cancer. Nature. 487 (7407), 330-337 (2012).
- Arcaroli, J. J., et al. Tumours with elevated levels of the Notch and Wnt pathways exhibit efficacy to PF-03084014, a gamma-secretase inhibitor, in a preclinical colorectal explant model. Br J Cancer. 109 (3), 667-675 (2013).
- Hubbard, J., Grothey, A. Antiangiogenesis agents in colorectal cancer. Curr Opin Oncol. 22 (4), 374-380 (2010).
- van Es, J. H., et al. Notch/gamma-secretase inhibition turns proliferative cells in intestinal crypts and adenomas into goblet cells. Nature. 435 (7044), 959-963 (2005).
- Cassidy, J. W., Caldas, C., Bruna, A. Maintaining Tumor Heterogeneity in Patient-Derived Tumor Xenografts. Cancer Res. 75 (15), 2963-2968 (2015).
- Jin, K., et al. Patient-derived human tumour tissue xenografts in immunodeficient mice: a systematic review. Clin Transl Oncol. 12 (7), 473-480 (2010).
- Julien, S., et al. Characterization of a large panel of patient-derived tumor xenografts representing the clinical heterogeneity of human colorectal cancer. Clin Cancer Res. 18 (19), 5314-5328 (2012).
- Siolas, D., Hannon, G. J. Patient-derived tumor xenografts: transforming clinical samples into mouse models. Cancer Res. 73 (17), 5315-5319 (2013).
- Tentler, J. J., et al. Patient-derived tumour xenografts as models for oncology drug development. Nat Rev Clin Oncol. 9 (6), 338-350 (2012).
- Carson, F. L. . Histotechnology: A Self-Assessment Workbook. , (1996).
- Arcaroli, J. J., et al. Common PIK3CA mutants and a novel 3′ UTR mutation are associated with increased sensitivity to saracatinib. Clin Cancer Res. 18 (9), 2704-2714 (2012).
- Arcaroli, J. J., et al. A NOTCH1 gene copy number gain is a prognostic indicator of worse survival and a predictive biomarker to a Notch1 targeting antibody in colorectal cancer. Int J Cancer. 138 (1), 195-205 (2016).
- Arcaroli, J. J., et al. Gene array and fluorescence in situ hybridization biomarkers of activity of saracatinib (AZD0530), a Src inhibitor, in a preclinical model of colorectal cancer. Clin Cancer Res. 16 (16), 4165-4177 (2010).
- Lieu, C. H., et al. Antitumor activity of a potent MEK inhibitor, TAK-733, against colorectal cancer cell lines and patient derived xenografts. Oncotarget. 6 (33), 34561-34572 (2015).
- Pitts, T. M., et al. Association of the epithelial-to-mesenchymal transition phenotype with responsiveness to the p21-activated kinase inhibitor, PF-3758309, in colon cancer models. Front Pharmacol. 4, 35 (2013).
- Song, E. K., et al. Potent antitumor activity of cabozantinib, a c-MET and VEGFR2 inhibitor, in a colorectal cancer patient-derived tumor explant model. Int J Cancer. 136 (8), 1967-1975 (2015).
- Tentler, J. J., et al. Identification of predictive markers of response to the MEK1/2 inhibitor selumetinib (AZD6244) in K-ras-mutated colorectal cancer. Mol Cancer Ther. 9 (12), 3351-3362 (2010).
- Bardelli, A., et al. Amplification of the MET receptor drives resistance to anti-EGFR therapies in colorectal cancer. Cancer Discov. 3 (6), 658-673 (2013).
- Bertotti, A., et al. A molecularly annotated platform of patient-derived xenografts (“xenopatients”) identifies HER2 as an effective therapeutic target in cetuximab-resistant colorectal cancer. Cancer Discov. 1 (6), 508-523 (2011).
- Davis, S. L., et al. Combined inhibition of MEK and Aurora A kinase in KRAS/PIK3CA double-mutant colorectal cancer models. Front Pharmacol. 6, 120 (2015).
- Morelli, M. P., et al. Preclinical activity of the rational combination of selumetinib (AZD6244) in combination with vorinostat in KRAS-mutant colorectal cancer models. Clin Cancer Res. 18 (4), 1051-1062 (2012).
- Pitts, T. M., et al. Dual pharmacological targeting of the MAP kinase and PI3K/mTOR pathway in preclinical models of colorectal cancer. PLoS One. 9 (11), e113037 (2014).
- Spreafico, A., et al. Rational combination of a MEK inhibitor, selumetinib, and the Wnt/calcium pathway modulator, cyclosporin A, in preclinical models of colorectal cancer. Clin Cancer Res. 19 (15), 4149-4162 (2013).
- Arcaroli, J. J., et al. ALDH+ tumor-initiating cells exhibiting gain in NOTCH1 gene copy number have enhanced regrowth sensitivity to a gamma-secretase inhibitor and irinotecan in colorectal cancer. Mol Oncol. 6 (3), 370-381 (2012).
- Hoey, T., et al. DLL4 blockade inhibits tumor growth and reduces tumor-initiating cell frequency. Cell Stem Cell. 5 (2), 168-177 (2009).
- Ikebuchi, F., et al. Dissociation of c-Met phosphotyrosine sites in human cells in response to mouse hepatocyte growth factor but not human hepatocyte growth factor: the possible roles of different amino acids in different species. Cell Biochem Funct. 31 (4), 298-304 (2013).
- Zhang, Y. W., et al. Enhanced growth of human met-expressing xenografts in a new strain of immunocompromised mice transgenic for human hepatocyte growth factor/scatter factor. Oncogene. 24 (1), 101-106 (2005).

