Udvikling og vedligeholdelse af et præklinisk Patient Afledt Tumor xenograftmodel for undersøgelse af Novel Anti-Cancer Therapies
Summary
Ved hjælp patient-afledte tumorer i en subkutan præklinisk model er en glimrende måde at studere effekten af nye behandlingsformer, prædiktiv biomarkør opdagelse og lægemiddelresistente veje. Denne model, i udviklingsprocessen narkotika, er afgørende for at bestemme skæbnen for mange nye anti-cancer behandlinger forud for klinisk undersøgelse.
Abstract
Patient derived tumor xenograft (PDTX) models provide a necessary platform in facilitating anti-cancer drug development prior to human trials. Human tumor pieces are injected subcutaneously into athymic nude mice (immunocompromised, T cell deficient) to create a bank of tumors and subsequently are passaged into different generations of mice in order to maintain these tumors from patients. Importantly, cellular heterogeneity of the original tumor is closely emulated in this model, which provides a more clinically relevant model for evaluation of drug efficacy studies (single agent and combination), biomarker analysis, resistant pathways and cancer stem cell biology. Some limitations of the PDTX model include the replacement of the human stroma with mouse stroma after the first generation in mice, inability to investigate treatment effects on metastasis due to the subcutaneous injections of the tumors, and the lack of evaluation of immunotherapies due to the use of immunocompromised mice. However, even with these limitations, the PDTX model provides a powerful preclinical platform in the drug discovery process.
Introduction
Kolorektal cancer (CRC) er en væsentlig bidragyder til kræftdødsfald i USA. I 2015 var der en anslået 132,700 nye tilfælde af CRC med 49,700 dødsfald 1. Selvom prognosen hos patienter med lokaliseret sygdom er fremragende, patienter med fremskreden sygdom har dårlige resultater, hvilket gør dette til en vigtig prioritet i udviklingen af nye terapier. Trods standard for pleje kemoterapeutiske regimer og nyere biologiske, der er indsat mod denne sygdom, har der kun været en trinvis stigning i den samlede overlevelse. Følgelig er der en betydelig indsats for at forstå føreren involverede veje lette tumorvækst i denne sygdom. Den Cancer Genome Atlas Network har for nylig identificeret en lang række store veje, der er impliceret i CRC dysregulering og omfatter: WNT, phosphoinositid 3-kinase (PI3K), RAS, transformerende vækstfaktor-β (TGF β) og TP53 2. Sammen med undersøgelser, der beskriver othendes veje, der forstærker vækst i CRC har antændt udviklingen af nyere terapier for markant at øge overlevelsen i denne patientpopulation 3-5. Ved hjælp prækliniske modeller i onkologi lægemiddeludvikling har været afgørende i denne proces til at forudsige den kliniske aktivitet af disse nye forbindelser.
Forskellige prækliniske modeller er blevet anvendt i udvikling af nye lægemidler. I betragtning af at prækliniske transgene dyremodeller og udødeliggjort cellelinjer har fået medhold i at bestemme den kliniske aktivitet af nye onkologiske behandlinger, hovedsagelig på grund af deres manglende evne til at afspejle kompleksiteten af humane tumorer, er der etableret patient-afledt tumor xenograft (PDTX) modeller. Den største fordel ved denne model er, at tumor heterogenitet forbliver intakt og afspejler nøje de molekylære karakteristika og klonalitet af oprindelse patientens tumor 6-9. PDTX modeller giver en fremragende in vivopræklinisk platform til at studere nye agenter, lægemiddelresistens veje, kombinatoriske strategier og kræft stamcellebiologi 10.
En generel oversigt over PDTX er illustreret i figur 1. Den begynder i klinikken, samtykke patienter til at tillade nogle af deres overskydende tumorvæv, der skal anvendes til denne forskning. Dernæst ved kirurgi, er et stykke af tumoren indtjente af en patolog og sat i medier, der skal transporteres til forskning personale. Umiddelbart efter denne, er et snit af tumoren skåret i små stykker og transplanteres ind immunsvækkede mus subkutant. Når tumoren vokser, er det passeret i forskellige generationer af mus for at opretholde tumoren 10. Typisk efter F3 generation tumoren kan udvides til en behandling studie, hvor hidtil ukendte forbindelser og / eller kombinatoriske terapier evalueres. Ved hjælp Next Gen Seq (Exome Seq, RNA Seq og SNP-array) potentielle prædiktive biomarkører er opdageed at hjælpe med udvælgelsen af patienter, der kan drage fordel af en særlig behandling.
De overordnede mål med at bruge PDTX modeller er til: 1) evaluere effekten af nye behandlingsformer som enkeltstof eller i kombination, og 2) at identificere prædiktive biomarkører for følsomhed eller resistens forud for klinisk undersøgelse. I dette manuskript, giver vi den metode i initiering og vedligeholdelse af et CRC PDTX bank og give fordele og begrænsninger af denne model i udvikling lægemiddelforskning.
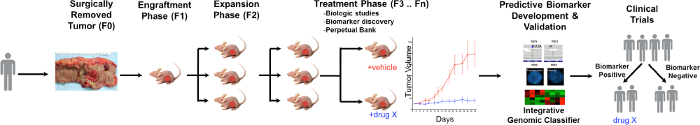
Figur 1. Oversigt over CRC PDTX Model protokol. En patient afledt tumor modtages fra kirurgi og straks injiceret i athymiske nøgne mus subkutant. Når tumoren vokser det udvidet til efterfølgende generationer og til sidst udvidet til behandling studier. Behandling RespoNSES vurderes og prædiktive biomarkører er identificeret, som kan hjælpe i patientudvælgelse. Klik her for at se en større version af dette tal.
Protocol
Representative Results
Discussion
Den PDTX lægemiddelforskning platform giver en forbedret model til manglerne i andre prækliniske modeller, der er upålidelige forudsige klinisk aktivitet af nye forbindelser. Vigtigt er det, tumorer i denne model er biologisk stabile, bevarer metastatisk potentiale, og udviser lignende stof lydhørhed fra generation til generation. I denne model er patientens afledte tumorer injiceres i athymiske nøgne mus, passeret, og efterfølgende anvendes i terapeutisk vurdering. Der er flere kritiske trin til en vellykket PDTX…
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was supported by grant 1R01CA152303-01.
Materials
| RPMI or DMEM | Corning | 10-040-CV | |
| Penicillin-Streptomycin | Corning | 30-002-CI | |
| Non-essential Amino Acids | Corning | 25-025-CI | |
| Fetal Bovine Serum | Corning | 35-010-CV | Thaw in -4 °C, then activate for 30 minutes at 60 °C water bath |
| CPT blood tube | BD vacutainer | 362761 | |
| Microcentrifuge tube | Surelock | A-7002 | |
| Phospate-Buffered Saline | Corning | 21-040-CV | |
| Cyrogenic vials | Cyroking | C0732901 | |
| Plastic tumor cutting dish | Trueline | TR4001 | |
| Scissors | Roboz | RS-5881 | |
| Forceps | Roboz | RS-5135 | |
| Matrigel (gelatinous protein mixture) | Corning | 354234 | Store at -20 or -80 °C, then thaw on ice, do not leave at room temperature |
| 10% Formalin cups | Protocol | 032-059 | |
| Liquid Nitrogen Dewar Storage | Thermolyne | CY50900 | |
| Portable liquid nitrogen dewar | Nalgene | 4150-2000 | |
| Dimethyl Sulfoxide | Fischer | 67-68-5 | |
| Freezing container: Mr Frosty | Nalgene | 5100-0001 | |
| Isopropyl Alcohol | Decon | 64-17-5 | |
| Trocars | Innovative Research of America | MP-182 | |
| Anesthesia machine | Patterson Veterinary | none | |
| Anesthesia box | Patterson Veterinary | none | |
| Isoflurane | Vet one | 1038005 | |
| F-Air Canister | Bickford Omnicon | 80120 | |
| Meloxicam | Vet one | 5182-90C | |
| Calipers | Fowler | 54-100-167 | |
| Weight scale | Ohaus | Scout Pro SP601 |
References
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics. 2015. CA Cancer J Clin. 65 (1), 5-29 (2015).
- . Comprehensive molecular characterization of human colon and rectal cancer. Nature. 487 (7407), 330-337 (2012).
- Arcaroli, J. J., et al. Tumours with elevated levels of the Notch and Wnt pathways exhibit efficacy to PF-03084014, a gamma-secretase inhibitor, in a preclinical colorectal explant model. Br J Cancer. 109 (3), 667-675 (2013).
- Hubbard, J., Grothey, A. Antiangiogenesis agents in colorectal cancer. Curr Opin Oncol. 22 (4), 374-380 (2010).
- van Es, J. H., et al. Notch/gamma-secretase inhibition turns proliferative cells in intestinal crypts and adenomas into goblet cells. Nature. 435 (7044), 959-963 (2005).
- Cassidy, J. W., Caldas, C., Bruna, A. Maintaining Tumor Heterogeneity in Patient-Derived Tumor Xenografts. Cancer Res. 75 (15), 2963-2968 (2015).
- Jin, K., et al. Patient-derived human tumour tissue xenografts in immunodeficient mice: a systematic review. Clin Transl Oncol. 12 (7), 473-480 (2010).
- Julien, S., et al. Characterization of a large panel of patient-derived tumor xenografts representing the clinical heterogeneity of human colorectal cancer. Clin Cancer Res. 18 (19), 5314-5328 (2012).
- Siolas, D., Hannon, G. J. Patient-derived tumor xenografts: transforming clinical samples into mouse models. Cancer Res. 73 (17), 5315-5319 (2013).
- Tentler, J. J., et al. Patient-derived tumour xenografts as models for oncology drug development. Nat Rev Clin Oncol. 9 (6), 338-350 (2012).
- Carson, F. L. . Histotechnology: A Self-Assessment Workbook. , (1996).
- Arcaroli, J. J., et al. Common PIK3CA mutants and a novel 3′ UTR mutation are associated with increased sensitivity to saracatinib. Clin Cancer Res. 18 (9), 2704-2714 (2012).
- Arcaroli, J. J., et al. A NOTCH1 gene copy number gain is a prognostic indicator of worse survival and a predictive biomarker to a Notch1 targeting antibody in colorectal cancer. Int J Cancer. 138 (1), 195-205 (2016).
- Arcaroli, J. J., et al. Gene array and fluorescence in situ hybridization biomarkers of activity of saracatinib (AZD0530), a Src inhibitor, in a preclinical model of colorectal cancer. Clin Cancer Res. 16 (16), 4165-4177 (2010).
- Lieu, C. H., et al. Antitumor activity of a potent MEK inhibitor, TAK-733, against colorectal cancer cell lines and patient derived xenografts. Oncotarget. 6 (33), 34561-34572 (2015).
- Pitts, T. M., et al. Association of the epithelial-to-mesenchymal transition phenotype with responsiveness to the p21-activated kinase inhibitor, PF-3758309, in colon cancer models. Front Pharmacol. 4, 35 (2013).
- Song, E. K., et al. Potent antitumor activity of cabozantinib, a c-MET and VEGFR2 inhibitor, in a colorectal cancer patient-derived tumor explant model. Int J Cancer. 136 (8), 1967-1975 (2015).
- Tentler, J. J., et al. Identification of predictive markers of response to the MEK1/2 inhibitor selumetinib (AZD6244) in K-ras-mutated colorectal cancer. Mol Cancer Ther. 9 (12), 3351-3362 (2010).
- Bardelli, A., et al. Amplification of the MET receptor drives resistance to anti-EGFR therapies in colorectal cancer. Cancer Discov. 3 (6), 658-673 (2013).
- Bertotti, A., et al. A molecularly annotated platform of patient-derived xenografts (“xenopatients”) identifies HER2 as an effective therapeutic target in cetuximab-resistant colorectal cancer. Cancer Discov. 1 (6), 508-523 (2011).
- Davis, S. L., et al. Combined inhibition of MEK and Aurora A kinase in KRAS/PIK3CA double-mutant colorectal cancer models. Front Pharmacol. 6, 120 (2015).
- Morelli, M. P., et al. Preclinical activity of the rational combination of selumetinib (AZD6244) in combination with vorinostat in KRAS-mutant colorectal cancer models. Clin Cancer Res. 18 (4), 1051-1062 (2012).
- Pitts, T. M., et al. Dual pharmacological targeting of the MAP kinase and PI3K/mTOR pathway in preclinical models of colorectal cancer. PLoS One. 9 (11), e113037 (2014).
- Spreafico, A., et al. Rational combination of a MEK inhibitor, selumetinib, and the Wnt/calcium pathway modulator, cyclosporin A, in preclinical models of colorectal cancer. Clin Cancer Res. 19 (15), 4149-4162 (2013).
- Arcaroli, J. J., et al. ALDH+ tumor-initiating cells exhibiting gain in NOTCH1 gene copy number have enhanced regrowth sensitivity to a gamma-secretase inhibitor and irinotecan in colorectal cancer. Mol Oncol. 6 (3), 370-381 (2012).
- Hoey, T., et al. DLL4 blockade inhibits tumor growth and reduces tumor-initiating cell frequency. Cell Stem Cell. 5 (2), 168-177 (2009).
- Ikebuchi, F., et al. Dissociation of c-Met phosphotyrosine sites in human cells in response to mouse hepatocyte growth factor but not human hepatocyte growth factor: the possible roles of different amino acids in different species. Cell Biochem Funct. 31 (4), 298-304 (2013).
- Zhang, Y. W., et al. Enhanced growth of human met-expressing xenografts in a new strain of immunocompromised mice transgenic for human hepatocyte growth factor/scatter factor. Oncogene. 24 (1), 101-106 (2005).

