단일 세포 수준에서 캐비테이션 버블 (들) -cell 상호 작용 및 결과 Bioeffects을 조사하기위한 표면 패터닝와 마이크로 유체 시스템
Summary
A microfluidic chip was fabricated to produce pairs of gold dots for tandem bubble generation and fibronectin-coated islands for single-cell patterning nearby. The resultant flow field was characterized by particle image velocimetry and was employed to study various bioeffects, including cell membrane poration, membrane deformation, and intracellular calcium response.
Abstract
이 논문에서는 먼저 정확하게 탠덤 거품 잘 정의 된 위치 및 형상에 가까운 패턴 개별 세포의 생성을 제어하는 동일한 유리 기판 상에 금 도트 피브로넥틴 – 코팅 영역으로, 미세 유체 칩의 제작 프로토콜을 설명한다. 그런 다음 몇 마이크로 초 시간 지연 골드 도트 쌍 조명 개의 펄스 레이저를 이용하여 탠덤 기포의 생성을 보여준다. 우리는 고속 촬상하여 버블 버블 제트 상호 작용 형성을 시각화 입자 화상 속도계 (PIV)를 사용하여 생성 된 유동장의 특성. 마지막으로, 우리는 고분자 흡수와 세포막의 poration, 부착 인테그린 결합 구슬의 변위에 의해 결정 지역화 막 변형 및 비율 적 영상에서 세포 내 칼슘 응답을 포함하여 단일 세포 분석,이 기술의 일부 응용 프로그램을 제시한다. 우리의 결과는 빠르고 방향 분사 흐름이 프로임을 보여근접 성장한 세포의 표면에서 매우 국부적 전단 응력을 부과 할 수있는 탠덤 기포 작용에 의해 선보였. 또 다른 bioeffects는 탠덤 기포 셀의 유격 거리를 조정함으로써 분사 흐름의 강도를 변화시킴으로써 유도 될 수있다.
Introduction
휴대 이질성이, 유전자, 단백질 및 대사 산물의 확률 적 표현에서 발생하는 큰 세포 집단 내에 존재하는 세포의 적응과 진화 한 수 있도록 생물학의 기본 원리 역할을하는 성장 인식이 있습니다. 따라서, 개별 셀들은 상호 작용의 기능을 이해하는 인구 기반 벌크 측정을 사용하는 정확하고 신뢰할 수 없다. 단일 세포 분석을위한 새로운 기술을 개발하는 것은 따라서 생물학적 및 약리학 적 연구에서 높은 관심, 그리고 더 줄기 세포 생물학 및 암 치료 2-4의 주요 신호 전달 경로 및 과정을 이해하는데 사용될 수있다. 최근, 미세 유체 플랫폼의 등장은 크게 각 셀의 응답의 위치 설정, 처리, 및 관찰 신규 분석 전략 5 수행 된 단일 세포 분석을 용이하게하고있다.
캐비테이션 고강도 의한 암의 치료를 비롯한 생물 의학적 응용의 다양한 범위에 중요한 역할 초음파 (HIFU) 6- 집중 연극 충격파 쇄석술 의한 신장 결석의 비 침습적 단편화 (SWL) (7) 약물 또는 유전자 전달 sonoporation 8 및 유체 역학적 거품 캐비테이션 (9, 10)에 의해 세포 나 조직의 최근보고 된 파괴에 의해. 그럼에도 불구하고, 캐비테이션 버블 (들) 생체 조직과 세포와의 상호 작용의 동적 프로세스는 잘 이해되지 않았다. 이 초음파, 충격파, 지역 유압에 의해 생성 된 캐비테이션 개시 및 거품 역학의 임의성 때문이다; 또한, 특히, 단일 세포 수준에서 생체 세포의 본질적으로 복잡하고 빠르게 응답을 해결하는 기술을 가능하게 부족하다.
이러한 문제의, 그것은 놀라운 일이 아니다 때문에 거의 연구는 꿀벌을 가지고N은 잘 조절 된 실험 조건 하에서 버블 – 세포 상호 작용을 조사하는 것으로보고. 예를 들어, 각각의 세포의 세포막의 poration 서스펜션 (11)에 포획 및 인간 적혈구 (12)의 임펄스 큰 변형이 미세 채널에서 발생 된 레이저 단일 기포를 이용하여 입증되었다. 후자의 기술은, 그러나, 인해 핵 (13)의 존재에 진핵 세포에서 매우 작은 변형을 생성 할 수있다. 또한, 세포 현탁액을 처리 할 때 하류 bioeffects을 모니터하기가 어렵다. 다른 연구에서, 단일 부착 세포에서 세포막의 poration 및 / 또는 세포 칼슘 응답을 생성하는 세포 – 결합 된 미세 기포 (또는 초음파 조영제) 초음파 자극은 8보고되었다. 단일 부착 세포의 멤브레인의 poration 또한 광 흡수 트리 판 블루 용액 (14)을 포함하는 얇은 액체 층에 레이저 발생 탠덤 거품을 사용하여 제조하거나 할 수있다microchambers 15 광학적 흡수 기판을 통해 조사 마이크로 레이저 펄스에 의해 발생 된 진동에 의한 기포. 비교하면, 후자는 세포에 독성이기 때문에, 광 흡수 기판을 레이저 흡수 트리 판 블루 용액에 비해 이점을 갖는다. 더 중요한 것은, 레이저 발생하는 기포는 음향 여기 기포보다 거품의 크기 및 위치의 관점에서 더 많은 제어 가능하다. 그럼에도 불구하고, 모든 이전의 연구에서, 셀 형상, 방향, 접착 조건은 실질적으로 세포 반응 및 기계적 응력 (16)에 의해 생성 bioeffects 영향을 미칠 수있는 조절되지 않았다.
이전 연구에서의 이러한 단점을 극복하기 위해 최근 버블 발생 세포 패터닝 버블 버블 – 세포 상호 작용 및 실시간 미세 TECHN의 독특한 조합을 이용하여 구성되는 마이크로 유체 칩 내의 세포 반응의 생물 검정을위한 실험 시스템을 개발iques. 분야의 다른 사람들로부터 우리 실험 시스템을 구별 세 가지 특징은 1) 유리 기판 상에 마이크론 크기의 금 도트 패턴은 버블 발생 17 지역화 레이저 흡수성을 활성화하는 단계; 2) 동일한 기판 상에 세포 접착 세포 외 기질 (ECM)의 마이크론 크기의 아일랜드의 패터닝 위치 및 각 셀의 구조 모두를 제어하는 단계; 3) 준 2 차원 공간에 3 차원의 기포 거품 세포 상호 작용 도메인의 치수의 압축은 모든 캡처, 유동장, 셀의 변형, 및 bioeffects 분사 거품 기포 상호 작용의 면내 시각화를 용이하게 하나의 간소화 된 영상 시퀀스 (그림 1D).
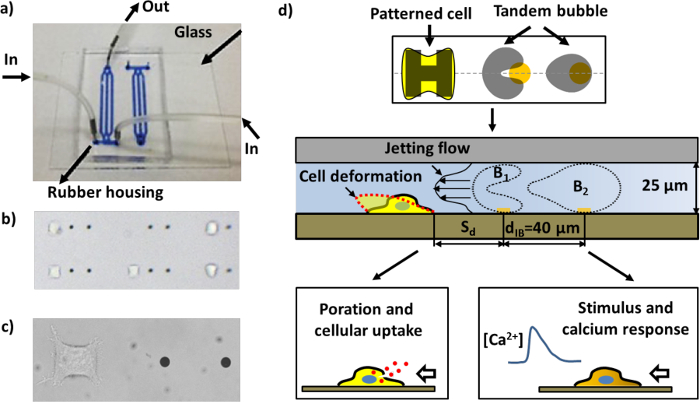
그림 1 : 미세 유체 칩과 다른 분석의 개략도. 가) 채널을 가진 조립 된 미세 유체 칩은 파란색 잉크로 가득 시각화를위한. b)는 패턴 세포와 골드 점 마이크로 유체 칩 내부 영역은 (근접에있는 두 개의 골드 점 사이의 거리)는 40 μm의입니다. 작업 단위의 다수 쌍의 채널에 배치 될 수있다. 금 도트 한 쌍의 셀 패터닝 영역에 부착 된 헬라 세포로 이루어진 단일 작업 단위의 c) 이미지. 디바이스 동작의 d) 회로도. 하나의 셀을 준수하고 피브로넥틴로 코팅 된 "H"모양의 섬에 펼쳐집니다. 역상 진동으로 캐비테이션 기포 (탠덤 기포)의 쌍은 주변 타겟 셀을 향해 이동 빠르고 국소 젯의 생성을 선도 (도 4a 참조)을 금 도트에 펄스 레이저 빔을 조사함으로써 생성된다. 세포는 변형 고분자 흡수위한 porated 및 / 또는 직렬 기포 셀의 이격 거리 (S의 d)에 따라, 칼슘 응답을 자극 할 수있다.F = "http://ecsource.jove.com/files/ftp_upload/55106/55106fig1large.jpg"대상 = "_ 빈">이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
이 플랫폼은 또한 형광 분석법 캐비테이션 유도 bioeffects 대한 세포 표면에 부착 된 기능화 된 비드와 결합 될 수있다. 특히,이 플랫폼은 단일 세포 수준에서 신뢰성 및 정량 분석을위한 방법을 연다. 지금까지, 우리는 직렬 버블 의한 세포막 변형 셀의 poration 세포 내 흡수, 생존, 세포 사멸, 세포 내 칼슘 응답의 분석 장치를 사용했다. 다음의 프로토콜에서는, 칩 제조 공정과 상술 한 각종 bioeffects을 분석하는 과정을 설명한다. 또한, 칩의 동작은 설명한다.
Protocol
Representative Results
Discussion
단일 세포 분석은 살아있는 세포 영상과 함께 크게 같은 표현형 개발 및 면역 반응 (23)과 같은 개별 셀에서 동적 종종 가변 과정에 대한 이해를 강화하고있다. 접시 또는 플라스크 종래 세포 배양액과 대조적으로, 미세 유체 시스템은 실시간으로 다운 단일 세포 수준으로 미세의 정확한 제어를 활성화. 따라서, 미세 유체 기술의 진보 및 기술은 대부분 단일 셀 분석 처리량 및 재현성을 향?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
We would like to acknowledge the use of the clean room facility SMIF at Duke University. We also want to thank Hao Qiang for his assistance in measuring the jet velocity. The authors thank Todd Rumbaugh of Hadland Imaging for providing the Shimadzu HPV-X camera used in this study.The work was funded in part by NIH through grants 5R03EB017886-02 and 4R37DK052985-20.
Materials
| Reagent/Materials | |||
| 75x38mm Plain Microscope Slides | Corning | 2947-75X38 | |
| Acetone | Sigma Aldrich, Co. | 320110 | ACS reagent, ≥99.5% |
| Isopropyl alcohol | Sigma Aldrich, Co. | W292907 | ≥99.7%, FCC, FG |
| Sulfuric acid | Sigma Aldrich, Co. | 320501 | ACS reagent, 95.0-98.0% |
| Hydrogen peroxide | Sigma Aldrich, Co. | 216763 | 30 wt.% in H2O |
| Primer P-20 | Microchem | MCC Primer 80/20 | |
| NFR photoresist | JSR | NFR016D2 | |
| Photomask | Photoplotstore | N/A | 4×4 Direct write mask |
| MF-319 Developer | Shipley (Rohm and Haas) | Microposit MF-319 | |
| 1165 Photoresist Remover | Dow Chemical, Co. | DEM-10018073 | 1-methyl-2-pyrrolidinone based |
| S1813 photoresist | Shipley (Rohm and Haas) | S1813 | |
| PLL-g-PEG | SuSoS | PLL(20)-g[3.5]- PEG(2) | |
| HEPES | ThermoFisher Scientific | 15630080 | |
| Paraffin film | HACH | 251764 | |
| SU-2025 photoresist | Microchem | SU-2025 | |
| PDMS | Dow Corning | 184 SIL ELAST KIT 0.5KG | |
| Microbore Tubing | Saint-Gobain PPL Corp. | S-54-HL | |
| Metal pins | New England Small Tube | NE-1300-01 | Cut Tube (straight), 0.025” OD x 0.017” ID x 0.50” Long |
| HeLa cells | Duke Cell Culture Facility | (307-CCL-2) HeLa, p.148 | |
| DPBS(1X) buffer | ThermoFisher Scientific | 14190144 | |
| DMEM culture medium | ThermoFisher Scientific | 11995065 | |
| Fibronectin Bovine Protein, Plasma | ThermoFisher Scientific | 33010018 | |
| 0.25% Trypsin-EDTA (1X) | ThermoFisher Scientific | 25200056 | |
| Propidium Iodide | ThermoFisher Scientific | P21493 | |
| Carboxylate Microspheres 1.00μm | Polysciences, Inc | 08226-15 | |
| Carboxylate Microspheres 2.00μm | Polysciences, Inc | 18327-10 | |
| EDC (1-ethyl-3-(3-dimethylaminopropyl)carbodiimide hydrochloride) | ThermoFisher Scientific | 22980 | |
| Sulfo-NHS | Sulfo-NHS (N-hydroxysulfosuccinimide) | 24510 | |
| Peptite-2000 | Advanced BioMatrix | 5020-5MG | |
| FITC Annexin V | ThermoFisher Scientific | A13199 | |
| Fura-2, AM | ThermoFisher Scientific | F1221 | |
| DMSO | Sigma Aldrich, Co. | D2650 | |
| F-127 | invitrogen | P6866 | 0.2 µm filtered (10% Solution in Water) |
| Reduced serum media | ThermoFisher Scientific | 11058021 | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Plasma asher | Emitech | K-1050X | O2 / Ar plasma ashing of photoresist and other organic materials |
| Mask aligner | SUSS MicroTec | Karl Suss MA6/BA6 | |
| E-beam evaporator | CHA Industries | CHA Industries Solution E-Beam | |
| RIE | Trion Technology | Trion Technology Phantom II | (oxide/ nitride/ polymer) etching |
| Stereoscope | AmScope | American Scope SM-4TZ-FRL | Stereo Microscope |
| Syringe pump | Chemyx Inc | NanoJet | |
| Cell culture incubator | NuAire | AutoFlow NU-8500 Water Jacket CO2 Incubator | |
| Biological Safety Cabinets | NuAire | NU-425-400 | |
| Water bath | VWR | 1122s | |
| Centrifuge | IEC | Centra CL2 | |
| Microscope | Zeiss | Axio Observer Z1 | |
| Nd:YAG laser (laser 1) | New Wave Research | Tempest | |
| Nd:YAG laser (laser 2) | New Wave Research | Orion | |
| Delay generator | Berkeley Nucleonics | BNC 565-8c | |
| Flash lamp | Dyna-Lite | ML1000 fiber-coupled flashtube | |
| high speed camera | DRS Hadland | Imacon 200 | |
| high speed camera | Shimadzu | HPV-X | |
| high speed camera | Vision Research | Phantom V7.3 | |
| PIV software | LaVision | DaVis 7.2 | |
| camera | Zeiss | AxioCam MRc 5 | |
| software | Zeiss | AxioVision | |
| PTI system | Horiba | S/N: 1705 RAM-X | |
| EasyRatio software | Horiba | Easy Ratio Pro 2 | version 2.3.125.86 |
| 63× objective | Zeiss | LD Plan Neofluar |
References
- Wang, D., Bodovitz, S. Single cell analysis: the new frontier in ‘omics. Trends Biotechnol. 28 (6), 281-290 (2010).
- Weaver, W. M., et al. Advances in high-throughput single-cell microtechnologies. Curr Opin Biotechnol. 25, 114-123 (2014).
- Gossett, D. R., et al. Hydrodynamic stretching of single cells for large population mechanical phenotyping. Proc Natl Acad Sci USA. 109 (20), 7630-7635 (2012).
- Spiller, D. G., Wood, C. D., Rand, D. A., White, M. R. H. Measurement of single-cell dynamics. Nature. 465 (7299), 736-745 (2010).
- Lecault, V., White, A. K., Singhal, A., Hansen, C. L. Microfluidic single cell analysis: from promise to practice. Curr Opin Chem Biol. 16 (3-4), 381-390 (2012).
- Kennedy, J. E. High-intensity focused ultrasound in the treatment of solid tumours. Nat Rev Cancer. 5 (4), 321-327 (2005).
- Zhu, S., Cocks, F. H., Preminger, G. M., Zhong, P. The role of stress waves and cavitation in stone comminution in shock wave lithotripsy. Ultrasound Med Biol. 28 (5), 661-671 (2002).
- Fan, Z., Liu, H., Mayer, M., Deng, C. X. Spatiotemporally controlled single cell sonoporation. Proc Natl Acad Sci U S A. 109 (41), 16486-16491 (2012).
- Itah, Z., et al. Hydrodynamic cavitation kills prostate cells and ablates benign prostatic hyperplasia tissue. Exp Biol Med. 238 (11), 1242-1250 (2013).
- Kosar, A., Sesen, M., Oral, O., Itah, Z., Gozuacik, D. Bubbly cavitating flow generation and investigation of its erosional nature for biomedical applications. IEEE Trans Biomed Eng. 58 (5), 1337-1346 (2011).
- Li, Z. G., Liu, A. Q., Klaseboer, E., Zhang, J. B., Ohl, C. D. Single cell membrane poration by bubble-induced microjets in a microfluidic chip. Lab Chip. 13 (6), 1144-1150 (2013).
- Li, F. F., Chan, C. U., Ohl, C. D. Yield Strength of Human Erythrocyte Membranes to Impulsive Stretching. Biophys J. 105 (4), 872-879 (2013).
- Li, F., M, M., Ohl, C. .. D. .. Shear stress induced stretching of red blood cells by oscillating bubbles within a narrow gap. Bull Am Phys Soc. 58, (2013).
- Sankin, G. N., Yuan, F., Zhong, P. Pulsating tandem microbubble for localized and directional single-cell membrane poration. Phys. Rev. Lett. 105 (7), 078101 (2010).
- Fan, Q., Hu, W., Ohta, A. T. Laser-induced microbubble poration of localized single cells. Lab Chip. 14 (9), 1572-1578 (2014).
- Chen, C. S., Mrksich, M., Huang, S., Whitesides, G. M., Ingber, D. E. Geometric control of cell life and death. Science. 276 (5317), 1425-1428 (1997).
- Yuan, F., Sankin, G., Zhong, P. Dynamics of tandem bubble interaction in a microfluidic channel. J Acoust Soc Am. 130 (5), 3339-3346 (2011).
- Yang, C. . Analysis of Tandem Bubble Interaction and Jet Formation in a Microfluidic Channel. , (2013).
- Simon, S. I., Schmid-Schonbein, G. W. Cytoplasmic strains and strain rates in motile polymorphonuclear leukocytes. Biophys J. 58 (2), 319-332 (1990).
- Barbee, K. A., Macarak, E. J., Thibault, L. E. Strain measurements in cultured vascular smooth muscle cells subjected to mechanical deformation. Ann Biomed Eng. 22 (1), 14-22 (1994).
- Yuan, F., Yang, C., Zhong, P. Cell membrane deformation and bioeffects produced by tandem bubble-induced jetting flow. Proc. Natl. Acad. Sci. U.S.A. 112 (51), E7039-E7047 (2015).
- Yin, H., Marshall, D. Microfluidics for single cell analysis. Curr Opin Biotechnol. 23 (1), 110-119 (2012).
- Tay, S., et al. Single-cell NF-kappa B dynamics reveal digital activation and analogue information processing. Nature. 466 (7303), 267-271 (2010).
- Rand, R. P., Burton, A. C. Mechanical Properties of the Red Cell Membrane: I. Membrane Stiffness and Intracellular Pressure. Biophys J. 4 (2), 115-135 (1964).
- Lim, C. T., Dao, M., Suresh, S., Sow, C. H., Chew, K. T. Large deformation of living cells using laser traps. Acta Mater. 52 (7), 1837-1845 (2004).
- Puig-de-Morales-Marinkovic, M., Turner, K. T., Butler, J. P., Fredberg, J. J., Suresh, S. Viscoelasticity of the human red blood cell. Am J Physiol Cell Physiol. 293 (2), C597-C605 (2007).
- Kudo, N., Okada, K., Yamamoto, K. Sonoporation by single-shot pulsed ultrasound with microbubbles adjacent to cells. Biophys J. 96 (12), 4866-4876 (2009).
- van Wamel, A., et al. Vibrating microbubbles poking individual cells: Drug transfer into cells via sonoporation. J Control Release. 112 (2), 149-155 (2006).
- Hu, Y., Wan, J. M., Yu, A. C. Membrane perforation and recovery dynamics in microbubble-mediated sonoporation. Ultrasound Med Biol. 39 (12), 2393-2405 (2013).
- Dijkink, R., et al. Controlled cavitation-cell interaction: trans-membrane transport and viability studies. Phys Med Biol. 53 (2), 375-390 (2008).
- Rau, K. R., Quinto-Su, P. A., Hellman, A. N., Venugopalan, V. Pulsed laser microbeam-induced cell lysis: Time-resolved imaging and analysis of hydrodynamic effects. Biophys J. 91 (1), 317-329 (2006).

