Expression de la cytokine exogène dans les xénogreffes dérivées par un patient par injection avec une lignée cellulaire Stromal transduites par une cytokine
Summary
On décrit ici un procédé pour produire une cytokine exogène chez des souris de xénogreffe (PDX) dérivées du patient par injection intrapéritonéale hebdomadaire d'une lignée cellulaire stromale transduit par cytokine. Cette méthode élargit l'utilité de PDX et fournit l'option pour la distribution de cytokines exogènes transitoires ou prolongées dans une multitude de modèles PDX.
Abstract
Les souris dérivées de xénogreffe (PDX) sont produites par transplantation de cellules humaines dans des souris immunodéficientes. Ces modèles sont un outil important pour étudier les mécanismes de l'hématopoïèse normale et maligne et constituent l'étalon-or pour l'identification de chimiothérapies efficaces pour de nombreuses tumeurs malignes. Les modèles PDX sont possibles car beaucoup de cytokines de souris agissent également sur des cellules humaines. Cependant, ce n'est pas le cas pour toutes les cytokines, y compris celles qui sont essentielles pour l'étude de l'hématopoïèse normale et maligne dans les cellules humaines. Les techniques qui engendrent des souris pour produire des cytokines humaines (modèles transgéniques et knock-in) nécessitent des dépenses importantes avant que l'utilité du modèle ne soit démontrée. D'autres techniques nécessitent beaucoup de travail (injection de cytokine recombinante ou lentivirus) et, dans certains cas, nécessitent des connaissances techniques élevées (injection hydrodynamique d'ADN). Ce rapport décrit une méthode simple pour générer des souris PDX qui ont une cyan humaine exogèneTokine (TSLP, lymphopoïétine stromale thymique) par injection hebdomadaire intraperitoneale de stroma qui a été transduit pour surexprimer cette cytokine. L'utilisation de cette méthode fournit une source in vivo de production continue de cytokines qui atteint des niveaux physiologiques de cytokine humaine circulante dans la souris. Les niveaux plasmatiques de cytokine humaine peuvent varier en fonction du nombre de cellules stromales injectées et la production de cytokines peut être initiée à n'importe quel moment de l'expérience. Cette méthode comprend également des souris témoins négatives pour les cytokines qui sont produites de manière similaire, mais par injection intraperitoneale de stroma transduit avec un vecteur témoin. Nous avons déjà démontré que les cellules de leucémie récoltées à partir de la PDX exprimant le TSLP, par rapport au PDX de contrôle, présentent un modèle d'expression génique plus semblable à l'échantillon original du patient. Ensemble, les souris PDX produisant des cytokines et des souris cytokines négatives produites par cette méthode fournissent un système modèle que nous avons utilisé avec succès pour étudier laRôle de TSLP dans l'hématopoïèse normale et maligne.
Introduction
Les xénogreffes dérivées de patients (PDX) sont un puissant modèle in vivo pour étudier la production de cellules hématopoïétiques normales et malignes dans un environnement de mammifère "natif". Le plus souvent, la PDX est produite par injection ou transplantation de cellules humaines dans des souris immunodéficientes. La production de PDX à l'aide de cellules souches hématopoïétiques humaines normales permet des études in vivo du sang humain normal et du développement de cellules immunitaires. La PDX produite à partir de leucémie ou d'autres cellules cancéreuses permet d'étudier les mécanismes oncogènes et d'identifier des thérapies efficaces dans le contexte de la gamme des paysages génétiques et des mutations présentes dans la population humaine. 1 Par conséquent, PDX est l'étalon-or actuel pour la recherche biomédicale translationnelle pour identifier les thérapies efficaces et un outil important pour comprendre les mécanismes de progression du cancer. Les modèles PDX sont un outil essentiel pour faciliter la recherche sur les disparités en matière de santé en raison de maladies spécifiques Les lésions génétiques ou toute maladie dans laquelle les variations du paysage génétique d'un patient peuvent contribuer de manière substantielle à l'oncogenèse et aux résultats du traitement.
Les modèles PDX souris-humains sont possibles car de nombreuses cytokines de souris imitent de manière adéquate leurs analogues humains dans l'activation des récepteurs de cytokines des cellules humaines alors qu'ils se trouvent à l'intérieur de la souris. Par exemple, l'interleukine-7 (IL-7) fournit un signal critique pour le développement des cellules B humaines. 2 Dans ce cas, l'IL-7 de souris a une homologie suffisante avec l'IL-7 humaine que la cytokine de souris stimule les voies de signalisation dans les précurseurs de cellules B humaines. 2 , 3 , 4 Cependant, ce n'est pas le cas pour la lymphopoïétine stromale thymique (TSLP), 5 , 6 qui, parmi d'autres cytokines (IL-3, facteur de stimulation des colonies de granulocytes-macrophages (GM-CSF), facteur de cellules souches (SCF) ,La cytokine de souris et humaine présente une faible homologie, les cytokines de souris n'activent pas leurs récepteurs respectifs sur les cellules humaines. Pour surmonter cet obstacle, un certain nombre de stratégies ont été utilisées Pour englober l'expression de cytokines humaines chez les souris PDX, notamment l'injection de cytokines humaines recombinantes, l'injection hydrodynamique de l'ADN, l'expression lentivirale, l'expression transgénique et le remplacement du gène knockin. 7 Ce rapport décrit une méthode pour l'ingénierie de PDX pour produire une cytokine humaine par médiation par le stromal Distribution de cytokines ( figure 1 ).
Dans la méthode démontrée ici, les souris PDX sont conçues pour exprimer la cytokine humaine, la TSLP, ou pour servir de témoins négatifs à la cytokine. TSLP-exprimant PDX sont réalisés par des injections intrapéritonéales hebdomadaires de cellules stromales qui ont été transduites pour exprimer des niveaux élevés de TSLP humaine.Les souris "contrôle" PDX "anti-cytokine négatives" sont conçues de manière similaire; Bien que le stroma de contrôle soit transduit avec un vecteur témoin. Cette méthode atteint des taux physiologiques normaux de TSLP humaine chez des souris PDX injectées avec le stroma TSLP +. Aucune TSLP détectable n'est observée chez les souris PDX recevant le stroma négatif des cytokines. Nous avons sélectionné la ligne cellulaire stromale humaine HS-27A pour nos études, car elle se développe de manière robuste en culture et affiche un très faible taux de production de cytokines qui ne supporte pas la prolifération de cellules progénitrices isolées dans les cultures de cultures. 8 Pour l'expression TSLP humaine, le stroma a été transduit avec un vecteur lentiviral auto-inactif à génération avancée dérivé d'un squelette décrit précédemment, 9 et comprend l'élément cPPT / cts et l'élément régulateur post-transcriptionnel hépatite de la marbrure (WPRE) pour augmenter l'expression du transgène. Le gène TSLP humain a été construit dans ce vecteur sous le contrôle du facteur d'allongement-1(EF-1) alpha pour obtenir une expression solide, constitutive et à long terme.
L'ingénierie de ce modèle PDX amélioré par les cytokines humaines se compose de 4 étapes majeures. Tout d'abord, le stroma transduit est développé in vitro et évalué par dosage immunosorbant enzymatique (ELISA) pour une production stable et à haute teneur en cytokines. Deuxièmement, l'activité de la cytokine humaine produite par les cellules stromales transduites (et le manque d'activité de la cytokine à partir du stroma témoin) est vérifiée à l'aide de la cytométrie à flux phosphore. Les lignées cellulaires connues pour réagir à la cytokine d'intérêt (dans ce cas, TSLP) sont incubées avec un surnageant de cellules stromales et testées pour la phosphorylation induite par les cytokines. Troisièmement, les souris sont injectées avec un stroma humain transduit, puis le plasma de souris est évalué par ELISA pour des taux de cytokines humains sur une base hebdomadaire. Quatrièmement, les cellules hématopoïétiques humaines sont transplantées et les effets fonctionnels in vivo de la cytokine humaine sont évalués sur une cible connue ( <em> P.ex. Population cellulaire).
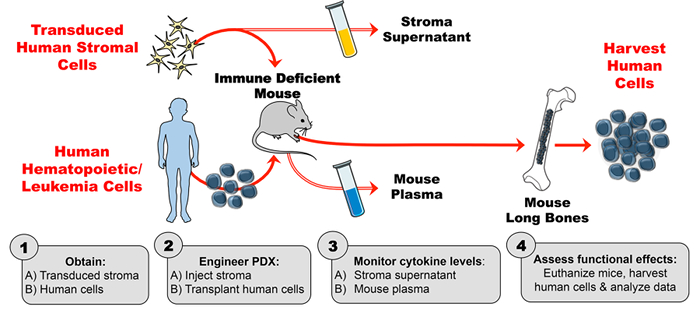
Figure 1: Modèle PDX conçu pour produire des cytokines humaines exogènes chez les souris. ( 1A ) Expérience de conception et obtention de cellules stromales humaines transduites ( 1B ) Obtenir des cellules humaines (cellules souches hématopoïétiques, cellules de leucémie, etc. ) pour générer des souris PDX (xénogreffe dérivée du patient). ( 2A ) Injecter le stroma manipulé et ( 2B ) transplanter des cellules humaines dans des souris immunodéficientes selon le calendrier expérimental. ( 3A-B ) Surveiller les concentrations de cytokines dans le surnageant de stroma et le plasma de souris par ELISA. ( 4 ) Récolter des cellules humaines et évaluer les effets fonctionnels in vivo de la cytokine humaine présente dans la PDX. Cliquez ici s'il vous plaitPour afficher une version plus grande de cette figure.
La délivrance de cytokines humaines par l'intermédiaire de cellules stromales offre à la fois des avantages et des inconvénients par rapport à d'autres procédés de délivrance / production de cytokines humaines chez des souris PDX. 7 Par rapport à l'injection de cytokine humaine recombinante, la délivrance à médiation par le stroma est généralement moins coûteuse (le coût de la culture de cellules stromales est inférieur au coût de la cytokine recombinante) et moins de travail intensif (une injection par semaine par injection multiple par semaine). La question de la demi-vie courte des cytokines est également atténuée puisque le stroma produit continuellement la cytokine exogène. La délivrance de cytokine par injection hydrodynamique d'ADN peut être moins coûteuse que la délivrance par stroma. Cependant, il est également transitoire et peut nécessiter plus de compétences techniques que l'injection intrapéritonéale hebdomadaire simple requise pour l'administration par stimulation du stroma. L'expression du gène lentiviral chez la souris peut fournir moins de traMéthode de distribution de cytokines; Cependant, dans nos mains, les niveaux de TSLP physiologiques n'ont pas été atteints. En outre, cette méthode nécessite beaucoup de travail, nécessitant une production continue de vecteur lentiviral. Les souris transgéniques ou knock-in offrent une expression stable à long terme de la cytokine et peuvent être conçues pour une expression spécifique des tissus, ce qui peut être un avantage. D'autre part, l'expression transgénique du gène de la cytokine humaine sur le fond de souris immunodépendant requis pour les souris PDX nécessite un immense investissement de ressources avant que la valeur du modèle ne soit établie. En outre, les modèles transgéniques ne permettent généralement pas l'option de modifier le moment de l'initiation des cytokines ou le niveau de production de cytokines in vivo . Ceux-ci peuvent être atteints avec une distribution stimulée par le stroma en modifiant simplement le point de temps pour l'initiation de l'injection de cellules stromales ou la dose de cellules stromales injectées.
La méthodologie de distribution de cytokines médiée par une cellule stromaleOd détaillé ici a été utilisé pour développer PDX pour évaluer le rôle du TSLP dans le développement normal des cellules B humaines 4 , 6 et la leucémie lymphoblastique aiguë des cellules B à haut risque. 6 Cette méthode fournit une méthode de distribution de cytokine alternative utilisée pour générer des modèles similaires avec des cytokines humaines autres que TSLP. Ce modèle peut également être utile pour générer des données préliminaires qui peuvent aider à déterminer si la valeur d'un cytokine transgénique ou cytokine knock-in PDX modèle serait digne de l'investissement en temps et en argent important.
Protocol
Representative Results
Discussion
Ce manuscrit décrit une méthode simple, rapide et relativement rentable pour l'ingénierie PDX pour exprimer des cytokines humaines exogènes. La stratégie décrite ici est basée sur des injections intrapéritonéales hebdomadaires d'une lignée cellulaire stromale transduites pour exprimer la cytokine humaine, TSLP. Avant d'exécuter les méthodes décrites ici, le stroma conçu pour exprimer des niveaux élevés de cytokine d'intérêt (TSLP) et un stroma de contrôle de même ingénierie ont été…
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was supported by NIH R21CA162259, NIH R01CA209829, NIH P20 MD006988, NIH 2R25 GM060507, a Hyundai Hope on Wheels Scholar Hope Grant, the Department of Pathology and Human Anatomy, the Department of Basic Sciences, and the Center for Health Disparities and Molecular Medicine at Loma Linda University School of Medicine and by a Grant to Promote Collaborative and Translational Research from Loma Linda University (KJP). The content is solely the responsibility of the authors and does not necessarily represent the official views of the NIH.
Materials
| Wet lab reagents | |||
| T-25 Nunc Cell Culture Treated EasYFlasks, 7 mL capacity, 25cm² culture area | Thermo Scientific / Fisher | 156367 | |
| T-75 Falcon Tissue Culture Treated Flask, 250 mL capacity, 75 cm² culture area & vented cap | Corning Inc. / Fisher | 353136 | |
| T-150 Falcon Tissue Culture Treated Flask, 600 mL capacity, 150 cm² culture area & vented cap | Corning Inc. / Fisher | 355001 | |
| 10 mL serological pipettes | Falcon | 357551 | |
| 15 mL polypropylene conical tubes | Fisher | 05-539-12 | |
| 5 mL round-bottom polystyrene tubes | Falcon | 352054 | |
| 50 mL polypropylene conical tubes | Falcon | 352098 | |
| 2.0 mL cryogenic vials, externally threaded | Corning Inc. / Fisher | 4230659 | |
| 1 mL pipette tips | Fisher | 2707509 | |
| 200 μL pipette tips | Denville Scientific | P3020-CPS | |
| 10 μL pipette tips | Denville Scientific | P-1096-CP | |
| Sterile Disposable Filter Units with SFCA Membrane, Nalgene Rapid-Flow | Fisher | 09-740-28D | |
| 2N H2SO4 | BioLegend | 423001 | |
| Dulbecco’s phosphate-buffered saline (PBS) without calicium and magnesium, 1× | Corning cellgro/ Mediatech | 21-031-CV | |
| Human TSLP ELISA Max Deluxe Set | BioLegend | 434204 | |
| 3% Acetic Acid with Methylene Blue | Stemcell Technologies | 7060 | |
| Trypan Blue | Corning | 25-900-Cl | |
| "Trypsin" 1x 0.25% Trypsin 2.21 mM EDTA in HBSS | ThermoFisher | 25-053 | |
| TWEEN 20 BioXtra | Sigma-Aldrich | P-7949 | |
| “R10” cell culture medium, % of total volume (makes 565 mL) | – | – | Lab Recipe |
| RPMI, 88.5% (500 mL) | Mediatech | 10-040-CV | |
| FBS, 9.9% (56 mL) | Mediatech | 35-011-CV | |
| L-Glutamine, 0.99% (5.6 mL) | Mediatech | 25-005-Cl | |
| Penicillin-Streptomycin, 0.50% (2.8 mL) | Mediatech | 30-002-Cl | |
| 2-Mercaptoethanol, 0.10% (560 µL) | MP | 190242 | |
| “R20” cell culture medium, % of total volume (makes 195 mL) | – | – | Lab Recipe |
| RPMI, 76.84% (150 mL) | see above | see above | |
| FBS, 20.49% (40 mL) | see above | see above | |
| 2mM L-glutamine, 1.02% (2 mL) | see above | see above | |
| 1mM Na pyruvate, 1.02% (2 mL ) | see above | see above | |
| Penicillin-Streptomycin, 0.51% (1 mL) | see above | see above | |
| 2-Mercaptoethanol, 0.10% (0.1 M), 0.10% (200 µL) | see above | see above | |
| “Freezing medium”, % of total volume | – | – | Lab Recipe |
| “R10” medium, 45% | see "R10" recipe | – | |
| FBS, 20% | see above | 35-011-CV | |
| DMSO, 10% | Corning | 25-950-CQC | |
| D(-)(+)-Trehalose dihydrate, 5% | Fisher Scientific | BP2687-100 | |
| Name | Company | Catolog Number | Comments |
| Biologics | |||
| "HS-27" HS-27A human stroma line | ATCC | CRL-2496 | |
| "CALL-4" MHH-CALL-4 cell line, human B cell precursor leukemia | DSMZ | ACC 337 | |
| “NSG mice” NOD.Cg-Prkdcscid Il2rgtm1Wjl/SzJ, male or female, age 6 – 8 weeks | JAX Mice | # 005557 | |
| MUTZ-5 cell line, human B cell precursor leukemia | DSMZ | ACC 490 | |
| Recombinant Human TSLP protein | R&D Systems | 1398-TS-010 | |
| Name | Company | Catolog Number | Comments |
| Flow cytomery antibodies (clone)* | |||
| Anti-mouse CD45 FITC (30F11) | Miltenyi Biotec | 130-102-778 | |
| CD127 PE (MB15-18C9) (alternate name is IL-7Rα) | Miltenyi Biotec | 130-098-094 | |
| CD34 APC (8G12) | BD Biosciences | 340667 | |
| CD45 PE-Cy7 (HI30) | eBioscience | 25-0459 | |
| "FVD" Fixable viability dye eFluor 780 | eBioscience | 65-0865 | |
| Ig κ light chain FITC (G20-193) | BD Pharmingen | 555791 | |
| Ig λ light chain FITC (JDC-12) | BD Pharmingen | 561379 | |
| IgD PE (IA6-2) | BioLegend | 348203 | |
| IgM PE-Cy5 (G20-127) | BD Biosciences | 551079 | |
| pSTAT5 PE, mouse anti-STAT5 (pY694) | BD PhosphoFlow | 612567 | |
| Name | Company | Catolog Number | Comments |
| Other materials & equipment | |||
| Animal Implantable Nano Transponder with Canula | Trovan | ID-100B(1.25) | |
| EMLA lidocaine anesthetic cream (obtain by presciption through animal care facility) | perscription | perscription | |
| BD ½ cc LO-DOSE U-100 Insulin Syringe 28G½ | BD | #329461 | |
| BD Microtainer Tubes with K2EDTA | BD | #365974 | |
| Centrifuge | Beckman Coulter | Alegra X-15R | |
| FisherBrand Capillary Tubes (Heparinized) | Fisher Scientific | 22-260-950 | |
| Hemocytometer | Fisher | 02-671-6 | |
| MACSQuant Analyzer 10 | Miltenyi Biotec | 130-096-343 | |
| Mouse Pie Cage | Braintree Scientific, Inc. | MPC-1 | |
| Mouse Tail Illuminator Restrainer | Braintree Scientific, Inc. | MTI STD | |
| Pistol Grip Implanter | Trovan | IM-300(1.25) | |
| µQuant | Bio-Tek Instruments Inc. | MQX200 | |
| FlowJo flow cytometry analysis software | FlowJo, LLC | Version 10 | |
| *All antibodies are anti-human unless otherwise stated. |
References
- Francis, O. L., Milford, T. A., Beldiman, C., Payne, K. J. Fine-tuning patient-derived xenograft models for precision medicine approaches in leukemia. J Investig Med. 64 (3), 740-744 (2016).
- Parrish, Y. K., et al. IL-7 Dependence in human B lymphopoiesis increases during progression of ontogeny from cord blood to bone marrow. J Immunol. 182 (7), 4255-4266 (2009).
- Johnson, S. E., Shah, N., Panoskaltsis-Mortari, A., LeBien, T. W. Murine and human IL-7 activate STAT5 and induce proliferation of normal human pro-B cells. J Immunol. 175 (11), 7325-7331 (2005).
- Milford, T. A., et al. TSLP or IL-7 provide an IL-7Ralpha signal that is critical for human B lymphopoiesis. Eur J Immunol. 46 (9), 2155-2161 (2016).
- Reche, P. A., et al. Human thymic stromal lymphopoietin preferentially stimulates myeloid cells. J Immunol. 167 (1), 336-343 (2001).
- Francis, O. L., et al. A novel xenograft model to study the role of TSLP-induced CRLF2 signals in normal and malignant human B lymphopoiesis. Haematologica. 101 (4), 417-426 (2016).
- Willinger, T., Rongvaux, A., Strowig, T., Manz, M. G., Flavell, R. A. Improving human hemato-lymphoid-system mice by cytokine knock-in gene replacement. Trends Immunol. 32 (7), 321-327 (2011).
- Graf, L., Iwata, M., Torok-Storb, B. Gene expression profiling of the functionally distinct human bone marrow stromal cell lines HS-5 and HS-27a. Blood. 100 (4), 1509-1511 (2002).
- Follenzi, A., Ailles, L. E., Bakovic, S., Geuna, M., Naldini, L. Gene transfer by lentiviral vectors is limited by nuclear translocation and rescued by HIV-1 pol sequences. Nat Genet. 25 (2), 217-222 (2000).
- Li, M., Husic, N., Lin, Y., Snider, B. J. Production of lentiviral vectors for transducing cells from the central nervous system. J Vis Exp. (63), e4031 (2012).
- Cockrell, A. S., Kafri, T. Gene delivery by lentivirus vectors. Mol Biotechnol. 36 (3), 184-204 (2007).
- Ricardo, R., Phelan, K. Freezing, thawing, and packaging cells for transport. J Vis Exp. (17), (2008).
- Tasian, S. K., et al. Aberrant STAT5 and PI3K/mTOR pathway signaling occurs in human CRLF2-rearranged B-precursor acute lymphoblastic leukemia. Blood. 120 (4), 833-842 (2012).
- Kalaitzidis, D., Neel, B. G. Flow-cytometric phosphoprotein analysis reveals agonist and temporal differences in responses of murine hematopoietic stem/progenitor cells. PLoS One. 3 (11), (2008).
- Machholz, E., Mulder, G., Ruiz, C., Corning, B. F., Pritchett-Corning, K. R. Manual restraint and common compound administration routes in mice and rats. J Vis Exp. (67), (2012).
- Kovacsics, D., Raper, J. Transient expression of proteins by hydrodynamic gene delivery in mice. J Vis Exp. (87), (2014).
- Menon, V., Thomas, R., Ghale, A. R., Reinhard, C., Pruszak, J. Flow cytometry protocols for surface and intracellular antigen analyses of neural cell types. J Vis Exp. (94), (2014).
- Pearson, T., Greiner, D. L., Shultz, L. D. Chapter 15, Creation of "humanized" mice to study human immunity. Curr Protoc Immunol. , (2008).
- Matheu, M. P., Sen, D., Cahalan, M. D., Parker, I. Generation of bone marrow derived murine dendritic cells for use in 2-photon imaging. J Vis Exp. (17), (2008).
- Scheeren, F. A., et al. Thymic stromal lymphopoietin induces early human B-cell proliferation and differentiation. Eur J Immunol. 40 (4), 955-965 (2010).
- Lee, E. B., et al. Increased serum thymic stromal lymphopoietin in children with atopic dermatitis. Pediatr Allergy Immunol. 21 (2 Pt 2), e457-e460 (2010).

