ביטוי של ציטוקינים אקסוגניים ב- Xenografts שמקורם בחולה באמצעות הזרקה באמצעות קו תאים סטרומל ציטוקינים
Summary
מתואר כאן היא שיטה לייצור ציטוקינים אקסוגניים בעכברים xenograft (PDX) נגזר החולה באמצעות הזרקה intraperitoneal שבועי של צינוקין transduced transromal שורה התא. שיטה זו מרחיבה את התועלת של PDX ומספקת את האפשרות עבור משלוח ציטוקינים אקסוגני חולף או מתמשכת במספר רב של מודלים PDX.
Abstract
עכברים שמקורם בחולה (PDX) שמקורם בחולה מיוצרים על ידי השתלת תאים אנושיים לעכברים חסרי מערכת החיסון. מודלים אלה הם כלי חשוב לחקר המנגנונים של hematopoiesis נורמלי וממאיר והם תקן הזהב לזיהוי chemotherapies יעיל עבור ממאירות רבות. מודלים PDX אפשריים כי רבים של ציטוקינים העכבר גם לפעול על תאים אנושיים. עם זאת, זה לא המקרה עבור כל ציטוקינים, כולל רבים כי הם קריטיים לחקר hematopoiesis נורמלי וממאיר בתאים אנושיים. טכניקות כי מהנדסים עכברים לייצר ציטוקינים אנושיים (מהונדס ודפיקות- in מודלים) דורשים הוצאה משמעותית לפני התועלת של המודל הוכח. טכניקות אחרות הן עבודה אינטנסיבית (הזרקה של ציטוקינים רקומביננטי או lentivirus) ובמקרים מסוימים דורשים רמות גבוהות של מומחיות טכנית (הזרקת הידרודינמית של דנ"א). דוח זה מתאר שיטה פשוטה ליצירת עכברים PDX כי יש אקסוגני האדם cyTokine (TSLP, thymic stromal lymphopoietin) באמצעות הזרקה intraperitoneal שבועי של stroma כי כבר transduced כדי overexpress זה ציטוקינים. השימוש בשיטה זו מספק מקור vivo של ייצור ציטוקינים רציפה כי משיגה רמות פיזיולוגיות של ציטוקינים האדם במחזור העכבר. רמות פלזמה של ציטוקינים אנושיים יכולים להיות מגוונים על סמך מספר התאים סטרומה מוזרק, ייצור ציטוקינים יכול להיות יזם בכל נקודה בניסוי. שיטה זו כוללת גם עכברים שליטה שלילית ציטוקינים המיוצרים באופן דומה, אבל באמצעות הזרקה intraperitoneal של stroma transduced עם וקטור שליטה. יש לנו הוכיחו בעבר כי תאים לוקמיה שנקטפו TSLP- להביע PDX, לעומת שליטה PDX, התערוכה ביטוי ביטוי הגן יותר כמו המדגם המטופל המקורי. יחד ציטוקינים בייצור ו- cytokine שלילי עכברים PDX המיוצרים על ידי שיטה זו מספקים מודל המערכת שבה השתמשנו בהצלחה ללמוד אתתפקיד TSLP ב hematopoiesis רגיל וממאיר.
Introduction
המטופל נגזר xenografts (PDX) הם חזקים מודל vivo לחקר הייצור של תאים hematopoietic הממאירים נורמלי בסביבה יונקים "יליד". לרוב, PDX מיוצרים על ידי הזרקת או השתלת תאים אנושיים לעכברים חסרי מערכת החיסון. הייצור של PDX באמצעות תאי גזע האדם hematopoietic רגיל מאפשר במחקרים vivo של דם אדם נורמלי ופיתוח תאים החיסון. PDX המיוצר מלוקמיה או תאי סרטן אחרים מאפשרים ללמוד מנגנונים oncogenic ולזהות טיפולים יעילים בהקשר של מגוון של נופים גנטיים ומוטציות הנוכחי באוכלוסייה האנושית. 1 כתוצאה מכך, PDX הם תקן הזהב הנוכחי עבור מחקר ביו-רפואי translational כדי לזהות טיפולים יעילים וכלי חשוב להבנת מנגנוני התקדמות סרטן. מודלים PDX הם כלי חיוני כדי לסייע במחקר לתוך מחלות פערים בריאותיים עקב ספציפיות נגעים גנטיים, או כל מחלה שבה הווריאציות של הנוף הגנטי של המטופל יכולות לתרום באופן משמעותי לאונקוגנזה ולתוצאות הטיפול.
עכבר האדם מודלים PDX אפשריים בגלל ציטוקינים רבים העכבר כראוי לחקות האנלוגים האנושיים שלהם הפעלת קולטנים ציטוקינים של תאים אנושיים בזמן שהם בתוך העכבר. לדוגמה, אינטרליוקין -7 (IL-7) מספק אות קריטי לפיתוח תאי B. 2 במקרה זה, עכבר IL-7 יש מספיק הומולוגיה עם IL-7 האנושי כי ציטוקין העכבר מגרה נתיבי איתות בבשר מבשר התא האנושי. 5 , 6 , אשר בין ציטוקינים אחרים (IL-3, גרנולוציטים-מקרופאג מושבה גורם מגרה (GM-CSF), גורם תא גזע (SCF) ,Ref 7 "חשוב לייצור תאים הומאופויטים נורמליים וממאירים, כאשר ציטוקינים של עכברים ושל בני אדם מציגים הומולוגיה נמוכה, הציטוקינים של העכבר אינם מפעילים את הקולטנים שלהם על תאים אנושיים.כדי להתגבר על מכשול זה, נעשה שימוש במספר אסטרטגיות כדי להביע את הביטוי של ציטוקינים אנושיים בעכברים PDX.זה כולל הזרקה של ציטוקינים אנושיים רקומביננטי, הזרקת הידרודינמית של דנ"א, ביטוי lentiviral, ביטוי מהונדס תחליף הגן knockin 7. דוח זה מתאר שיטה להנדסה PDX לייצר ציטוקינים אנושיים באמצעות stromal בתיווך משלוח ציטוקינים ( איור 1 ).
בשיטה הפגינו כאן, עכברים PDX מתוכננים להביע את הציטוקין האנושי, TSLP, או לשמש שולטת ציטוקינים שלילי. TSLP- להביע PDX מושגות על ידי זריקות intraperitoneal שבועי של תאים stromal כי כבר transduced להביע רמות גבוהות של TSLP האדם.ציטוקינים שלילי PDX "שליטה" עכברים הם מהונדסים באופן דומה; אם כי stroma שליטה transduced עם וקטור שליטה. שיטה זו משיגה רמות פיזיולוגיות נורמלי של TSLP האדם בעכברים PDX מוזרק עם stroma TSLP. לא TSLP לזיהוי הוא ציין בעכברים PDX קבלת stroma ציטוקינים שלילי. בחרנו את קו התא האנושי stromal HS-27A עבור המחקר שלנו כי הוא גדל בחוזקה בתרבות מראה רמה נמוכה מאוד של ייצור ציטוקינים כי אינו תומך התפשטות של תאים אב מבודד cocultures. 8 עבור הביטוי TSLP האנושי, stroma היו transduced עם הדור מתקדם עצמית- inactivating וקטור lentiviral נגזר עמוד שדרה שתואר בעבר, 9 וכולל את האלמנט cPPT / CTS ואת הפטיטיס וודצוק שלאחר אלמנט תמלילי שלאחר (WPRE) כדי להגדיל את הביטוי transgene. הגן TSLP האנושי נבנה לתוך וקטור זה תחת שליטה של גורם הארכה -1(EF-1) מקדם אלפא כדי להשיג ביטוי חזק, מכונן, לטווח ארוך.
ההנדסה של אדם זה ציטוקינים משופרת PDX מודל מורכב של 4 שלבים עיקריים. ראשית, transduced stransa מורחבות במבחנה ולהעריך על ידי אנזים מקושרים immunayorbent assay (ELISA) לייצור יציב, ברמה גבוהה ציטוקינים. שנית, פעילות של ציטוקינים אנושיים המיוצרים על ידי תאים סטרומה transduced (וחוסר פעילות ציטוקינים מ stroma שליטה) מאומת באמצעות cytometry זרימת phospho. תאים תאים ידועים להגיב לציטוקינים של עניין (במקרה זה, TSLP) מודגרת עם supernatant תא סטרומה assayed עבור זירזום המושרה ציטוקינים. שלישית, עכברים מוזרקים עם stroma האדם transduced ולאחר מכן פלזמה העכבר מוערך על ידי ELISA עבור רמות של ציטוקינים האדם על בסיס שבועי. הרביעי, תאים hematopoietic האדם מושתלים ואת ההשפעות תפקודית vivo של הציטוקין האנושי מוערכת על יעד ידוע ( <em> לדוגמה. אוכלוסיית תאים).
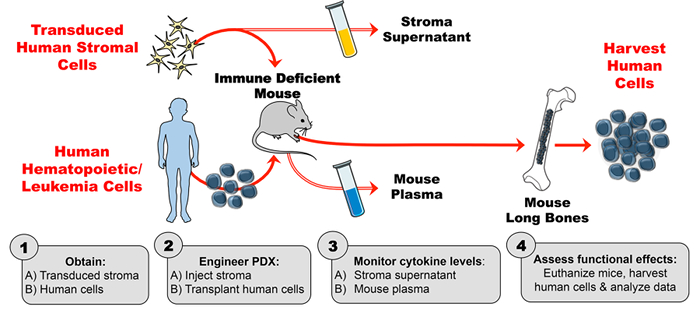
איור 1: PDX דגם מתוכנן לייצר ציטוקינים אנושיים אקסוגניים בעכברים. ( 1A ) ניסוי עיצוב ולהשיג transduced תאים סטרומה האדם ( 1B ) השגת תאים אנושיים (תאי גזע hematopoietic, תאי לוקמיה, וכו ' ) כדי לייצר עכברים PDX (שנבע מטופל xenograft) עכברים. ( 2A ) להזריק סטרומה מהונדסים ( 2B ) להשתלות תאים אנושיים לתוך עכברים לקוי החיסון לפי לוח הזמנים הניסויי. ( 3A-B ) צג ריכוזי ציטוקינים ב supernatant stroma ואת פלזמה העכבר על ידי ELISA. ( 4 ) קציר תאים אנושיים ולהעריך את ההשפעות תפקודית vivo של ההווה ציטוקינים האדם PDX. בבקשה לחץ כאןכדי להציג גרסה גדולה יותר של דמות זו.
משלוח של ציטוקינים אנושיים באמצעות תאים סטרומה מציע גם יתרונות וחסרונות בהשוואה לשיטות אחרות של אספקת / ייצור ציטוקינים אנושיים בעכברי PDX. לעומת הזרקה של ציטוקין אנושי רקומביננטי, מתן סטרומה מתווכת הוא בדרך כלל פחות יקר (העלות של תרבות התא סטרומה הוא פחות מאשר העלות של ציטוקין רקומביננטי) ופחות עבודה אינטנסיבי (הזרקת אחת בשבוע לעומת הזרקות מרובות בשבוע). הנושא של מחצית החיים ציטוקינים קצר הוא גם להקל מאז stroma לייצר ללא הרף את הציטוקינים אקסוגני. משלוח של ציטוקינים באמצעות הזרקה הידרודינמית של דנ"א עשוי להיות זול יותר מאשר משלוח באמצעות stroma. עם זאת, הוא חולף באופן דומה עשוי לדרוש יותר מיומנות טכנית מאשר הזרקת intraperitoneal שבועי פשוט נדרש עבור משלוח stroma בתיווך. ביטוי גנטי lentiviral העכבר עשוי לספק פחות traהשיטה המקובלת של משלוח ציטוקינים; עם זאת, בידינו רמות TSLP פיזי לא הושגו. בנוסף, שיטה זו היא עבודה אינטנסיבית, הדורשת ייצור רציף של וקטור lentiviral. עכברים מהונדס או לדפוק ב להציע יציבה לטווח ארוך ביטוי של ציטוקינים והוא יכול להיות מהונדסים עבור ביטוי רקמות ספציפיות, אשר יכול להיות יתרון. מצד שני, הביטוי הטרנסגני של הגן ציטוקינים האדם על רקע עכבר לקוי החיסונית הנדרשת עכברים PDX, מחייב השקעה עצומה של משאבים לפני הערך של המודל הוקם. יתר על כן, מודלים מהונדס אינם מאפשרים בדרך כלל את האפשרות של שינוי העיתוי של חניכה ציטוקינים או רמת הייצור ציטוקינים vivo . אלה יכולים להיות מושגת עם משלוח stroma בתיווך פשוט על ידי שינוי נקודת הזמן ליזום הזרקת תא סטרומה או מינון של תאים סטרומה מוזרק.
התאים סטרומה בתיווך ציטוקין בתיווךOd מפורט כאן שימש לפתח PDX להערכת התפקיד של TSLP ב נורמלי התא האנושי B התפתחות 4 , 6 ו בסיכון גבוה B- תאי לוקמיה לימפובלסטית חריפה. שיטה זו מספקת שיטת חלופה לציטוקינים חלופיים לשימוש בהפקת מודלים דומים עם ציטוקינים אנושיים שאינם TSLP. מודל זה יכול גם להיות שימושי עבור יצירת נתונים ראשוניים שיכולים לעזור לקבוע אם הערך של ציטוקינים מהונדס ציטוקינים או ציטוקין לדפוק ב- PDX המודל יהיה ראוי להשקעה זמן וכסף משמעותי.
Protocol
Representative Results
Discussion
כתב היד מתאר שיטה פשוטה, מהירה, וחסכונית יחסית עבור הנדסת PDX להביע ציטוקינים אנושיים אקסוגניים. האסטרטגיה המתוארת כאן מבוססת על זריקות intraperitoneal שבועי של קו התא stromal transduced להביע את הציטוקין האנושי, TSLP. לפני ביצוע השיטות המתוארות כאן, stroma מהונדסים להביע רמות גבוהות של צי…
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was supported by NIH R21CA162259, NIH R01CA209829, NIH P20 MD006988, NIH 2R25 GM060507, a Hyundai Hope on Wheels Scholar Hope Grant, the Department of Pathology and Human Anatomy, the Department of Basic Sciences, and the Center for Health Disparities and Molecular Medicine at Loma Linda University School of Medicine and by a Grant to Promote Collaborative and Translational Research from Loma Linda University (KJP). The content is solely the responsibility of the authors and does not necessarily represent the official views of the NIH.
Materials
| Wet lab reagents | |||
| T-25 Nunc Cell Culture Treated EasYFlasks, 7 mL capacity, 25cm² culture area | Thermo Scientific / Fisher | 156367 | |
| T-75 Falcon Tissue Culture Treated Flask, 250 mL capacity, 75 cm² culture area & vented cap | Corning Inc. / Fisher | 353136 | |
| T-150 Falcon Tissue Culture Treated Flask, 600 mL capacity, 150 cm² culture area & vented cap | Corning Inc. / Fisher | 355001 | |
| 10 mL serological pipettes | Falcon | 357551 | |
| 15 mL polypropylene conical tubes | Fisher | 05-539-12 | |
| 5 mL round-bottom polystyrene tubes | Falcon | 352054 | |
| 50 mL polypropylene conical tubes | Falcon | 352098 | |
| 2.0 mL cryogenic vials, externally threaded | Corning Inc. / Fisher | 4230659 | |
| 1 mL pipette tips | Fisher | 2707509 | |
| 200 μL pipette tips | Denville Scientific | P3020-CPS | |
| 10 μL pipette tips | Denville Scientific | P-1096-CP | |
| Sterile Disposable Filter Units with SFCA Membrane, Nalgene Rapid-Flow | Fisher | 09-740-28D | |
| 2N H2SO4 | BioLegend | 423001 | |
| Dulbecco’s phosphate-buffered saline (PBS) without calicium and magnesium, 1× | Corning cellgro/ Mediatech | 21-031-CV | |
| Human TSLP ELISA Max Deluxe Set | BioLegend | 434204 | |
| 3% Acetic Acid with Methylene Blue | Stemcell Technologies | 7060 | |
| Trypan Blue | Corning | 25-900-Cl | |
| "Trypsin" 1x 0.25% Trypsin 2.21 mM EDTA in HBSS | ThermoFisher | 25-053 | |
| TWEEN 20 BioXtra | Sigma-Aldrich | P-7949 | |
| “R10” cell culture medium, % of total volume (makes 565 mL) | – | – | Lab Recipe |
| RPMI, 88.5% (500 mL) | Mediatech | 10-040-CV | |
| FBS, 9.9% (56 mL) | Mediatech | 35-011-CV | |
| L-Glutamine, 0.99% (5.6 mL) | Mediatech | 25-005-Cl | |
| Penicillin-Streptomycin, 0.50% (2.8 mL) | Mediatech | 30-002-Cl | |
| 2-Mercaptoethanol, 0.10% (560 µL) | MP | 190242 | |
| “R20” cell culture medium, % of total volume (makes 195 mL) | – | – | Lab Recipe |
| RPMI, 76.84% (150 mL) | see above | see above | |
| FBS, 20.49% (40 mL) | see above | see above | |
| 2mM L-glutamine, 1.02% (2 mL) | see above | see above | |
| 1mM Na pyruvate, 1.02% (2 mL ) | see above | see above | |
| Penicillin-Streptomycin, 0.51% (1 mL) | see above | see above | |
| 2-Mercaptoethanol, 0.10% (0.1 M), 0.10% (200 µL) | see above | see above | |
| “Freezing medium”, % of total volume | – | – | Lab Recipe |
| “R10” medium, 45% | see "R10" recipe | – | |
| FBS, 20% | see above | 35-011-CV | |
| DMSO, 10% | Corning | 25-950-CQC | |
| D(-)(+)-Trehalose dihydrate, 5% | Fisher Scientific | BP2687-100 | |
| Name | Company | Catolog Number | Comments |
| Biologics | |||
| "HS-27" HS-27A human stroma line | ATCC | CRL-2496 | |
| "CALL-4" MHH-CALL-4 cell line, human B cell precursor leukemia | DSMZ | ACC 337 | |
| “NSG mice” NOD.Cg-Prkdcscid Il2rgtm1Wjl/SzJ, male or female, age 6 – 8 weeks | JAX Mice | # 005557 | |
| MUTZ-5 cell line, human B cell precursor leukemia | DSMZ | ACC 490 | |
| Recombinant Human TSLP protein | R&D Systems | 1398-TS-010 | |
| Name | Company | Catolog Number | Comments |
| Flow cytomery antibodies (clone)* | |||
| Anti-mouse CD45 FITC (30F11) | Miltenyi Biotec | 130-102-778 | |
| CD127 PE (MB15-18C9) (alternate name is IL-7Rα) | Miltenyi Biotec | 130-098-094 | |
| CD34 APC (8G12) | BD Biosciences | 340667 | |
| CD45 PE-Cy7 (HI30) | eBioscience | 25-0459 | |
| "FVD" Fixable viability dye eFluor 780 | eBioscience | 65-0865 | |
| Ig κ light chain FITC (G20-193) | BD Pharmingen | 555791 | |
| Ig λ light chain FITC (JDC-12) | BD Pharmingen | 561379 | |
| IgD PE (IA6-2) | BioLegend | 348203 | |
| IgM PE-Cy5 (G20-127) | BD Biosciences | 551079 | |
| pSTAT5 PE, mouse anti-STAT5 (pY694) | BD PhosphoFlow | 612567 | |
| Name | Company | Catolog Number | Comments |
| Other materials & equipment | |||
| Animal Implantable Nano Transponder with Canula | Trovan | ID-100B(1.25) | |
| EMLA lidocaine anesthetic cream (obtain by presciption through animal care facility) | perscription | perscription | |
| BD ½ cc LO-DOSE U-100 Insulin Syringe 28G½ | BD | #329461 | |
| BD Microtainer Tubes with K2EDTA | BD | #365974 | |
| Centrifuge | Beckman Coulter | Alegra X-15R | |
| FisherBrand Capillary Tubes (Heparinized) | Fisher Scientific | 22-260-950 | |
| Hemocytometer | Fisher | 02-671-6 | |
| MACSQuant Analyzer 10 | Miltenyi Biotec | 130-096-343 | |
| Mouse Pie Cage | Braintree Scientific, Inc. | MPC-1 | |
| Mouse Tail Illuminator Restrainer | Braintree Scientific, Inc. | MTI STD | |
| Pistol Grip Implanter | Trovan | IM-300(1.25) | |
| µQuant | Bio-Tek Instruments Inc. | MQX200 | |
| FlowJo flow cytometry analysis software | FlowJo, LLC | Version 10 | |
| *All antibodies are anti-human unless otherwise stated. |
References
- Francis, O. L., Milford, T. A., Beldiman, C., Payne, K. J. Fine-tuning patient-derived xenograft models for precision medicine approaches in leukemia. J Investig Med. 64 (3), 740-744 (2016).
- Parrish, Y. K., et al. IL-7 Dependence in human B lymphopoiesis increases during progression of ontogeny from cord blood to bone marrow. J Immunol. 182 (7), 4255-4266 (2009).
- Johnson, S. E., Shah, N., Panoskaltsis-Mortari, A., LeBien, T. W. Murine and human IL-7 activate STAT5 and induce proliferation of normal human pro-B cells. J Immunol. 175 (11), 7325-7331 (2005).
- Milford, T. A., et al. TSLP or IL-7 provide an IL-7Ralpha signal that is critical for human B lymphopoiesis. Eur J Immunol. 46 (9), 2155-2161 (2016).
- Reche, P. A., et al. Human thymic stromal lymphopoietin preferentially stimulates myeloid cells. J Immunol. 167 (1), 336-343 (2001).
- Francis, O. L., et al. A novel xenograft model to study the role of TSLP-induced CRLF2 signals in normal and malignant human B lymphopoiesis. Haematologica. 101 (4), 417-426 (2016).
- Willinger, T., Rongvaux, A., Strowig, T., Manz, M. G., Flavell, R. A. Improving human hemato-lymphoid-system mice by cytokine knock-in gene replacement. Trends Immunol. 32 (7), 321-327 (2011).
- Graf, L., Iwata, M., Torok-Storb, B. Gene expression profiling of the functionally distinct human bone marrow stromal cell lines HS-5 and HS-27a. Blood. 100 (4), 1509-1511 (2002).
- Follenzi, A., Ailles, L. E., Bakovic, S., Geuna, M., Naldini, L. Gene transfer by lentiviral vectors is limited by nuclear translocation and rescued by HIV-1 pol sequences. Nat Genet. 25 (2), 217-222 (2000).
- Li, M., Husic, N., Lin, Y., Snider, B. J. Production of lentiviral vectors for transducing cells from the central nervous system. J Vis Exp. (63), e4031 (2012).
- Cockrell, A. S., Kafri, T. Gene delivery by lentivirus vectors. Mol Biotechnol. 36 (3), 184-204 (2007).
- Ricardo, R., Phelan, K. Freezing, thawing, and packaging cells for transport. J Vis Exp. (17), (2008).
- Tasian, S. K., et al. Aberrant STAT5 and PI3K/mTOR pathway signaling occurs in human CRLF2-rearranged B-precursor acute lymphoblastic leukemia. Blood. 120 (4), 833-842 (2012).
- Kalaitzidis, D., Neel, B. G. Flow-cytometric phosphoprotein analysis reveals agonist and temporal differences in responses of murine hematopoietic stem/progenitor cells. PLoS One. 3 (11), (2008).
- Machholz, E., Mulder, G., Ruiz, C., Corning, B. F., Pritchett-Corning, K. R. Manual restraint and common compound administration routes in mice and rats. J Vis Exp. (67), (2012).
- Kovacsics, D., Raper, J. Transient expression of proteins by hydrodynamic gene delivery in mice. J Vis Exp. (87), (2014).
- Menon, V., Thomas, R., Ghale, A. R., Reinhard, C., Pruszak, J. Flow cytometry protocols for surface and intracellular antigen analyses of neural cell types. J Vis Exp. (94), (2014).
- Pearson, T., Greiner, D. L., Shultz, L. D. Chapter 15, Creation of "humanized" mice to study human immunity. Curr Protoc Immunol. , (2008).
- Matheu, M. P., Sen, D., Cahalan, M. D., Parker, I. Generation of bone marrow derived murine dendritic cells for use in 2-photon imaging. J Vis Exp. (17), (2008).
- Scheeren, F. A., et al. Thymic stromal lymphopoietin induces early human B-cell proliferation and differentiation. Eur J Immunol. 40 (4), 955-965 (2010).
- Lee, E. B., et al. Increased serum thymic stromal lymphopoietin in children with atopic dermatitis. Pediatr Allergy Immunol. 21 (2 Pt 2), e457-e460 (2010).

