Expressão de citocina exógena em xenotransplantes derivados de pacientes via injeção com uma linha de células estromáticas transduzidas por citocinas
Summary
Descreve-se aqui um método para produzir citoquina exógena em ratinhos de xenoenxerto derivados de doentes (PDX) por meio de injecção intraperitoneal semanal de uma linha de células de estroma transduzidas por citoquinas. Este método alarga a utilidade de PDX e proporciona a opção para a libertação transitória ou prolongada de citoquinas exógenas numa multiplicidade de modelos PDX.
Abstract
Os ratinhos de xenoenxerto derivados de pacientes (PDX) são produzidos por transplante de células humanas em ratinhos deficientes em imunidade. Estes modelos são uma ferramenta importante para o estudo dos mecanismos da hematopoiese normal e maligna e são o padrão-ouro para a identificação de quimioterápias eficazes para muitas malignidades. Os modelos PDX são possíveis porque muitas das citoquinas de rato também actuam em células humanas. No entanto, este não é o caso de todas as citocinas, incluindo muitas que são críticas para o estudo normal e hematopoiese maligna em células humanas. As técnicas que engendram camundongos para produzir citoquinas humanas (modelos transgênicos e knock-in) exigem uma despesa significativa antes que a utilidade do modelo tenha sido demonstrada. Outras técnicas são de trabalho intensivo (injeção de citocinas recombinantes ou lentivírus) e, em alguns casos, exigem altos níveis de especialização técnica (injeção hidrodinâmica de DNA). Este relatório descreve um método simples para a geração de camundongos PDX que possuem células humanas exógenasTokina (TSLP, linfopoietina do estroma tímico) via injecção intraperitoneal semanal de estroma que foram transduzidos para sobre-expressar esta citocina. A utilização deste método proporciona uma fonte in vivo de produção contínua de citoquinas que atinge os níveis fisiológicos de citoquina humana circulante no rato. Os níveis plasmáticos de citoquina humana podem ser variados com base no número de células estromais injectadas, e a produção de citoquinas pode ser iniciada em qualquer ponto da experiência. Este m�odo tamb� inclui ratinhos de controlo negativo de citoquina que s� produzidos de forma semelhante, mas atrav� de injec�o intraperitoneal de estroma transduzido com um vector de controlo. Demonstrou-se previamente que as células de leucemia colhidas a partir de PDX que expressa TSLP, em comparação com PDX de controlo, exibem um padrão de expressão de gene mais parecido com a amostra de paciente original. Juntos, os ratinhos PDX produtores de citoquinas e negativos a citoquinas produzidos por este método proporcionam um sistema modelo que usamos com sucesso para estudar aPapel da TSLP na hematopoiese normal e maligna.
Introduction
Os xenoenxertos derivados de pacientes (PDX) são um poderoso modelo in vivo para estudar a produção de células hematopoiéticas normais e malignas num ambiente mamífero "nativo". Na maioria das vezes, PDX são produzidos por injeção ou transplante de células humanas em ratinhos deficientes imunológicos. A produção de PDX utilizando células estaminais hematopoiéticas humanas normais permite estudos in vivo de sangue humano normal e desenvolvimento de células imunitárias. O PDX produzido a partir de leucemia ou outras células cancerosas torna possível o estudo de mecanismos oncogénicos e a identificação de terapias eficazes no contexto da gama de paisagens genéticas e mutações presentes na população humana. 1 Por conseguinte, PDX são o padrão ouro atual para a investigação biomédica translacional para identificar terapias eficazes e uma ferramenta importante para a compreensão dos mecanismos de progressão do câncer. Os modelos PDX são uma ferramenta essencial para auxiliar a pesquisa em doenças de disparidades de saúde Lesões genéticas ou qualquer doença em que as variações da paisagem genética de um paciente possam contribuir substancialmente para a oncogénese e para o resultado do tratamento.
Os modelos PDX de rato-humanos são possíveis porque muitas citoquinas de murganho imitam adequadamente os seus análogos humanos na activação dos receptores de citoquinas de células humanas enquanto estão dentro do rato. Por exemplo, a interleucina-7 (IL-7) proporciona um sinal crítico para o desenvolvimento de células B humanas. 2 Neste caso, IL-7 de ratinho tem homologia suficiente com IL-7 humana que a citoquina de ratinho estimula vias de sinalização em precursores de células B humanas. Entretanto, este não é o caso da linfopoietina do estroma tímico (TSLP) 5,6 , que entre outras citocinas (IL-3, fator estimulador de colônias de granulócitos-macrófagos (GM-CSF), fator de células estaminais (SCF) ,7 é importante para a produção de células hematopoiéticas humanas normais e malignas Quando as citoquinas humanas e de ratinho apresentam baixa homologia, as citocinas de murganho não activam os seus respectivos receptores em células humanas Para superar este obstáculo foram utilizadas várias estratégias Para desenvolver a expressão de citoquinas humanas em ratinhos PDX, incluindo injecção de citocinas humanas recombinantes, injecção hidrodinâmica de ADN, expressão lentiviral, expressão transgénica e substituição de genes knockin.7 Este relatório descreve um método para a engenharia de PDX para produzir citoquinas humanas através de medicações mediadas por estroma Citoquina ( Figura 1 ).
No m�odo aqui demonstrado, os ratinhos PDX s� manipulados para expressar a citoquina humana, TSLP, ou para servir como controlos negativos para citoquinas. Os PDX que expressam TSLP são conseguidos por injecções intraperitoneais semanais de células estromais que foram transduzidas para expressar níveis elevados de TSLP humana.Os ratinhos PDX de "controlo" de citocinas negativas são igualmente manipulados; Embora o estroma de controlo seja transduzido com um vector de controlo. Este método atinge os níveis fisiológicos normais de TSLP humana em ratinhos PDX injectados com o estroma TSLP +. Nenhuma TSLP detectável é observada em ratinhos PDX que recebem o estroma negativo para citoquina. Nós selecionamos a linha de células de estroma humana HS-27A para nossos estudos porque cresce robustamente em cultura e mostra um nível muito baixo de produção de citocinas que não suporta a proliferação de células progenitoras isoladas em co-culturas. 8 Para a expressão de TSLP humano, o estroma foi transduzido com um vector lentiviral de auto-inactivação de geração avançada derivado de uma estrutura anterior descrita 9 , e inclui o elemento cPPT / cts e o elemento regulador pós-transcricional da hepatite de marmota (WPRE) para aumentar a expressão do transgene. O gene TSLP humano foi construído neste vector sob o controlo do factor de alongamento-1(EF-1) para conseguir uma expressão robusta, constitutiva e de longo prazo.
A engenharia deste modelo de PDX realçado por citocina humana consiste em 4 etapas principais. Primeiro, o estroma transduzido é expandido in vitro e avaliado por ensaio imunoenzimático (ELISA) para produção de citocinas estáveis e de alto nível. Em segundo lugar, verifica-se a actividade da citoquina humana produzida pelas células estromais transduzidas (e falta de actividade das citocinas a partir do estroma de controlo) utilizando citometria de fluxo fosfo. As linhas celulares conhecidas por serem sensíveis à citoquina de interesse (neste caso, TSLP) são incubadas com sobrenadante de células estromais e ensaiadas quanto à fosforilação induzida por citoquinas. Em terceiro lugar, os ratinhos são injectados com estroma humano transduzido e depois o plasma de rato é avaliado por ELISA para níveis de citoquina humana semanalmente. Em quarto lugar, as células hematopoiéticas humanas são transplantadas e os efeitos funcionais in vivo da citoquina humana são avaliados num alvo conhecido ( <em> Eg. População de células).
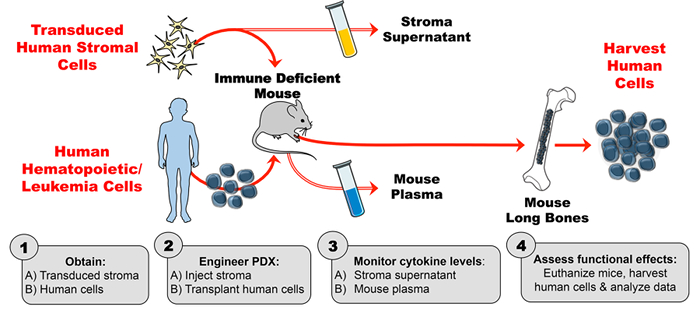
Figura 1: Modelo PDX concebido para produzir citoquina humana exógena em ratinhos. ( 1A ) Experiência de projeto e obtenção de células de estroma humanas transduzidas ( 1B ) Obter células humanas (células-tronco hematopoiéticas, células de leucemia, etc. ) para gerar camundongos PDX (xenoenxertos derivados de pacientes). ( 2A ) Injectar estroma de engenharia e ( 2B ) células humanas de transplante em ratinhos deficientes em imunidade de acordo com o calendário experimental. ( 3A-B ) Monitorizar as concentrações de citoquinas no sobrenadante do estroma e no plasma do rato por ELISA. ( 4 ) Colher células humanas e avaliar os efeitos funcionais in vivo da citoquina humana presente no PDX. Por favor, clique aquiPara ver uma versão maior desta figura.
A entrega de citoquinas humanas através de células estromais oferece vantagens e desvantagens quando comparado com outros métodos de entrega / produção de citoquinas humanas em ratinhos PDX. Em comparação com a injecção de citoquina humana recombinante, a administração mediada por estroma é geralmente menos dispendiosa (o custo da cultura de células do estroma é inferior ao custo da citocina recombinante) e menos intensivo em trabalho (uma injecção por semana versus várias injecções por semana). A questão da meia-vida de citoquinas curtas também é atenuada uma vez que o estroma produz continuamente a citocina exógena. A administração de citoquina através de uma injecção hidrodinâmica de ADN pode ser menos dispendiosa do que a administração através de estroma. No entanto, é similarmente transitória e pode exigir mais habilidade técnica do que a simples injecção intraperitoneal semanal necessária para a entrega mediada por estroma. A express� do gene lentiviral no ratinho pode proporcionarNsient método de entrega de citoquinas; Entretanto, em nossas mãos os níveis fisiológicos de TSLP não foram alcançados. Além disso, este método é intensivo em mão de obra, exigindo produção contínua de vetor lentiviral. Os murganhos transgénicos ou knock-in oferecem expressão a longo prazo estável de citoquina e podem ser manipulados para expressão específica de tecido, o que pode ser uma vantagem. Por outro lado, a expressão transgénica do gene da citoquina humana sobre o fundo de rato imuno deficiente requerido para ratinhos PDX, necessita de um imenso investimento de recursos antes de o valor do modelo ter sido estabelecido. Além disso, os modelos transgénicos não permitem geralmente a opção de variar o momento da iniciação de citoquinas ou o nível de produção de citoquinas in vivo . Estes podem ser conseguidos com a entrega mediada por estroma simplesmente mudando o ponto de tempo para o início da injeção de células estromais ou a dose de células estromais injetadas.
O método de administração de citoquinas mediado por células estromaisOd detalhado aqui foi usado para desenvolver PDX para avaliar o papel da TSLP no desenvolvimento de células B humanas normais 4,6 e leucemia linfoblástica aguda de células B de alto risco. 6 Este método proporciona um método alternativo de administração de citoquinas para utilização na geração de modelos semelhantes com citocinas humanas diferentes da TSLP. Este modelo também pode ser útil para gerar dados preliminares que podem ajudar a determinar se o valor de uma citocina transgénica ou citoquina knock-in PDX modelo seria digno do investimento de tempo e dinheiro substancial.
Protocol
Representative Results
Discussion
Este manuscrito descreve um método simples, rápido e relativamente rentável para a engenharia de PDX para expressar citoquina humana exógena. A estratégia descrita aqui é baseada em injecções intraperitoneais semanais de uma linha de células de estroma transduzidas para expressar a citoquina humana, TSLP. Antes da realização dos métodos aqui descritos, o estroma manipulado para expressar níveis elevados da citocina de interesse (TSLP) e o estroma de controlo manipulado de forma semelhante foram gerados. Nos…
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was supported by NIH R21CA162259, NIH R01CA209829, NIH P20 MD006988, NIH 2R25 GM060507, a Hyundai Hope on Wheels Scholar Hope Grant, the Department of Pathology and Human Anatomy, the Department of Basic Sciences, and the Center for Health Disparities and Molecular Medicine at Loma Linda University School of Medicine and by a Grant to Promote Collaborative and Translational Research from Loma Linda University (KJP). The content is solely the responsibility of the authors and does not necessarily represent the official views of the NIH.
Materials
| Wet lab reagents | |||
| T-25 Nunc Cell Culture Treated EasYFlasks, 7 mL capacity, 25cm² culture area | Thermo Scientific / Fisher | 156367 | |
| T-75 Falcon Tissue Culture Treated Flask, 250 mL capacity, 75 cm² culture area & vented cap | Corning Inc. / Fisher | 353136 | |
| T-150 Falcon Tissue Culture Treated Flask, 600 mL capacity, 150 cm² culture area & vented cap | Corning Inc. / Fisher | 355001 | |
| 10 mL serological pipettes | Falcon | 357551 | |
| 15 mL polypropylene conical tubes | Fisher | 05-539-12 | |
| 5 mL round-bottom polystyrene tubes | Falcon | 352054 | |
| 50 mL polypropylene conical tubes | Falcon | 352098 | |
| 2.0 mL cryogenic vials, externally threaded | Corning Inc. / Fisher | 4230659 | |
| 1 mL pipette tips | Fisher | 2707509 | |
| 200 μL pipette tips | Denville Scientific | P3020-CPS | |
| 10 μL pipette tips | Denville Scientific | P-1096-CP | |
| Sterile Disposable Filter Units with SFCA Membrane, Nalgene Rapid-Flow | Fisher | 09-740-28D | |
| 2N H2SO4 | BioLegend | 423001 | |
| Dulbecco’s phosphate-buffered saline (PBS) without calicium and magnesium, 1× | Corning cellgro/ Mediatech | 21-031-CV | |
| Human TSLP ELISA Max Deluxe Set | BioLegend | 434204 | |
| 3% Acetic Acid with Methylene Blue | Stemcell Technologies | 7060 | |
| Trypan Blue | Corning | 25-900-Cl | |
| "Trypsin" 1x 0.25% Trypsin 2.21 mM EDTA in HBSS | ThermoFisher | 25-053 | |
| TWEEN 20 BioXtra | Sigma-Aldrich | P-7949 | |
| “R10” cell culture medium, % of total volume (makes 565 mL) | – | – | Lab Recipe |
| RPMI, 88.5% (500 mL) | Mediatech | 10-040-CV | |
| FBS, 9.9% (56 mL) | Mediatech | 35-011-CV | |
| L-Glutamine, 0.99% (5.6 mL) | Mediatech | 25-005-Cl | |
| Penicillin-Streptomycin, 0.50% (2.8 mL) | Mediatech | 30-002-Cl | |
| 2-Mercaptoethanol, 0.10% (560 µL) | MP | 190242 | |
| “R20” cell culture medium, % of total volume (makes 195 mL) | – | – | Lab Recipe |
| RPMI, 76.84% (150 mL) | see above | see above | |
| FBS, 20.49% (40 mL) | see above | see above | |
| 2mM L-glutamine, 1.02% (2 mL) | see above | see above | |
| 1mM Na pyruvate, 1.02% (2 mL ) | see above | see above | |
| Penicillin-Streptomycin, 0.51% (1 mL) | see above | see above | |
| 2-Mercaptoethanol, 0.10% (0.1 M), 0.10% (200 µL) | see above | see above | |
| “Freezing medium”, % of total volume | – | – | Lab Recipe |
| “R10” medium, 45% | see "R10" recipe | – | |
| FBS, 20% | see above | 35-011-CV | |
| DMSO, 10% | Corning | 25-950-CQC | |
| D(-)(+)-Trehalose dihydrate, 5% | Fisher Scientific | BP2687-100 | |
| Name | Company | Catolog Number | Comments |
| Biologics | |||
| "HS-27" HS-27A human stroma line | ATCC | CRL-2496 | |
| "CALL-4" MHH-CALL-4 cell line, human B cell precursor leukemia | DSMZ | ACC 337 | |
| “NSG mice” NOD.Cg-Prkdcscid Il2rgtm1Wjl/SzJ, male or female, age 6 – 8 weeks | JAX Mice | # 005557 | |
| MUTZ-5 cell line, human B cell precursor leukemia | DSMZ | ACC 490 | |
| Recombinant Human TSLP protein | R&D Systems | 1398-TS-010 | |
| Name | Company | Catolog Number | Comments |
| Flow cytomery antibodies (clone)* | |||
| Anti-mouse CD45 FITC (30F11) | Miltenyi Biotec | 130-102-778 | |
| CD127 PE (MB15-18C9) (alternate name is IL-7Rα) | Miltenyi Biotec | 130-098-094 | |
| CD34 APC (8G12) | BD Biosciences | 340667 | |
| CD45 PE-Cy7 (HI30) | eBioscience | 25-0459 | |
| "FVD" Fixable viability dye eFluor 780 | eBioscience | 65-0865 | |
| Ig κ light chain FITC (G20-193) | BD Pharmingen | 555791 | |
| Ig λ light chain FITC (JDC-12) | BD Pharmingen | 561379 | |
| IgD PE (IA6-2) | BioLegend | 348203 | |
| IgM PE-Cy5 (G20-127) | BD Biosciences | 551079 | |
| pSTAT5 PE, mouse anti-STAT5 (pY694) | BD PhosphoFlow | 612567 | |
| Name | Company | Catolog Number | Comments |
| Other materials & equipment | |||
| Animal Implantable Nano Transponder with Canula | Trovan | ID-100B(1.25) | |
| EMLA lidocaine anesthetic cream (obtain by presciption through animal care facility) | perscription | perscription | |
| BD ½ cc LO-DOSE U-100 Insulin Syringe 28G½ | BD | #329461 | |
| BD Microtainer Tubes with K2EDTA | BD | #365974 | |
| Centrifuge | Beckman Coulter | Alegra X-15R | |
| FisherBrand Capillary Tubes (Heparinized) | Fisher Scientific | 22-260-950 | |
| Hemocytometer | Fisher | 02-671-6 | |
| MACSQuant Analyzer 10 | Miltenyi Biotec | 130-096-343 | |
| Mouse Pie Cage | Braintree Scientific, Inc. | MPC-1 | |
| Mouse Tail Illuminator Restrainer | Braintree Scientific, Inc. | MTI STD | |
| Pistol Grip Implanter | Trovan | IM-300(1.25) | |
| µQuant | Bio-Tek Instruments Inc. | MQX200 | |
| FlowJo flow cytometry analysis software | FlowJo, LLC | Version 10 | |
| *All antibodies are anti-human unless otherwise stated. |
References
- Francis, O. L., Milford, T. A., Beldiman, C., Payne, K. J. Fine-tuning patient-derived xenograft models for precision medicine approaches in leukemia. J Investig Med. 64 (3), 740-744 (2016).
- Parrish, Y. K., et al. IL-7 Dependence in human B lymphopoiesis increases during progression of ontogeny from cord blood to bone marrow. J Immunol. 182 (7), 4255-4266 (2009).
- Johnson, S. E., Shah, N., Panoskaltsis-Mortari, A., LeBien, T. W. Murine and human IL-7 activate STAT5 and induce proliferation of normal human pro-B cells. J Immunol. 175 (11), 7325-7331 (2005).
- Milford, T. A., et al. TSLP or IL-7 provide an IL-7Ralpha signal that is critical for human B lymphopoiesis. Eur J Immunol. 46 (9), 2155-2161 (2016).
- Reche, P. A., et al. Human thymic stromal lymphopoietin preferentially stimulates myeloid cells. J Immunol. 167 (1), 336-343 (2001).
- Francis, O. L., et al. A novel xenograft model to study the role of TSLP-induced CRLF2 signals in normal and malignant human B lymphopoiesis. Haematologica. 101 (4), 417-426 (2016).
- Willinger, T., Rongvaux, A., Strowig, T., Manz, M. G., Flavell, R. A. Improving human hemato-lymphoid-system mice by cytokine knock-in gene replacement. Trends Immunol. 32 (7), 321-327 (2011).
- Graf, L., Iwata, M., Torok-Storb, B. Gene expression profiling of the functionally distinct human bone marrow stromal cell lines HS-5 and HS-27a. Blood. 100 (4), 1509-1511 (2002).
- Follenzi, A., Ailles, L. E., Bakovic, S., Geuna, M., Naldini, L. Gene transfer by lentiviral vectors is limited by nuclear translocation and rescued by HIV-1 pol sequences. Nat Genet. 25 (2), 217-222 (2000).
- Li, M., Husic, N., Lin, Y., Snider, B. J. Production of lentiviral vectors for transducing cells from the central nervous system. J Vis Exp. (63), e4031 (2012).
- Cockrell, A. S., Kafri, T. Gene delivery by lentivirus vectors. Mol Biotechnol. 36 (3), 184-204 (2007).
- Ricardo, R., Phelan, K. Freezing, thawing, and packaging cells for transport. J Vis Exp. (17), (2008).
- Tasian, S. K., et al. Aberrant STAT5 and PI3K/mTOR pathway signaling occurs in human CRLF2-rearranged B-precursor acute lymphoblastic leukemia. Blood. 120 (4), 833-842 (2012).
- Kalaitzidis, D., Neel, B. G. Flow-cytometric phosphoprotein analysis reveals agonist and temporal differences in responses of murine hematopoietic stem/progenitor cells. PLoS One. 3 (11), (2008).
- Machholz, E., Mulder, G., Ruiz, C., Corning, B. F., Pritchett-Corning, K. R. Manual restraint and common compound administration routes in mice and rats. J Vis Exp. (67), (2012).
- Kovacsics, D., Raper, J. Transient expression of proteins by hydrodynamic gene delivery in mice. J Vis Exp. (87), (2014).
- Menon, V., Thomas, R., Ghale, A. R., Reinhard, C., Pruszak, J. Flow cytometry protocols for surface and intracellular antigen analyses of neural cell types. J Vis Exp. (94), (2014).
- Pearson, T., Greiner, D. L., Shultz, L. D. Chapter 15, Creation of "humanized" mice to study human immunity. Curr Protoc Immunol. , (2008).
- Matheu, M. P., Sen, D., Cahalan, M. D., Parker, I. Generation of bone marrow derived murine dendritic cells for use in 2-photon imaging. J Vis Exp. (17), (2008).
- Scheeren, F. A., et al. Thymic stromal lymphopoietin induces early human B-cell proliferation and differentiation. Eur J Immunol. 40 (4), 955-965 (2010).
- Lee, E. B., et al. Increased serum thymic stromal lymphopoietin in children with atopic dermatitis. Pediatr Allergy Immunol. 21 (2 Pt 2), e457-e460 (2010).

