Analyse der Mineralien von hFOB 1.19 produziert und Saos-2 Zellen mittels Transmissions-Elektronenmikroskopie mit Energy Dispersive x-ray Mikroanalyse
Summary
Wir präsentieren Ihnen ein Protokoll, um den Zustand der Mineralien in Vesikeln veröffentlicht von zwei menschlichen Knochen Zelllinien zu vergleichen: hFOB 1,19 und Saos-2. Ihre Mineralisierung Profile wurden von Alizarin rot-S (AR-S) Färbung, ultravioletten (UV) Licht Visualisierung, Übertragung Elektronenmikroskopie (TEM) Bildgebung und Energie dispersiven Röntgen-Mikroanalyse (EDX) analysiert.
Abstract
Dieses Video zeigt die Verwendung von Transmissions-Elektronenmikroskopie mit Energy dispersive x-ray Mikroanalyse (TEM-EDX), den Zustand der Mineralien in Vesikeln veröffentlicht von zwei menschlichen Knochen Zelllinien zu vergleichen: hFOB 1,19 und Saos-2. Diese Zell-Linien, nach der Behandlung mit Ascorbinsäure (AA) und β-glycerophosphat (β-GP), komplette osteogene Transdifferenzierung von Verbreitung, Mineralisierung zu unterziehen und produzieren Matrix Vesikel (MVs), die Apatit Keimbildung bei Auslösen der extrazelluläre Matrix (ECM).
Basierend auf Alizarin rot-S (AR-S) Färbung und Analyse der Zusammensetzung von Mineralien in Zelle Lysates mit ultraviolettem (UV) Licht oder in Vesikeln TEM Bildgebung gefolgt von EDX-Quantifizierung und Ionen-Mapping verwenden, können wir daraus schließen, dass Osteosarkom Saos-2 und osteoblastischen hFOB 1.19 Zellen zeigen unterschiedliche Mineralisierung Profile. Saos-2 Zellen effizienter als hFOB 1.19 Zellen mineralisieren und produzieren größere mineralische Ablagerungen, die nicht unter UV-Licht sichtbar, aber ähneln Hydroxylapatit (HA), dass sie mehr Ca und F Vertretungen haben.
Die erzielten Ergebnisse mit diesen Techniken ermöglichen uns zu dem Schluss, dass der Prozess der Mineralisierung unterscheidet sich je nach Zelltyp. Wir schlagen vor, dass auf zellulärer Ebene, die Herkunft und die Eigenschaften von Vesikeln die Art der Mineralien bestimmen.
Introduction
Knochen ist eine Art von Bindegewebe besteht aus zwei Teilen: Bio (Zellen und Kollagenfasern) und Mineralien (Calcium und Phosphat-Verbindungen). Die mineralischen Hauptbestandteile in den Knochen sind Apatite1. Verschiedene Arten von Mineralisierung-kompetente Zellen in Knochen (Osteoblasten), Zähne (Odontoblasts) und im Knorpel (Chondrozyten) regulieren die ersten Schritte der Mineralisierung durch Produktion von Proteinen der extrazellulären Matrix (ECM) und loslassen matrix Vesikel (MVs) (Abbildung 1). MVs sind 100-300 nm Durchmesser Vesikel, die Calcium- und Phosphatspiegel, die Erleichterung der Apatit Keimbildung zu sammeln und anschließend binden an Kollagen2,3. Dann zerfallen MVs Apatite auf das extrazelluläre Medium lösen. Die Apatite weiterhin in Kontakt mit Kollagenfasern wachsen und bilden der Knochenmatrix. Die Mineralisierung wird durch die konstante Versorgung mit Pich und Ca2 + im extrazellulären Medium getragen. Einige kürzlich veröffentlichten Daten unterstützen unsere Modell-4,–5. Weichteile nicht unter physiologischen Bedingungen mineralisieren. Ektopische Verkalkung kann jedoch unter pathologischen Bedingungen wie Gefäßverkalkung3auftreten. Vaskuläre Zellen, die Osteoblasten Phänotyp erwerben können MVs produzieren, die Keimbildung von Apatite zu induzieren und Mineralisierung in den medialen und Intima Schichten der Wand der Blutgefäße zu initiieren. Seit ektopische Verkalkung ähneln normalen Endochondral Mineralisierung3, Verständnis der molekularen Mechanismen der Mineralisierung der Knochen Zellen und Chondrozyten sollen einige Hinweise auf ektopische Verkalkung der Weichteile, die gebildet.
Die Entwicklung des skelettartigen Gewebe wird durch verschiedene Enzyme, Wachstumsfaktoren und Promotoren oder Inhibitoren der Mineralisierung geregelt. Die Antagonistische Wirkung der Gewebe-unspezifische alkalische Phosphatase (TNAP) (Abbildung 1) und Ectonucleotide Pyrophosphatase/Phosphodiesterase kontrolliert ich (NPP1), zusammen mit Ankyrin (ANK), anorganisches Pyrophosphat (PPich) Konzentration 6. PPich, ein potenter Inhibitor der HA-Formation ist hydrolysiert durch TNAP; NPP1 hydrolysiert Nukleotid Triphosphate um PPich zu bilden, während ANK PPich in das ECM aus der Zelle exportiert. Das Verhältnis von Pi/PPi kann Apatit Bildung7,8 mit möglichen pathologischen folgen9regulieren.
Die MV-Membran ist in Ionen-Transport-Proteine angereichert, die die erste Ausfällung von Kalzium und Phosphat im Inneren der MVs bei der Keimbildung (Abbildung 1) zu erleichtern. Die Phosphat-Transporter 1 (PiT) hilft, um Pich erzeugt im Perivesicular Raum in der MVs10,11zu integrieren. Polymerasen können beteiligt sein, in die Bindung und den Transport von Ca2 + und in den biophysikalischen Prozess, der Mineralisierung in der MV Lumen12,13initiiert. Wir favorisieren die Hypothese vorgeschlagen, für die Mineralisierung innerhalb Intrazytoplasmatische Vesikel des internen Keimbildung von Apatit innerhalb der MV vor ihrer Ausbreitung in der ECM-14,–15. In-vitro- Modellierung bestätigt die Induktion von Ca2 +/ pich komplexe Bildung in Proteoliposomes aus PS und AnxA516hergestellt. Dies kann darauf hindeuten, dass Akkumulation von Ca2 +, Pich, AnxA5 und PS-komplexe in Lipid Rafts der Mikrovilli-wie Membranesrepresent der Keimbildung Kern (NC) Apatit innerhalb MVs. Polymerasen und TNAP besitzen auch Kollagen-Bindung Kapazitäten, die möglicherweise hilfreich bei der Platzierung von MVs entlang Kollagenfasern und bei der Förderung der Ausbreitung von Mineralisierung in der ECM. Fetuin-A und Osteopontin (OPN)17, sind bekannt als Inhibitoren der Apatit-Formation, die die Ausbreitung der Mineralisierung auf dem kollagenen Gerüst verlangsamen kann. Keimbildung und Vermehrung sind unterschiedliche Veranstaltungen, erstere vor dem letzteren, und sowohl für den Prozess der pathologischen Mineralisierung relevant sein können.
Um herauszufinden, wie die Chemie des Calcium-Phosphat-komplexen physiologischen Mineralisierung und ektopische Verkalkung ändern kann, ist es notwendig, die Mineralien produziert von Zellen zu identifizieren. Apatite sind eine Gruppe von Kalzium und Phosphat enthalten Mineralien mit dem allgemeinen Kristall Zelle Formel Ca10(PO4)6X2, wobei X = Cl, F, OH. Sie gelten als18folgt: Fluorapatit (FA) Ca10(PO4)6F2, Chlorapatite (CA) Ca10(PO4)6Cl2 und Hydroxylapatit (HA) Ca10(PO4 ),6(OH)2.
Die Wahl der Osteoblasten Zelllinien induzieren MINERALBILDUNG ist entscheidend, denn jede Zelllinie ein klares Profil der Mineralisierung zeigt. In diesem Bericht verglichen wir die Keimbildung der Mineralien von zwei ausgewählten menschlichen zellmodelle Mineralisierung: osteoblastischen hFOB 1.19 und Osteosarkom Saos-2 Zellen. Osteosarkom-abgeleitete Zellen werden häufig als osteoblastischen Modelle verwendet und Saos-2 Zellen haben die reifsten osteoblastischen Charakter19 beibehalten, während undifferenzierte menschlichen fetalen hFOB Zellen häufig als Modell für normale osteoblastischen verwendet werden Differenzierung-20. Ihre Mineralisierung Profile wurden mit verschiedenen Methoden analysiert: Alizarin rot-S (AR-S) Färbung, ultravioletten (UV) Licht Visualisierung Übertragung Elektronenmikroskopie (TEM) Bildgebung, Energy dispersive x-ray Mikroanalyse (EDX) Quantifizierung und Ion Mapping. Der Vorteil von TEM-EDX über alternative Techniken verwendet in früheren Studien ist, dass es quantitative und qualitative Ergebnisse der Ionen-Austausch in Apatit Kristalle4,5,21 gibt. Das übergeordnete Ziel der Verwendung von TEM-EDX war, eine einfache Methode für Bildgebung und Quantifizierung der Verteilung von Ca, F und Cl-Ionen in verschiedenen Mineralien aus verschiedenen Arten von Zellen während der Phasen des Prozesses Mineralisierung zu finden. Diese Methode erfolgreich, zum Beispiel dient zur Überwachung der Wechselwirkung von Zink-Nanopartikel mit verschiedenen Chemikalien und ihre kombinierte Wirkung auf Wasserorganismen22. In einer weiteren Studie, ein Kupfer Photocatalyst auf Titan-Materialien in wässriger Lösung ausführlich zeichnete sich durch optische emissionsspektrometrie induktiv gekoppelte Plasma (ICP-OES), N2 Physisorption (BET), XRD, UV-Vis-DRS, FT-IR, Raman Spektroskopie, TEM-EDX und photoelektrochemische Messungen23. Unser Ziel war es, die Herkunft und Eigenschaften der Vesikel und Mineralien in beiden Zelllinien, den Mechanismus zu verstehen, der Mineralisierung im knöchernen Differenzierung steuert zu vergleichen.
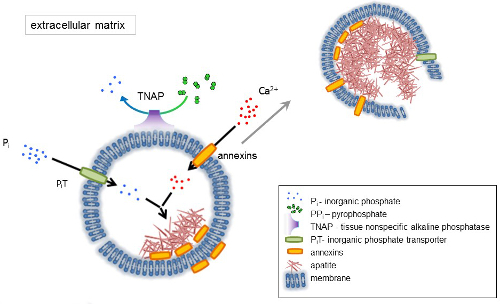
Abbildung 1 . Schema der ersten Schritte der Mineralisierung im knöchernen Zellen mit der Synthese von Proteinen der extrazellulären Matrix (ECM) und Freisetzung von Matrix Vesikel (MVs) aus der Membran. MVs akkumulieren Kalzium durch die Einwirkung von Kalzium-bindende Proteine, Polymerasen und Phosphat, durch das Wirken des ein anorganisches Phosphat-Transporter (PiT) gefolgt von der Aktivität der Gewebe-unspezifische alkalische Phosphatase (TNAP), dem dephosphorylates PPich Pich, wodurch Apatit Keimbildung. Dann MVs zerfallen und freigeben Apatite auf das extrazelluläre Medium. Die Mineralisierung wird durch die konstante Versorgung mit Pich und Ca2 + in der extrazellulären mittlere4,5getragen. Bitte klicken Sie hier für eine größere Version dieser Figur.
Protocol
Representative Results
Discussion
In der aktuellen Zeitung beschrieben wir die Protokolle für AR-S Färbung, UV Licht Identifizierung von Fluorapatit und TEM-EDX in Vitro Imaging von MVs durch Mineralisierung Zellen freigesetzt und Mineralien produziert von MVs. Es ist möglich, alle Methoden, die oben genannten folgen einige allgemeine Schritte zur Problembehandlung. Um optimale Ergebnisse zu erzielen, sollten mehrere kritische Schritte sorgfältig durchgeführt werden. Erstens ist es besser, hinzuzufügen, dass AA (das saure) gefolgt…
Disclosures
The authors have nothing to disclose.
Acknowledgements
MK und ASK manuelle Operationen durchgeführt und LB Zeichnungen vorbereitet und den Film gemacht. ASK schrieb das Manuskript LB schrieb das Drehbuch und MK vorbereitet in der Tabelle. SM, RB und SP lesen kritisch der Tabelle, die Schrift und das Manuskript. Die Autoren möchte Hanna Chomontowska für ihre hervorragende Unterstützung mit ultramicrotomy und Szymon Suski sowie Henryk Bilski für ihre hervorragende Unterstützung mit TEM-EDX-Analyse danken. Die Autoren möchte Dr. Patrick Groves für professionelle Englisch Korrektur und Barbara Sobiak zur Erfassung der Anweisungen zu danken.
Diese Arbeit wurde von Grant N N401 140639 aus dem polnischen Ministerium für Wissenschaft und Hochschulwesen, ASK, durch Zuschüsse aus dem National Science Centre, Polen 2016/23/N/NZ4/03313 LB und 2016/23/N/NZ1/02449, MK, EU FP7 Projekt BIOIMAGINE unterstützt. : BIO-IMAGing in Forschung, INnovation und Bildung, GA Nr. 264173, und durch die gesetzlichen Mittel von der Nencki Instituts für Experimentelle Biologie, Polnische Akademie der Wissenschaften.
Materials
| Reagent | |||
| Ham’s DMEM/F12 media mixture | PAA | E15-813 | 1:1, for human fetus hFOB 1.19 SV40 large T antigen transfected osteoblasts (ATCC CRL-11372) |
| McCoy’s 5A medium | PAA | E82312-0025 | for human osteosarcoma Saos-2 cells (ATCC HTB-85) |
| Antibiotics mixture (penicillin/streptomycin) | Sigma | P0781-100ML | 100 U/mL each |
| G-418 | Sigma | 68168 | 0.3 mg/mL |
| FBS | Gibco | 10270 | 10% for hFOB 1.19 and 15% for Saos-2 |
| AA | Sigma | A-5960 | 50 µg/mL |
| ß-GP | Sigma | G9422-100G | 7.5 mM |
| Bio-Gel HTP Gel | Bio-Rad | 130-0420 | for HA |
| FA | synthesized by us | ||
| CA | synthesized by us | ||
| Sodium phosphate buffer Na2HPO4/NaH2PO4 mixture | Sigma | S7907/S8282 | 0.1 M, pH 7.2 |
| PBS | pH 7.0, prepared by us | ||
| AR-S in PBS | Sigma | A5533-25G | 0.5 g/100 mL, pH 5.0 |
| Collagenase type IA | Sigma | C2674 | 500 U/mL |
| SCL buffer | prepared by us | ||
| Deionized wather | produced by us | ||
| Ethanol | POCh | BA6480111 | absolut 99.8% and solutions 25, 50, 75, 90% |
| Uranyl acetate in 50% ethanol | Polysciences Inc. | 21447-25 | 0.25 g/10 mL |
| PD medium | pH 7.4, prepared by us | ||
| Fixation mixture (paraformaldehyde/glutaraldehyde) | Sigma | 158127/G-6257 | 3%:1% |
| Post-fixation OsO4 | Sigma | 75633 | 1% |
| LR White resin in ethanol | Polysciences Inc. | 17411-MUNC 500g | 1:2, 1:1, 100% |
| Acetone | CHEMPUR | 111024800 | pure |
| Tool | |||
| Cryogenic vials | Corning Inc. | 430487 | 1.2 mL |
| Plastic Petri culture dishes | Falcon | 353003 | 100 mm |
| Plastic tubes | Falcon | 352096 and 352070 | 15 and 50 mL |
| Serological pipettes | Falcon and VWR | 357521 and 612-3700 | 1 and 10 mL |
| Plastic microcentrifuge tubes | Sigma | Z688312 and Z628034 | 1.5 mL black and 2 mL transparent |
| Plastic tips | VWR | 613-0364, 613-0239 and 613-1050 | 0.1-10 µL natural, 1-200 µL yellow and 200-1000 µL blue |
| Plastic racks | Light Labs | A-7055-Z, A-7053-C | green for tubes, orange for micro tubes and blue for TEM probes |
| Laminar Hera Save | Thermo Scientific Co. | KS12 | HEPA filter (H14 according to DIN EN 1822) |
| Incubators Hera Cell | Thermo Scientific Co. | 150 | 34°C for hFOB 1.19 and 37°C for Saos-2 |
| Fume hood | POLON | WCS-2 | for TEM stainings |
| Glass bottles | SIMAX | 1632414501050 and 1632414501100 | 50 and 100 mL |
| Quartz glass tubes | SIMAX | 638422010100 | Ø 10 mm, L 100 mm |
| Pump | IBS Integra Biosciences | VACUSAFE comfort | for vacuum |
| Oven | Memmert | UNE 400 | 56°C |
| Porcelain multi-well plate | Rosenthal technik | 229/12 | 12 wells |
| Glass beakers | SIMAX | 632417010025 | 25 mL |
| Glass bottles | Pocord | DIN22 | 10 mL |
| Plastic box | Agar Scientific Ltd. | for darkness | |
| Snap Fit Gelatin Capsules | Agar Scientific Ltd. | G3741 | size 1 |
| Formvar/Carbon 300 Mesh Ni grids in box | Agar Scientific Ltd. | S162N3 | film on the shiny side |
| Silicon cell scraper | Sigma | SIAL0010-100EA | size 1.8/25 cm |
| Syringe with needle | BogMark | 007 | syringe 1 mL 40 U, needle 0.5 x 16 |
| Syringe | Chirana | CH005L | 5 mL |
| Centrifuge | MPW Medical Instruments | MPW-350R | 130 x g and 500 x g |
| UV transluminator | UVP | M-20 | for visible and UV light |
| Ultramicrotome | LKB | NOVA | 700Å sections |
| Block holder | LKB | E6711 | round shape |
| Diamond knife | DiATOME | Ultra 45° | size 3 |
| Eyelash holder | bovine, prepared by us | ||
| Forceps | ROTH | 2855.1 | antistatic for grids |
| Spatulas set | ROTH | E286.1 | antistatic for powders |
| Imaging | |||
| Inverted Light Microscope | Zeiss with Canon | AxioObserver Z1 equipped with PowerShot G9 | Phase contrast, Transmitted light, 20 x objective, RGB filters |
| Transmission Electron Microscope | TEM Jeol Co. with Oxford Instruments and SiS-Olympus | JEM-1400 TEM equipped with full range INCA Energy Dispersive X-ray microanalysis (EDX) System and 11 Megapixel MORADA G2 camera | magnification 50,000X for TEM and 15,000X for STEM and EDX |
| Camera body and lenses | Nikon | Nikon D7100 Nikkor AF Micro 105 mm f/2.8D Nikkor AF-S 50 mm f/1.8G Nikkor AF 28 mm f/2.8D |
for movie recordings |
| Microphone | MXL Mics | Tempo | for voice recordings |
References
- Buckwalter, J. A., Cooper, R. R. Bone structure and function. Instr. Course Lect. 36, 27-28 (1987).
- Anderson, H. C. Molecular biology of matrix vesicles. Clin. Orthop. Relat. Res. 314, 266-280 (1995).
- Anderson, H. C. Matrix vesicles and calcification. Curr Rheumatol. 5 (3), 222-226 (2003).
- Bolean, M., Simão, A. M. S., Barioni, M. B., Favarin, B. Z., Sebinelli, H. G., Veschi, E. A., Janku, T. A. B., Bottini, M., Hoylaerts, M. F., Itri, R., Millán, J. L., Ciancaglini, P. Biophysical aspects of biomineralization. Biophys Rev. 9 (5), 747-760 (2017).
- Bottini, M., Mebarek, S., Anderson, K. L., Strzelecka-Kiliszek, A., Bozycki, L., Simão, A. M. S., Bolean, M., Ciancaglini, P., Bandorowicz Pikula, J., Pikula, S., Magne, D., Volkmann, N., Hanein, D., Millán, J. L., Buchet, R. Matrix vesicles from chondrocytes and osteoblasts: Their biogenesis, properties, functions and biomimetic models. Biochim Biophys Acta. 1862 (3), 532-546 (2018).
- Hessle, L., Johnson, K. A., Anderson, H. C., Narisawa, S., Sali, A., Goding, J. W., Terkeltaub, R., Millan, J. L. Tissue-nonspecific alkaline phosphatase and plasma cell membrane glycoprotein-1 are central antagonistic regulators of bone mineralization. Proc. Natl. Acad. Sci. U. S. A. 99 (14), 9445-9449 (2002).
- Garimella, R., Bi, X., Anderson, H. C., Camacho, N. P. Nature of phosphate substrate as a major determinant of mineral type formed in matrix vesicle-mediated in vitro mineralization: An FTIR imaging study. Bone. 38 (6), 811-817 (2006).
- Thouverey, C., Bechkoff, G., Pikula, S., Buchet, R. Inorganic pyrophosphate as a regulator of hydroxyapatite or calcium pyrophosphate dihydrate mineral deposition by matrix vesicles. Osteoarthr. Cartil. 17, 64-72 (2009).
- Terkeltaub, R. A. Inorganic pyrophosphate generation and disposition in pathophysiology. Am. J. Phys. 281 (1), 1-11 (2001).
- Guicheux, J., Palmer, G., Shukunami, C., Hiraki, Y., Bonjour, J. P., Caverzasio, J. A novel in vitro culture system for analysis of functional role of phosphate transport in endochondral ossification. Bone. 27 (1), 69-74 (2000).
- Yadav, M. C., Bottini, M., Cory, E., Bhattacharya, K., Kuss, P., Narisawa, S., Sah, R. L., Beck, L., Fadeel, B., Farquharson, C., Millán, J. L. Skeletal mineralization deficits and impaired biogenesis and function of chondrocyte-derived matrix vesicles in Phospho1(-/-) and Phospho1/Pi t1 double-knockout mice. J. Bone Miner. Res. 31 (6), 1275-1286 (2016).
- Thouverey, C., Malinowska, A., Balcerzak, M., Strzelecka-Kiliszek, A., Buchet, R., Dadlez, M., Pikula, S. Proteomic characterization of biogenesis and functions of matrix vesicles released from mineralizing human osteoblast-like cells. J. Proteome. 74 (7), 1123-1134 (2011).
- Wang, W., Xu, J., Kirsch, T. Annexin-mediated Ca2+ influx regulates growth plate chondrocyte maturation and apoptosis. J. Biol. Chem. 278 (6), 3762-3769 (2003).
- Nollet, M., Santucci-Darmanin, S., Breuil, V., et al. Autophagy in osteoblasts is involved in mineralization and bone homeostasis. Autophagy. 10 (11), 1965-1977 (2014).
- Boonrungsiman, S., Gentleman, E., Carzaniga, R., Evans, N. D., McComb, D. W., Porter, A. E., Stevens, M. M. The role of intracellular calcium phosphate in osteoblast-mediated bone apatite formation. Proc. Natl. Acad. Sci. U. S. A. 109 (35), 14170-14175 (2012).
- Genge, B. R., Wu, L. N., Wuthier, R. E. In vitro modeling of matrix vesicle nucleation: synergistic stimulation of mineral formation by annexin A5 and phosphatidylserine. J. Biol. Chem. 282 (36), 26035-26045 (2007).
- Jahnen-Dechent, W., Schäfer, B., Ketteler, M., McKee, M. D. Mineral chaperones: a role for fetuin-A and osteopontin in the inhibition and regression of pathologic calcification. J. Mol. Med. (Berl). 86 (4), 379-389 (2008).
- Suchanek, W., Yoshimura, M. Processing and properties of hydroxyapatite-based biomaterials for use as hard tissue replacement implants. J. Miner. Res. 13 (1), 94-117 (1998).
- Pautke, C., Schieker, M., Tischer, T., Kolk, A., Neth, P., Mutschler, W., Milz, S. Characterization of osteosarcoma cell lines MG-63, Saos-2 and U-2 OS in comparison to human osteoblasts. Anticancer Res. 24 (6), 3743-3748 (2004).
- Yen, M. -. L., Chien, C. -. C., Chiu, I. -. M., Huang, H. -. I., Chen, Y. -. C., Hu, H. -. I., Yen, B. L. Multilineage differentiation and characterization of the human fetal osteoblastic 1.19 cell line: a possible in vitro model of human mesenchymal progenitors. Stem Cells. 25 (1), 125-131 (2007).
- Brittle, S. W., Foose, D. P., O’Neil, K. A., Sikon, J. M., Johnson, J. K., Stahler, A. C., Ryan, J. D., Higgins, S. R., Sizemore, I. E. A raman-based imaging method for characterizing the molecular adsorption and spatial distribution of silver nanoparticles to hydrated mineral surfaces. Environ Sci Technol. , (2018).
- Liu, N., Wang, Y., Ge, F., Liu, S., Xiao, H. Antagonistic effect of nano-ZnO and cetyltrimethyl ammonium chloride on the growth of Chlorella vulgaris: Dissolution and accumulation of nano-ZnO. Chemosphere. 196, 566-574 (2018).
- Tasbihi, M., Kočì, K., Troppová, I., Edelmannová, M., Reli, M., Čapek, L., Schomäcker, R. Photocatalytic reduction of carbon dioxide over Cu/TiO2 photocatalysts. Environ Sci Pollut Res Int. , (2017).
- Chen, N. X., O’Neill, K. D., Chen, X., Moe, S. M. Annexin-Mediated Matrix Vesicle Calcification in Vascular Smooth Muscle Cells. J. Bone Miner. Res. 23 (11), 1798-1805 (2008).
- Strzelecka-Kiliszek, A., Bozycki, L., Mebarek, S., Buchet, R., Pikula, S. Characteristics of minerals in vesicles produced by human osteoblasts hFOB 1.19 and osteosarcoma Saos-2 cells stimulated for mineralization. J. Inorg. Bioch. 171, 100-107 (2017).
- Thouverey, C., Strzelecka-Kiliszek, A., Balcerzak, M., Buchet, R., Pikula, S. Matrix vesicles originate from apical membranę microvilli of mineralizing osteoblast-like Saos-2 cells. J. Cell. Biochem. 106 (1), 127-138 (2009).
- Cazalbou, S., Eichert, D., Ranz, X., Drouet, C., Combes, C., Harmand, M. F., Rey, C. Ion exchanges in apatites for biomedical application. J. Mater. Sci. Mater. Med. 16 (5), 405-409 (2005).
- Kraus, D. Consolidated data analysis and presentation using an open-source add-in for the Microsoft Excel® spreadsheet software. Med. Writ. 23 (1), 25-28 (2014).
- Kawasaki, K., Buchanan, A. V., Weiss, K. M. Biomineralization in humans: making the hard choices in life. Annu. Rev. Genet. 43, 119-142 (2009).
- Bonucci, E. Bone mineralization. Front. Biosci. 17, 100-128 (2012).
- Veis, A., Dorvee, J. R. Biomineralization mechanisms: A new paradigm for crystal nucleation in organic matrices. Calcif. Tissue Int. 93 (4), 307-315 (2013).
- Nudelman, F., Lausch, A. J., Sommerdijk, N. A., Sone, E. D. In vitro models of collagen biomineralization. J. Struct. Biol. 183 (2), 258-269 (2013).
- Alliston, T. Biological regulation of bone quality. Curr. Osteoporos. Rep. 12 (3), 366-375 (2014).
- Wang, W., Kirsch, T. Retinoic acid stimulates annexin-mediated growth plate chondrocyte mineralization. J. Cell Biol. 157 (6), 1061-1069 (2002).
- Wang, W., Xu, J., Kirsh, T. Annexin V and terminal differentiation of growth plate chondrocytes. Exp. Cell Res. 305 (1), 156-165 (2005).

