Analyse av mineraler produsert av hFOB 1,19 og Saos-2 celler ved hjelp av overføring elektronmikroskop med energi dispersiv X-ray Microanalysis
Summary
Vi presenterer en protokoll for å sammenligne tilstanden til mineraler i blemmer utgitt av to menneskelig bein linjer: hFOB 1,19 og Saos-2. Deres mineralisering profiler ble analysert av Alizarin Red-S (AR-S) flekker, ultrafiolett (UV) lys visualisering, overføring elektronmikroskop (TEM) bildebehandling og energi dispersiv X-ray microanalysis (EDX).
Abstract
Denne videoen viser bruk av overføring elektronmikroskop med energi dispersiv X-ray microanalysis (TEM-EDX) å sammenligne tilstanden av mineraler i blemmer utgitt av to menneskelig bein linjer: hFOB 1,19 og Saos-2. Disse linjer, etter behandling med askorbinsyre (AA) og β-glycerophosphate (β-GP), gjennomgå komplett osteogenic transdifferentiation fra spredning til mineralisering og produsere matrix blemmer (MVs) som utløser apatitt nucleation i den ekstracellulær matrix (EFM).
Basert på Alizarin Red-S (AR-S) flekker og analyse av sammensetningen av mineraler i celle lysates med ultrafiolett (UV) lys eller blemmer med TEM imaging etterfulgt av EDX kvantifisering og ion kartlegging, kan vi antyde at osteosarcoma Saos-2 og osteoblastic hFOB 1,19 celler avsløre distinkte mineralisering profiler. SAOS-2 celler mineralize mer effektivt enn hFOB 1,19 celler og produsere større mineralforekomster som vises ikke under UV lys, men som ligner på hydroxyapatite (HA) ved at de har flere Ca og F erstatninger.
Resultatene disse teknikkene tillater oss å konkludere med at prosessen med mineralisering varierer avhengig celle. Vi foreslår at på cellenivå, opprinnelse og egenskaper av blemmer forhåndsbestemme av mineraler.
Introduction
Ben er en type bindevev består av to deler: organisk (celler og kollagen fibrene) og mineral (kalsium og fosfat forbindelser). Mineral hovedkomponentene i bein er direkte oversatt: apatitter1. Ulike typer mineralisering kompetente celler i bein (osteoblasts), tenner (odontoblasts) og brusk (chondrocytes) regulere forbokstaven skritt av mineralisering av produserer proteiner av den ekstracellulære matrisen (ECM) og slippe matrise blemmer (MVs) (figur 1). MVs er 100-300 nm diameter blemmer som akkumuleres kalsium og fosfat tilrettelegge apatitt nucleation og deretter binde kollagen2,3. Deretter nedbryte MVs for å løslate direkte oversatt: apatitter til ekstracellulære medium. De direkte oversatt: apatitter fortsette å vokse i kontakt med kollagen fibrene og danne bein matrix. Mineraliseringen er påført konstante tilførselen av Pjeg og Ca2 + i ekstracellulære medium. Noen nylig publiserte data støtte vår modell4,5. Myke vev ikke mineralize under fysiologiske forhold. Ektopisk forkalkninger kan imidlertid oppstå under patologiske tilstander som vaskulær forkalkninger3. Vaskulære celler som kjøper osteoblast fenotypen kan produsere MVs som induserer nucleation av direkte oversatt: apatitter og starte mineralisering i mediale og intimal lagene på veggen av blod fartøy. Siden ektopisk forkalkninger ligne normal endochondral mineralisering3, forstå molekylære mekanismer av mineralisering av osseous celler og chondrocytes bør gi noen hint om ektopisk forkalkning av mykt vev som er dannet.
Utvikling av skjelettet vev er regulert av ulike enzymer, vekstfaktorer, og arrangører og hemmere av mineralisering. Handlingen antagonistiske vev-uspesifikke alkalisk fosfatase (TNAP) (figur 1) og ectonucleotide pyrophosphatase/fosfodiesterase jeg (NPP1), sammen med ankyrin (ANK), styrer uorganiske pyrophosphate (PPjeg) konsentrasjon 6. PPjeg, en potent hemmer av HA formasjon, er hydrolyzed av TNAP; NPP1 hydrolyzes nucleotide triphosphates å danne PPjeg mens ANK eksporterer PPjeg fra cellen til ECM. Pi/PPT forholdet kan regulere apatitt formasjon7,8 med mulige patologisk konsekvenser9.
MV membranen er beriket i ion transport proteiner som letter første nedbør av kalsium og fosfat inne MVs under nucleation prosessen (figur 1). Den fosfat transporter 1 (PiT) bidrar til å innlemme Pjeg generert i perivesicular plass i MVs10,11. Annexins kan være involvert i bindingen og transport av Ca2 + og Biofysiske prosessen som starter mineralisering i MV lumen12,13. Vi ønsker hypotesen foreslått tidligere mineralisering innen Intracytoplasmatisk blemmer av interne nucleation av apatitt inne MV før sin forplantning i ECM14,15. In vitro modellering bekreftet induksjon av Ca2 +/Pjeg komplekser formasjon i proteoliposomes laget av PS og AnxA516. Dette kan tyde på at opphopning av Ca2 +, Pjeg, AnxA5 og PS komplekser i lipid flåter av microvilli-lignende membranesrepresent nucleation kjernen (NC) i apatitt Mvs Annexins og TNAP har kollagen-bindende kapasitet som kan være nyttig i å plassere MVs langs kollagenfibre og stimulere utbredelsen av mineralisering i ECM. Fetuin A og osteopontin (OPN)17, kalles hemmere av apatitt formasjon som kan forsinke spredning av mineralisering på collagenous skafottet. Begge kan være relevante for prosessen med patologisk mineralisering nucleation og overføring er forskjellige arrangementer, tidligere foran sistnevnte.
For å oppdage hvordan kjemien i kalsium fosfat komplekser kan endre fysiologiske mineralisering og ektopisk forkalkninger, er det nødvendig å identifisere mineraler produsert av cellene. Direkte oversatt: apatitter er en gruppe av kalsium og fosfat som inneholder mineraler med generelle krystall enheten cellen formelen Ca10(PO4)6X2, der X = Cl, F, OH. De er klassifisert som følger18: fluorapatite (FA) Ca10(PO4)6F2, chlorapatite (CA) Ca10(PO4)6Cl2 og hydroxyapatite (HA) Ca10(PO4 )6(OH)2.
Valget av osteoblast linjer å skape mineral er viktig, siden hver celle linje viser en tydelig profil av mineralisering. I denne rapporten vi sammenlignet nucleation av mineraler av to valgte human celle modeller av mineralisering: osteoblastic hFOB 1,19 cellene og osteosarcoma Saos-2. Osteosarcoma-avledet celler brukes ofte som osteoblastic og Saos-2 celler har bevart de fleste eldre osteoblastic karakter19 mens udifferensierte menneskelige føtal hFOB celler er mye brukt som modell for vanlig osteoblastic differensiering20. Deres mineralisering profiler ble analysert av ulike metoder: Alizarin rød-S (AR-S) flekker, ultrafiolett (UV) lys visualisering, overføring elektronmikroskop (TEM) bildebehandling, energi dispersiv X-ray microanalysis (EDX) kvantifisering og ion tilordning. Fordelen med TEM-EDX over alternative teknikker som brukes i tidligere studier er at det gir kvantitative og kvalitative resultatene av ion erstatning i apatitt krystaller4,5,21. Det overordnede målet med å bruke TEM-EDX var å finne en enkel metode for bildebehandling og kvantifisering av fordelingen av Ca, F og Cl ioner i ulike mineraler fra forskjellige celler i forskjellige stadier av mineralisering. Denne metoden har blitt brukt, for eksempel for overvåking samspillet av sink nanopartikler coexisting kjemikalier og deres kombinerte effekten vannlevende organismer22. I en annen studie, en kobber photocatalyst på Titan materialer i vandig løsningen var mye preget med Induktivt kombinert plasma optisk utslipp massespektrometri (ICP-OES), N2 physisorption (innsats), XRD, UV-vis DRS, FT-IR, Raman spektroskopi og TEM-EDX photoelectrochemical målinger23. Vårt mål var å sammenligne opprinnelse og egenskaper av blemmer og mineraler i to linjer å forstå mekanismen som styrer mineralisering under osseous differensiering.
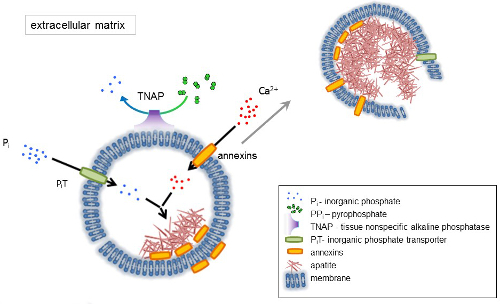
Figur 1 . Ordningen av de første trinnene av mineralisering i osseous celler syntesen av ekstracellulær matrix (EFM) proteiner og utgivelsen av matrix blemmer (MVs) fra membranen. MVs samle kalsium handlingen av kalsium bindende proteiner, annexins og fosfat, gjennom handling av en uorganisk fosfat transporter (PiT) etterfulgt av aktiviteten til vev ikke-spesifikk alkalisk fosfatase (TNAP), som dephosphorylates PPjeg Pjeg, og dermed tilrettelegge apatitt nucleation. Deretter MVs oppløsning og slipp direkte oversatt: apatitter til ekstracellulære medium. Mineraliseringen er påført konstante tilførselen av Pjeg og Ca2 + i ekstracellulære middels4,5. Klikk her for å se en større versjon av dette tallet.
Protocol
Representative Results
Discussion
I dagens papir, vi beskrev protokollene for AR-S flekker, UV lys identifikasjon av fluorapatite og TEM-EDX i vitro imaging MVs utgitt av mineralizing celler og mineraler produsert av MVs. Det er mulig å løse alle metodene ovenfor ved å følge noen felles feilsøkingstrinn. For å oppnå optimale resultater, skal flere viktige trinn utføres nøye. Først er det bedre å legge AA (som er surt) etterfulgt av β-GP (som er alkalisk) Hvis du vil beholde pH 7.4 i kultur medium. Andre, etter AR-S flekker, …
Disclosures
The authors have nothing to disclose.
Acknowledgements
MK og ASK utført manuell operasjoner og LB forberedt tegninger og laget filmen. ASK skrev manuskriptet, LB skrev manuset og MK forberedt tabellen. SM, RB og SP lese kritisk tabellen, skriptet og manuskriptet. Forfatterne vil gjerne takke Hanna Chomontowska for henne utmerket hjelp med ultramicrotomy samt Szymon Suski og Henryk Bilski for deres gode hjelp med TEM-EDX analyse. Forfatterne vil gjerne takke Dr. Patrick engelskspråklig korreksjon og Barbara Sobiak for opptak instruksjonene.
Dette arbeidet ble støttet av grant N N401 140639 fra polsk departementet for vitenskap og høyere utdanning til ASK, av tilskudd fra National Science Centre, Polen 2016/23/N/NZ4/03313 LB og 2016/23/N/NZ1/02449 til MK, EU FP7 prosjektet BIOIMAGINE : BIO-IMAGing forskning innovasjon og utdanning, GA nr. 264173, og av lovbestemte midlene av den Nencki Institutt for eksperimentell biologi, polske vitenskapsakademi.
Materials
| Reagent | |||
| Ham’s DMEM/F12 media mixture | PAA | E15-813 | 1:1, for human fetus hFOB 1.19 SV40 large T antigen transfected osteoblasts (ATCC CRL-11372) |
| McCoy’s 5A medium | PAA | E82312-0025 | for human osteosarcoma Saos-2 cells (ATCC HTB-85) |
| Antibiotics mixture (penicillin/streptomycin) | Sigma | P0781-100ML | 100 U/mL each |
| G-418 | Sigma | 68168 | 0.3 mg/mL |
| FBS | Gibco | 10270 | 10% for hFOB 1.19 and 15% for Saos-2 |
| AA | Sigma | A-5960 | 50 µg/mL |
| ß-GP | Sigma | G9422-100G | 7.5 mM |
| Bio-Gel HTP Gel | Bio-Rad | 130-0420 | for HA |
| FA | synthesized by us | ||
| CA | synthesized by us | ||
| Sodium phosphate buffer Na2HPO4/NaH2PO4 mixture | Sigma | S7907/S8282 | 0.1 M, pH 7.2 |
| PBS | pH 7.0, prepared by us | ||
| AR-S in PBS | Sigma | A5533-25G | 0.5 g/100 mL, pH 5.0 |
| Collagenase type IA | Sigma | C2674 | 500 U/mL |
| SCL buffer | prepared by us | ||
| Deionized wather | produced by us | ||
| Ethanol | POCh | BA6480111 | absolut 99.8% and solutions 25, 50, 75, 90% |
| Uranyl acetate in 50% ethanol | Polysciences Inc. | 21447-25 | 0.25 g/10 mL |
| PD medium | pH 7.4, prepared by us | ||
| Fixation mixture (paraformaldehyde/glutaraldehyde) | Sigma | 158127/G-6257 | 3%:1% |
| Post-fixation OsO4 | Sigma | 75633 | 1% |
| LR White resin in ethanol | Polysciences Inc. | 17411-MUNC 500g | 1:2, 1:1, 100% |
| Acetone | CHEMPUR | 111024800 | pure |
| Tool | |||
| Cryogenic vials | Corning Inc. | 430487 | 1.2 mL |
| Plastic Petri culture dishes | Falcon | 353003 | 100 mm |
| Plastic tubes | Falcon | 352096 and 352070 | 15 and 50 mL |
| Serological pipettes | Falcon and VWR | 357521 and 612-3700 | 1 and 10 mL |
| Plastic microcentrifuge tubes | Sigma | Z688312 and Z628034 | 1.5 mL black and 2 mL transparent |
| Plastic tips | VWR | 613-0364, 613-0239 and 613-1050 | 0.1-10 µL natural, 1-200 µL yellow and 200-1000 µL blue |
| Plastic racks | Light Labs | A-7055-Z, A-7053-C | green for tubes, orange for micro tubes and blue for TEM probes |
| Laminar Hera Save | Thermo Scientific Co. | KS12 | HEPA filter (H14 according to DIN EN 1822) |
| Incubators Hera Cell | Thermo Scientific Co. | 150 | 34°C for hFOB 1.19 and 37°C for Saos-2 |
| Fume hood | POLON | WCS-2 | for TEM stainings |
| Glass bottles | SIMAX | 1632414501050 and 1632414501100 | 50 and 100 mL |
| Quartz glass tubes | SIMAX | 638422010100 | Ø 10 mm, L 100 mm |
| Pump | IBS Integra Biosciences | VACUSAFE comfort | for vacuum |
| Oven | Memmert | UNE 400 | 56°C |
| Porcelain multi-well plate | Rosenthal technik | 229/12 | 12 wells |
| Glass beakers | SIMAX | 632417010025 | 25 mL |
| Glass bottles | Pocord | DIN22 | 10 mL |
| Plastic box | Agar Scientific Ltd. | for darkness | |
| Snap Fit Gelatin Capsules | Agar Scientific Ltd. | G3741 | size 1 |
| Formvar/Carbon 300 Mesh Ni grids in box | Agar Scientific Ltd. | S162N3 | film on the shiny side |
| Silicon cell scraper | Sigma | SIAL0010-100EA | size 1.8/25 cm |
| Syringe with needle | BogMark | 007 | syringe 1 mL 40 U, needle 0.5 x 16 |
| Syringe | Chirana | CH005L | 5 mL |
| Centrifuge | MPW Medical Instruments | MPW-350R | 130 x g and 500 x g |
| UV transluminator | UVP | M-20 | for visible and UV light |
| Ultramicrotome | LKB | NOVA | 700Å sections |
| Block holder | LKB | E6711 | round shape |
| Diamond knife | DiATOME | Ultra 45° | size 3 |
| Eyelash holder | bovine, prepared by us | ||
| Forceps | ROTH | 2855.1 | antistatic for grids |
| Spatulas set | ROTH | E286.1 | antistatic for powders |
| Imaging | |||
| Inverted Light Microscope | Zeiss with Canon | AxioObserver Z1 equipped with PowerShot G9 | Phase contrast, Transmitted light, 20 x objective, RGB filters |
| Transmission Electron Microscope | TEM Jeol Co. with Oxford Instruments and SiS-Olympus | JEM-1400 TEM equipped with full range INCA Energy Dispersive X-ray microanalysis (EDX) System and 11 Megapixel MORADA G2 camera | magnification 50,000X for TEM and 15,000X for STEM and EDX |
| Camera body and lenses | Nikon | Nikon D7100 Nikkor AF Micro 105 mm f/2.8D Nikkor AF-S 50 mm f/1.8G Nikkor AF 28 mm f/2.8D |
for movie recordings |
| Microphone | MXL Mics | Tempo | for voice recordings |
References
- Buckwalter, J. A., Cooper, R. R. Bone structure and function. Instr. Course Lect. 36, 27-28 (1987).
- Anderson, H. C. Molecular biology of matrix vesicles. Clin. Orthop. Relat. Res. 314, 266-280 (1995).
- Anderson, H. C. Matrix vesicles and calcification. Curr Rheumatol. 5 (3), 222-226 (2003).
- Bolean, M., Simão, A. M. S., Barioni, M. B., Favarin, B. Z., Sebinelli, H. G., Veschi, E. A., Janku, T. A. B., Bottini, M., Hoylaerts, M. F., Itri, R., Millán, J. L., Ciancaglini, P. Biophysical aspects of biomineralization. Biophys Rev. 9 (5), 747-760 (2017).
- Bottini, M., Mebarek, S., Anderson, K. L., Strzelecka-Kiliszek, A., Bozycki, L., Simão, A. M. S., Bolean, M., Ciancaglini, P., Bandorowicz Pikula, J., Pikula, S., Magne, D., Volkmann, N., Hanein, D., Millán, J. L., Buchet, R. Matrix vesicles from chondrocytes and osteoblasts: Their biogenesis, properties, functions and biomimetic models. Biochim Biophys Acta. 1862 (3), 532-546 (2018).
- Hessle, L., Johnson, K. A., Anderson, H. C., Narisawa, S., Sali, A., Goding, J. W., Terkeltaub, R., Millan, J. L. Tissue-nonspecific alkaline phosphatase and plasma cell membrane glycoprotein-1 are central antagonistic regulators of bone mineralization. Proc. Natl. Acad. Sci. U. S. A. 99 (14), 9445-9449 (2002).
- Garimella, R., Bi, X., Anderson, H. C., Camacho, N. P. Nature of phosphate substrate as a major determinant of mineral type formed in matrix vesicle-mediated in vitro mineralization: An FTIR imaging study. Bone. 38 (6), 811-817 (2006).
- Thouverey, C., Bechkoff, G., Pikula, S., Buchet, R. Inorganic pyrophosphate as a regulator of hydroxyapatite or calcium pyrophosphate dihydrate mineral deposition by matrix vesicles. Osteoarthr. Cartil. 17, 64-72 (2009).
- Terkeltaub, R. A. Inorganic pyrophosphate generation and disposition in pathophysiology. Am. J. Phys. 281 (1), 1-11 (2001).
- Guicheux, J., Palmer, G., Shukunami, C., Hiraki, Y., Bonjour, J. P., Caverzasio, J. A novel in vitro culture system for analysis of functional role of phosphate transport in endochondral ossification. Bone. 27 (1), 69-74 (2000).
- Yadav, M. C., Bottini, M., Cory, E., Bhattacharya, K., Kuss, P., Narisawa, S., Sah, R. L., Beck, L., Fadeel, B., Farquharson, C., Millán, J. L. Skeletal mineralization deficits and impaired biogenesis and function of chondrocyte-derived matrix vesicles in Phospho1(-/-) and Phospho1/Pi t1 double-knockout mice. J. Bone Miner. Res. 31 (6), 1275-1286 (2016).
- Thouverey, C., Malinowska, A., Balcerzak, M., Strzelecka-Kiliszek, A., Buchet, R., Dadlez, M., Pikula, S. Proteomic characterization of biogenesis and functions of matrix vesicles released from mineralizing human osteoblast-like cells. J. Proteome. 74 (7), 1123-1134 (2011).
- Wang, W., Xu, J., Kirsch, T. Annexin-mediated Ca2+ influx regulates growth plate chondrocyte maturation and apoptosis. J. Biol. Chem. 278 (6), 3762-3769 (2003).
- Nollet, M., Santucci-Darmanin, S., Breuil, V., et al. Autophagy in osteoblasts is involved in mineralization and bone homeostasis. Autophagy. 10 (11), 1965-1977 (2014).
- Boonrungsiman, S., Gentleman, E., Carzaniga, R., Evans, N. D., McComb, D. W., Porter, A. E., Stevens, M. M. The role of intracellular calcium phosphate in osteoblast-mediated bone apatite formation. Proc. Natl. Acad. Sci. U. S. A. 109 (35), 14170-14175 (2012).
- Genge, B. R., Wu, L. N., Wuthier, R. E. In vitro modeling of matrix vesicle nucleation: synergistic stimulation of mineral formation by annexin A5 and phosphatidylserine. J. Biol. Chem. 282 (36), 26035-26045 (2007).
- Jahnen-Dechent, W., Schäfer, B., Ketteler, M., McKee, M. D. Mineral chaperones: a role for fetuin-A and osteopontin in the inhibition and regression of pathologic calcification. J. Mol. Med. (Berl). 86 (4), 379-389 (2008).
- Suchanek, W., Yoshimura, M. Processing and properties of hydroxyapatite-based biomaterials for use as hard tissue replacement implants. J. Miner. Res. 13 (1), 94-117 (1998).
- Pautke, C., Schieker, M., Tischer, T., Kolk, A., Neth, P., Mutschler, W., Milz, S. Characterization of osteosarcoma cell lines MG-63, Saos-2 and U-2 OS in comparison to human osteoblasts. Anticancer Res. 24 (6), 3743-3748 (2004).
- Yen, M. -. L., Chien, C. -. C., Chiu, I. -. M., Huang, H. -. I., Chen, Y. -. C., Hu, H. -. I., Yen, B. L. Multilineage differentiation and characterization of the human fetal osteoblastic 1.19 cell line: a possible in vitro model of human mesenchymal progenitors. Stem Cells. 25 (1), 125-131 (2007).
- Brittle, S. W., Foose, D. P., O’Neil, K. A., Sikon, J. M., Johnson, J. K., Stahler, A. C., Ryan, J. D., Higgins, S. R., Sizemore, I. E. A raman-based imaging method for characterizing the molecular adsorption and spatial distribution of silver nanoparticles to hydrated mineral surfaces. Environ Sci Technol. , (2018).
- Liu, N., Wang, Y., Ge, F., Liu, S., Xiao, H. Antagonistic effect of nano-ZnO and cetyltrimethyl ammonium chloride on the growth of Chlorella vulgaris: Dissolution and accumulation of nano-ZnO. Chemosphere. 196, 566-574 (2018).
- Tasbihi, M., Kočì, K., Troppová, I., Edelmannová, M., Reli, M., Čapek, L., Schomäcker, R. Photocatalytic reduction of carbon dioxide over Cu/TiO2 photocatalysts. Environ Sci Pollut Res Int. , (2017).
- Chen, N. X., O’Neill, K. D., Chen, X., Moe, S. M. Annexin-Mediated Matrix Vesicle Calcification in Vascular Smooth Muscle Cells. J. Bone Miner. Res. 23 (11), 1798-1805 (2008).
- Strzelecka-Kiliszek, A., Bozycki, L., Mebarek, S., Buchet, R., Pikula, S. Characteristics of minerals in vesicles produced by human osteoblasts hFOB 1.19 and osteosarcoma Saos-2 cells stimulated for mineralization. J. Inorg. Bioch. 171, 100-107 (2017).
- Thouverey, C., Strzelecka-Kiliszek, A., Balcerzak, M., Buchet, R., Pikula, S. Matrix vesicles originate from apical membranę microvilli of mineralizing osteoblast-like Saos-2 cells. J. Cell. Biochem. 106 (1), 127-138 (2009).
- Cazalbou, S., Eichert, D., Ranz, X., Drouet, C., Combes, C., Harmand, M. F., Rey, C. Ion exchanges in apatites for biomedical application. J. Mater. Sci. Mater. Med. 16 (5), 405-409 (2005).
- Kraus, D. Consolidated data analysis and presentation using an open-source add-in for the Microsoft Excel® spreadsheet software. Med. Writ. 23 (1), 25-28 (2014).
- Kawasaki, K., Buchanan, A. V., Weiss, K. M. Biomineralization in humans: making the hard choices in life. Annu. Rev. Genet. 43, 119-142 (2009).
- Bonucci, E. Bone mineralization. Front. Biosci. 17, 100-128 (2012).
- Veis, A., Dorvee, J. R. Biomineralization mechanisms: A new paradigm for crystal nucleation in organic matrices. Calcif. Tissue Int. 93 (4), 307-315 (2013).
- Nudelman, F., Lausch, A. J., Sommerdijk, N. A., Sone, E. D. In vitro models of collagen biomineralization. J. Struct. Biol. 183 (2), 258-269 (2013).
- Alliston, T. Biological regulation of bone quality. Curr. Osteoporos. Rep. 12 (3), 366-375 (2014).
- Wang, W., Kirsch, T. Retinoic acid stimulates annexin-mediated growth plate chondrocyte mineralization. J. Cell Biol. 157 (6), 1061-1069 (2002).
- Wang, W., Xu, J., Kirsh, T. Annexin V and terminal differentiation of growth plate chondrocytes. Exp. Cell Res. 305 (1), 156-165 (2005).

