Анализ минералов, производимые hFOB 1.19 и Saos-2 клетки с помощью просвечивающей электронной микроскопии с энергии энергодисперсионный рентгеновский микроанализ
Summary
Мы представляем протокол для сравнения состояния минералов в везикулы, выпущенное две человеческие кости клеточных линий: hFOB 1.19 и Saos-2. Их минерализации профили были проанализированы по ализарин красный-S (AR-S) окрашивание, ультрафиолетового (УФ) света визуализации, передачи изображений электронной микроскопии (ТЕА) и энергии, дисперсионный рентгеновский микроанализ (EDX).
Abstract
Это видео представляет использование просвечивающей электронной микроскопии с энергии, дисперсионный рентгеновский микроанализ (ТЕА-EDX) для сравнения состояния минералов в везикулы, выпущенное две человеческие кости клеточных линий: hFOB 1.19 и Saos-2. Эти клеточные линии, после лечения с аскорбиновой кислотой (AA) и β-Глицерофосфат (β-GP), пройти полный Остеогенные transdifferentiation от распространения к минерализации и производим Матричные везикулы (МВС) которые вызывают нуклеации апатита в внеклеточная матрица (ECM).
Основываясь на окрашивание ализарин красный-S (AR-S) и анализ состава минералов в lysates клетки с помощью ультрафиолетового (УФ) света или пузырьки с помощью изображений ТЕА, следуют EDX количественный и Ион сопоставления, можно заключить, что остеосаркома Saos-2 и osteoblastic hFOB 1.19 клетки раскрыть собственный минерализации профили. Saos-2 клетки минерализации более эффективно, чем hFOB 1.19 клетки и производят больше полезных ископаемых, которые не видны под УФ света, но похожи на гидроксиапатита (га) в том, что они имеют больше Ca и F замен.
Результаты, полученные с помощью этих методов позволяет нам заключить, что процесс минерализации отличается в зависимости от типа ячейки. Мы предлагаем, что, на клеточном уровне, происхождение и свойства везикулы предопределить тип минералов.
Introduction
Кость — это тип соединительной ткани, состоящей из двух частей: органические (клетки и коллагеновые волокна) и минеральных (соединений кальция и фосфата). Основные минеральные компоненты в кости, Апатиты1. Различные типы минерализации компетентных клеток в кости (остеобласты), зубы (odontoblasts) и хряща (хондроцитов) регулируют первоначальные шаги минерализации, производя белков внеклеточного матрикса (ECM) и выпускать матрица везикулы (МВС) (рис. 1). МВС являются 100-300 Нм диаметр пузырьков, которые накапливаются кальция и фосфатов, содействия апатита нуклеации и впоследствии связать коллаген2,3. Затем MVs дезинтегрируют выпустить апатитов внеклеточных среды. Апатиты продолжают расти при контакте с коллагеновых волокон и формируют костной матрицы. Минерализация подкрепляется постоянные поставки P,я и Ca2 + в внеклеточных среды. Некоторые недавно опубликованные данные поддерживают нашу модель4,5. Мягких тканей не минерализации в физиологических условиях. Однако эктопической кальцификации может произойти в патологических условиях например сосудистой кальцификации3. Сосудистые клетки, которые приобретают остеобластов фенотипом могут производить MVs, которые вызывают нуклеации апатитов и инициировать минерализации в медиальной и интимы слои стенки кровеносных сосудов. Начиная с эктопической кальцификации напоминают нормальный endochondral минерализация3, понимание молекулярных механизмов минерализация костных клеток и хондроцитов следует обеспечить некоторые подсказки на Эктопическая кальцификация мягких тканей, которые являются сформирован.
Развитие скелетных тканей регулируется различные ферменты, факторы роста и промоутеров или ингибиторов минерализации. Антагонистическое действие ткани неспецифические щелочной фосфатазы (TNAP) (рис. 1) и ectonucleotide пирофосфатаза/фосфодиэстеразы я (NPP1), вместе с Анкирины (АНК), контролирует концентрации неорганических пирофосфат (PPя) 6. PPя, мощным ингибитором формирования HA, гидролизуется по TNAP; NPP1 гидролизует нуклеотидов трифосфаты сформировать PP,я пока ANK экспортирует PP,я из ячейки в ECM. Pi/PPi соотношение может регулировать апатита формирования7,8 возможных патологических последствий9.
Мембрана MV обогащается в ионный транспорт белков, которые облегчают начальный осадков кальция и фосфатов внутри векторы во время процесса нуклеации (рис. 1). Фосфат транспортер 1 (Пит) помогает включить Pя сгенерирована perivesicular пространства в МВС10,11. Аннексины могут быть вовлечены в привязке и транспорта Ca2 + и в процессе биофизических, который инициирует минерализации в MV просвета12,13. Мы выступаем за гипотеза, предложил ранее, для минерализации в интрацитоплазматической пузырьков внутреннего нуклеации апатита внутри мВ до его распространения в ECM14,15. В vitro моделирования подтвердил индукции формирования Ca2 +/ pя комплексов в proteoliposomes из16Л.С. и AnxA5. Это может означать, что накопление Ca2 +, P,я, AnxA5 и ПС комплексов в липидной плоты микроворсинки как membranesrepresent нуклеации ядро (NC) апатита в пределах Мпротив Аннексины и TNAP обладают также коллаген привязки возможности, которые могут быть полезны в размещении MVs вдоль волокон коллагена и в стимулировании распространения минерализации в ECM. Fetuin A и Остеопоэтин (OPN)17, известны как ингибиторы формирования апатита, которая может замедлить распространение минерализации на коллагеновых эшафот. Зарождения и распространения являются различные события, бывший до последнего, и оба могут быть актуальными для процесса патологических минерализации.
Чтобы узнать, как химический состав кальция фосфат комплексов могут изменить физиологических минерализации и эктопической кальцификации, это необходимо для идентификации минералов, производимые клеток. Апатиты группа кальция и фосфатов, содержащие минералы с общего кристалл блок клеток формулой Ca10(PO4)6X2, где X = Cl, F, OH. Они классифицируются следующим образом18: fluorapatite (ФА) Ca6F10(PO4)2, хлорапатитом (CA) Ca10(PO4)6Cl2 и гидроксиапатита (HA) Ca10(PO4 )6(OH)2.
Выбор остеобластов клеточных линий, чтобы побудить минеральные образования имеет решающее значение, поскольку в каждой ячейке строки экспонатов собственный профиль минерализации. В настоящем докладе, мы сравнили нуклеации минералов на две отдельных клеток человека модели минерализации: osteoblastic hFOB 1.19 клетки и клетки остеосаркома Saos-2. Остеосаркома, полученных клетки обычно используются как osteoblastic модели и Saos-2 клетки сохранили наиболее зрелой osteoblastic характер19 пока недифференцированные человеческого плода hFOB клетки широко используются как модель для нормальной osteoblastic дифференциация20. Их минерализации профили были проанализированы различными методами: пятнать ализарин красный-S (AR-S), ультрафиолетового (УФ) света визуализации, передачи электронной микроскопии (ТЕА) изображений, энергии энергодисперсионный рентгеновский микроанализ (EDX) количественный и Ион сопоставление. Преимущество ТЕА-EDX над альтернативные методы, используемые в предыдущих исследованиях является, что она дает количественные и качественные результаты замены иона в апатита кристаллов4,5,21. Общая цель использования ТЕА-EDX состояла в том, чтобы найти простой способ для создания образов и количественной оценки распределения ионов Ca, F и Cl в различных минералов из различных типов клеток на различных этапах процесса минерализации. Этот метод успешно используется, например, для контроля взаимодействия цинка наночастиц с сосуществующих химических веществ и их совокупное воздействие на водные организмы22. В другом исследовании, медные фотокатализатор на титановые материалы в водном растворе широко характеризуется с помощью индуктивно связанной плазмы оптической эмиссионной спектрометрии (ICP-OES), N2 physisorption (BET), Дифракционные, UV-vis DRS, FT-IR, Раман спектроскопия, ТЕА-EDX и фотоэлектрохимические измерения23. Нашей целью было сравнить происхождение и свойства везикулы и минералов в двух клеточных линий, чтобы понять механизм, который управляет минерализации при костной дифференциации.
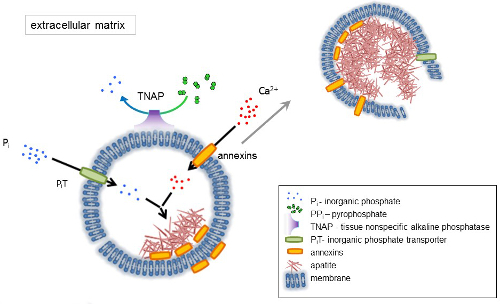
Рисунок 1 . Схема из первоначальных шагов минерализации в костных клеток, синтез белков внеклеточного матрикса (ECM) и выпуска Матричные везикулы (МВС) от мембраны. МВС накопления кальция через действия кальция связывания белков, Аннексины и фосфат, через действие неорганического фосфата транспортера (Пит) следуют активности тканей неспецифической щелочной фосфатазы (TNAP), который dephosphorylates PPя Pя, способствуя апатита зародышеобразования. Затем MVs распадаться и отпустите апатитов внеклеточных среды. Минерализация поддерживается постоянной поставке P,я и Ca2 + в внеклеточной средний4,5. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Protocol
Representative Results
Discussion
В текущем документе мы описали протоколы для окрашивания, УФ света идентификации fluorapatite AR-S и ТЕА-EDX в vitro изображений МВС, выпущенное минерализация клетки и минералов производимых MVs. Это позволяет решить все методы, упомянутые выше, после некоторых общих неполадок. Чтобы получ…
Disclosures
The authors have nothing to disclose.
Acknowledgements
МК и ASK ручной операции и LB подготовлены чертежи и сделал фильм. ASK написал рукопись, LB написал сценарий и MK подготовил таблицу. SM, RB и SP критически прочитать таблицу, сценарий и рукописи. Авторы хотели бы поблагодарить Hanna Chomontowska за ее превосходную помощь с ultramicrotomy а также Шимон Suski и Henryk Bilski за их прекрасную помощь с ТЕА-EDX анализа. Авторы хотели бы поблагодарить д-р Патрик рощи для коррекции профессионального английского языка и Барбара Sobiak для записи инструкции.
Эта работа была поддержана грант N N401 140639 от польского министерства науки и высшего образования спросить, за счет субсидий из национального научного центра, Польша 2016/23/N/NZ4/03313 фунтов и 2016/23/N/NZ1/02449 в МК, BIOIMAGINE Проект РП7 ЕС : Био-изображений в исследования инноваций и образования, GA № 264173 и уставных фондов из Ненцки Института экспериментальной биологии, польской академии наук.
Materials
| Reagent | |||
| Ham’s DMEM/F12 media mixture | PAA | E15-813 | 1:1, for human fetus hFOB 1.19 SV40 large T antigen transfected osteoblasts (ATCC CRL-11372) |
| McCoy’s 5A medium | PAA | E82312-0025 | for human osteosarcoma Saos-2 cells (ATCC HTB-85) |
| Antibiotics mixture (penicillin/streptomycin) | Sigma | P0781-100ML | 100 U/mL each |
| G-418 | Sigma | 68168 | 0.3 mg/mL |
| FBS | Gibco | 10270 | 10% for hFOB 1.19 and 15% for Saos-2 |
| AA | Sigma | A-5960 | 50 µg/mL |
| ß-GP | Sigma | G9422-100G | 7.5 mM |
| Bio-Gel HTP Gel | Bio-Rad | 130-0420 | for HA |
| FA | synthesized by us | ||
| CA | synthesized by us | ||
| Sodium phosphate buffer Na2HPO4/NaH2PO4 mixture | Sigma | S7907/S8282 | 0.1 M, pH 7.2 |
| PBS | pH 7.0, prepared by us | ||
| AR-S in PBS | Sigma | A5533-25G | 0.5 g/100 mL, pH 5.0 |
| Collagenase type IA | Sigma | C2674 | 500 U/mL |
| SCL buffer | prepared by us | ||
| Deionized wather | produced by us | ||
| Ethanol | POCh | BA6480111 | absolut 99.8% and solutions 25, 50, 75, 90% |
| Uranyl acetate in 50% ethanol | Polysciences Inc. | 21447-25 | 0.25 g/10 mL |
| PD medium | pH 7.4, prepared by us | ||
| Fixation mixture (paraformaldehyde/glutaraldehyde) | Sigma | 158127/G-6257 | 3%:1% |
| Post-fixation OsO4 | Sigma | 75633 | 1% |
| LR White resin in ethanol | Polysciences Inc. | 17411-MUNC 500g | 1:2, 1:1, 100% |
| Acetone | CHEMPUR | 111024800 | pure |
| Tool | |||
| Cryogenic vials | Corning Inc. | 430487 | 1.2 mL |
| Plastic Petri culture dishes | Falcon | 353003 | 100 mm |
| Plastic tubes | Falcon | 352096 and 352070 | 15 and 50 mL |
| Serological pipettes | Falcon and VWR | 357521 and 612-3700 | 1 and 10 mL |
| Plastic microcentrifuge tubes | Sigma | Z688312 and Z628034 | 1.5 mL black and 2 mL transparent |
| Plastic tips | VWR | 613-0364, 613-0239 and 613-1050 | 0.1-10 µL natural, 1-200 µL yellow and 200-1000 µL blue |
| Plastic racks | Light Labs | A-7055-Z, A-7053-C | green for tubes, orange for micro tubes and blue for TEM probes |
| Laminar Hera Save | Thermo Scientific Co. | KS12 | HEPA filter (H14 according to DIN EN 1822) |
| Incubators Hera Cell | Thermo Scientific Co. | 150 | 34°C for hFOB 1.19 and 37°C for Saos-2 |
| Fume hood | POLON | WCS-2 | for TEM stainings |
| Glass bottles | SIMAX | 1632414501050 and 1632414501100 | 50 and 100 mL |
| Quartz glass tubes | SIMAX | 638422010100 | Ø 10 mm, L 100 mm |
| Pump | IBS Integra Biosciences | VACUSAFE comfort | for vacuum |
| Oven | Memmert | UNE 400 | 56°C |
| Porcelain multi-well plate | Rosenthal technik | 229/12 | 12 wells |
| Glass beakers | SIMAX | 632417010025 | 25 mL |
| Glass bottles | Pocord | DIN22 | 10 mL |
| Plastic box | Agar Scientific Ltd. | for darkness | |
| Snap Fit Gelatin Capsules | Agar Scientific Ltd. | G3741 | size 1 |
| Formvar/Carbon 300 Mesh Ni grids in box | Agar Scientific Ltd. | S162N3 | film on the shiny side |
| Silicon cell scraper | Sigma | SIAL0010-100EA | size 1.8/25 cm |
| Syringe with needle | BogMark | 007 | syringe 1 mL 40 U, needle 0.5 x 16 |
| Syringe | Chirana | CH005L | 5 mL |
| Centrifuge | MPW Medical Instruments | MPW-350R | 130 x g and 500 x g |
| UV transluminator | UVP | M-20 | for visible and UV light |
| Ultramicrotome | LKB | NOVA | 700Å sections |
| Block holder | LKB | E6711 | round shape |
| Diamond knife | DiATOME | Ultra 45° | size 3 |
| Eyelash holder | bovine, prepared by us | ||
| Forceps | ROTH | 2855.1 | antistatic for grids |
| Spatulas set | ROTH | E286.1 | antistatic for powders |
| Imaging | |||
| Inverted Light Microscope | Zeiss with Canon | AxioObserver Z1 equipped with PowerShot G9 | Phase contrast, Transmitted light, 20 x objective, RGB filters |
| Transmission Electron Microscope | TEM Jeol Co. with Oxford Instruments and SiS-Olympus | JEM-1400 TEM equipped with full range INCA Energy Dispersive X-ray microanalysis (EDX) System and 11 Megapixel MORADA G2 camera | magnification 50,000X for TEM and 15,000X for STEM and EDX |
| Camera body and lenses | Nikon | Nikon D7100 Nikkor AF Micro 105 mm f/2.8D Nikkor AF-S 50 mm f/1.8G Nikkor AF 28 mm f/2.8D |
for movie recordings |
| Microphone | MXL Mics | Tempo | for voice recordings |
References
- Buckwalter, J. A., Cooper, R. R. Bone structure and function. Instr. Course Lect. 36, 27-28 (1987).
- Anderson, H. C. Molecular biology of matrix vesicles. Clin. Orthop. Relat. Res. 314, 266-280 (1995).
- Anderson, H. C. Matrix vesicles and calcification. Curr Rheumatol. 5 (3), 222-226 (2003).
- Bolean, M., Simão, A. M. S., Barioni, M. B., Favarin, B. Z., Sebinelli, H. G., Veschi, E. A., Janku, T. A. B., Bottini, M., Hoylaerts, M. F., Itri, R., Millán, J. L., Ciancaglini, P. Biophysical aspects of biomineralization. Biophys Rev. 9 (5), 747-760 (2017).
- Bottini, M., Mebarek, S., Anderson, K. L., Strzelecka-Kiliszek, A., Bozycki, L., Simão, A. M. S., Bolean, M., Ciancaglini, P., Bandorowicz Pikula, J., Pikula, S., Magne, D., Volkmann, N., Hanein, D., Millán, J. L., Buchet, R. Matrix vesicles from chondrocytes and osteoblasts: Their biogenesis, properties, functions and biomimetic models. Biochim Biophys Acta. 1862 (3), 532-546 (2018).
- Hessle, L., Johnson, K. A., Anderson, H. C., Narisawa, S., Sali, A., Goding, J. W., Terkeltaub, R., Millan, J. L. Tissue-nonspecific alkaline phosphatase and plasma cell membrane glycoprotein-1 are central antagonistic regulators of bone mineralization. Proc. Natl. Acad. Sci. U. S. A. 99 (14), 9445-9449 (2002).
- Garimella, R., Bi, X., Anderson, H. C., Camacho, N. P. Nature of phosphate substrate as a major determinant of mineral type formed in matrix vesicle-mediated in vitro mineralization: An FTIR imaging study. Bone. 38 (6), 811-817 (2006).
- Thouverey, C., Bechkoff, G., Pikula, S., Buchet, R. Inorganic pyrophosphate as a regulator of hydroxyapatite or calcium pyrophosphate dihydrate mineral deposition by matrix vesicles. Osteoarthr. Cartil. 17, 64-72 (2009).
- Terkeltaub, R. A. Inorganic pyrophosphate generation and disposition in pathophysiology. Am. J. Phys. 281 (1), 1-11 (2001).
- Guicheux, J., Palmer, G., Shukunami, C., Hiraki, Y., Bonjour, J. P., Caverzasio, J. A novel in vitro culture system for analysis of functional role of phosphate transport in endochondral ossification. Bone. 27 (1), 69-74 (2000).
- Yadav, M. C., Bottini, M., Cory, E., Bhattacharya, K., Kuss, P., Narisawa, S., Sah, R. L., Beck, L., Fadeel, B., Farquharson, C., Millán, J. L. Skeletal mineralization deficits and impaired biogenesis and function of chondrocyte-derived matrix vesicles in Phospho1(-/-) and Phospho1/Pi t1 double-knockout mice. J. Bone Miner. Res. 31 (6), 1275-1286 (2016).
- Thouverey, C., Malinowska, A., Balcerzak, M., Strzelecka-Kiliszek, A., Buchet, R., Dadlez, M., Pikula, S. Proteomic characterization of biogenesis and functions of matrix vesicles released from mineralizing human osteoblast-like cells. J. Proteome. 74 (7), 1123-1134 (2011).
- Wang, W., Xu, J., Kirsch, T. Annexin-mediated Ca2+ influx regulates growth plate chondrocyte maturation and apoptosis. J. Biol. Chem. 278 (6), 3762-3769 (2003).
- Nollet, M., Santucci-Darmanin, S., Breuil, V., et al. Autophagy in osteoblasts is involved in mineralization and bone homeostasis. Autophagy. 10 (11), 1965-1977 (2014).
- Boonrungsiman, S., Gentleman, E., Carzaniga, R., Evans, N. D., McComb, D. W., Porter, A. E., Stevens, M. M. The role of intracellular calcium phosphate in osteoblast-mediated bone apatite formation. Proc. Natl. Acad. Sci. U. S. A. 109 (35), 14170-14175 (2012).
- Genge, B. R., Wu, L. N., Wuthier, R. E. In vitro modeling of matrix vesicle nucleation: synergistic stimulation of mineral formation by annexin A5 and phosphatidylserine. J. Biol. Chem. 282 (36), 26035-26045 (2007).
- Jahnen-Dechent, W., Schäfer, B., Ketteler, M., McKee, M. D. Mineral chaperones: a role for fetuin-A and osteopontin in the inhibition and regression of pathologic calcification. J. Mol. Med. (Berl). 86 (4), 379-389 (2008).
- Suchanek, W., Yoshimura, M. Processing and properties of hydroxyapatite-based biomaterials for use as hard tissue replacement implants. J. Miner. Res. 13 (1), 94-117 (1998).
- Pautke, C., Schieker, M., Tischer, T., Kolk, A., Neth, P., Mutschler, W., Milz, S. Characterization of osteosarcoma cell lines MG-63, Saos-2 and U-2 OS in comparison to human osteoblasts. Anticancer Res. 24 (6), 3743-3748 (2004).
- Yen, M. -. L., Chien, C. -. C., Chiu, I. -. M., Huang, H. -. I., Chen, Y. -. C., Hu, H. -. I., Yen, B. L. Multilineage differentiation and characterization of the human fetal osteoblastic 1.19 cell line: a possible in vitro model of human mesenchymal progenitors. Stem Cells. 25 (1), 125-131 (2007).
- Brittle, S. W., Foose, D. P., O’Neil, K. A., Sikon, J. M., Johnson, J. K., Stahler, A. C., Ryan, J. D., Higgins, S. R., Sizemore, I. E. A raman-based imaging method for characterizing the molecular adsorption and spatial distribution of silver nanoparticles to hydrated mineral surfaces. Environ Sci Technol. , (2018).
- Liu, N., Wang, Y., Ge, F., Liu, S., Xiao, H. Antagonistic effect of nano-ZnO and cetyltrimethyl ammonium chloride on the growth of Chlorella vulgaris: Dissolution and accumulation of nano-ZnO. Chemosphere. 196, 566-574 (2018).
- Tasbihi, M., Kočì, K., Troppová, I., Edelmannová, M., Reli, M., Čapek, L., Schomäcker, R. Photocatalytic reduction of carbon dioxide over Cu/TiO2 photocatalysts. Environ Sci Pollut Res Int. , (2017).
- Chen, N. X., O’Neill, K. D., Chen, X., Moe, S. M. Annexin-Mediated Matrix Vesicle Calcification in Vascular Smooth Muscle Cells. J. Bone Miner. Res. 23 (11), 1798-1805 (2008).
- Strzelecka-Kiliszek, A., Bozycki, L., Mebarek, S., Buchet, R., Pikula, S. Characteristics of minerals in vesicles produced by human osteoblasts hFOB 1.19 and osteosarcoma Saos-2 cells stimulated for mineralization. J. Inorg. Bioch. 171, 100-107 (2017).
- Thouverey, C., Strzelecka-Kiliszek, A., Balcerzak, M., Buchet, R., Pikula, S. Matrix vesicles originate from apical membranę microvilli of mineralizing osteoblast-like Saos-2 cells. J. Cell. Biochem. 106 (1), 127-138 (2009).
- Cazalbou, S., Eichert, D., Ranz, X., Drouet, C., Combes, C., Harmand, M. F., Rey, C. Ion exchanges in apatites for biomedical application. J. Mater. Sci. Mater. Med. 16 (5), 405-409 (2005).
- Kraus, D. Consolidated data analysis and presentation using an open-source add-in for the Microsoft Excel® spreadsheet software. Med. Writ. 23 (1), 25-28 (2014).
- Kawasaki, K., Buchanan, A. V., Weiss, K. M. Biomineralization in humans: making the hard choices in life. Annu. Rev. Genet. 43, 119-142 (2009).
- Bonucci, E. Bone mineralization. Front. Biosci. 17, 100-128 (2012).
- Veis, A., Dorvee, J. R. Biomineralization mechanisms: A new paradigm for crystal nucleation in organic matrices. Calcif. Tissue Int. 93 (4), 307-315 (2013).
- Nudelman, F., Lausch, A. J., Sommerdijk, N. A., Sone, E. D. In vitro models of collagen biomineralization. J. Struct. Biol. 183 (2), 258-269 (2013).
- Alliston, T. Biological regulation of bone quality. Curr. Osteoporos. Rep. 12 (3), 366-375 (2014).
- Wang, W., Kirsch, T. Retinoic acid stimulates annexin-mediated growth plate chondrocyte mineralization. J. Cell Biol. 157 (6), 1061-1069 (2002).
- Wang, W., Xu, J., Kirsh, T. Annexin V and terminal differentiation of growth plate chondrocytes. Exp. Cell Res. 305 (1), 156-165 (2005).

