Analys av mineraler produceras av hFOB 1.19 och Saos-2 celler använder transmissionselektronmikroskopi med Energy Dispersive X-ray mikroanalys
Summary
Vi presenterar ett protokoll för att jämföra staten av mineraler i blåsor släpptes av två mänskliga ben cellinjer: hFOB 1.19 och Saos-2. Sina mineralisering profiler analyserades av Alizarin Red-S (AR-S) färgning, ultraviolett (UV) ljus visualisering, överföring elektronmikroskopi (TEM) imaging och energy dispersive X-ray mikroanalys (EDX).
Abstract
Denna video presenterar användning av transmissionselektronmikroskopi med energy dispersive X-ray mikroanalys (TEM-EDX) att jämföra staten av mineraler i blåsor släpptes av två mänskliga ben cellinjer: hFOB 1.19 och Saos-2. Dessa cellinjer, efter behandling med askorbinsyra (AA) och β-glycerofosfat (β-GP), genomgå fullständig osteogent transdifferentiation från spridning till mineralisering och producera matrix blåsor (MVs) som utlöser apatit kärnbildning i den extracellulär matrix (ECM).
Baserat på Alizarin Red-S (AR-S) färgning och analys av sammansättning av mineraler i cell lysates med ultraviolett (UV) ljus eller blåsor med hjälp av TEM imaging följt av EDX kvantifiering och ion kartläggning, vi kan dra slutsatsen att osteosarkom Saos-2 och osteoblastiska hFOB 1.19 celler avslöja distinkta mineralisering profiler. SAOS-2-celler mineralize mer effektivt än hFOB 1.19 celler och producera större mineralfyndigheter som inte är synligt i UV-belysning men liknar hydroxyapatit (HA) att de har mer Ca och F substitutioner.
De resultat som erhålls med hjälp av dessa tekniker tillåter oss att dra slutsatsen att processen för mineralisering skiljer sig beroende på cellen. Vi föreslår att på cellnivå, ursprung och egenskaper av blåsor förutbestämma vilken typ av mineraler.
Introduction
Ben är en typ av bindväv som består av två delar: ekologisk (celler och kollagenfibrer) och mineraler (kalcium och fosfat föreningar). Mineraliska huvudkomponenterna i ben är apatites1. Olika typer av mineralisering-kompetenta celler i skelettet (osteoblaster), tänder (odontoblaster) och brosk (kondrocyter) reglera de första stegen av mineralisering av producerar proteiner av den extracellulär matrixen (ECM) och släppa matris blåsor (MVs) (figur 1). MVs är 100-300 nm diameter blåsor som ackumuleras kalcium och fosfat underlätta apatit kärnbildning och därefter binda till kollagen2,3. Sedan, MVs upplösas för att släppa apatites till extracellulära medium. Apatites fortsätter att växa i kontakt med kollagenfibrer och bilda benmatrix. Mineraliseringen upprätthålls av den konstant tillförselen av Pjag och Ca2 + i det extracellulära mediet. Några nyligen publicerade data stödjer vår modell4,5. Mjuka vävnader inte mineralize under fysiologiska betingelser. Ektopisk förkalkning kan dock inträffa under sjukdomstillstånd såsom vaskulär förkalkning3. Vaskulära celler som förvärvar osteoblast fenotypen kan producera MVs som inducerar kärnbildning av apatites och initiera mineralisering i väggen mediala och intimans lager av blodkärl. Sedan ektopisk förkalkning likna normala endochondral mineralisering3, förstå de molekylära mekanismerna av mineralisering av bendefekter celler och kondrocyter bör ge några ledtrådar om ektopisk förkalkning av mjukvävnad som är bildas.
Utvecklingen av skelettet vävnader regleras av olika enzymer, tillväxtfaktorer, och initiativtagare eller hämmare av mineralisering. Åtgärden antagonistiska vävnad-ospecifik alkaliskt fosfatas (TNAP) (figur 1) och ectonucleotide pyrophosphatase/fosfodiesteras jag (NPP1), tillsammans med ankyrin (ANK), styr oorganisk pyrofosfat (PPjag) koncentration 6. PPjag, en potent hämmare av HA bildandet, hydrolyseras av TNAP; NPP1 hydrolyserar nukleotid trifosfater bildar PPjag medan ANK export PPjag från cellen till ECM. Förhållandet Pi/PPi kan reglera apatit bildandet7,8 med eventuella patologiska konsekvenserna9.
MV membranet är berikad i ion transportproteiner som underlättar inledande utfällning av kalcium och fosfat inuti MVs under processen kärnbildning (figur 1). Fosfat transportören 1 (PiT) hjälper till att införliva Pjag genereras i perivesicular utrymme till MVs10,11. Annexins kan vara inblandade i bindningen och transport av Ca2 + och biofysiska processen som initierar mineralisering i MV lumen12,13. Vi gynnar den hypotesen, föreslog tidigare, för mineralisering inom intracytoplasmatisk blåsor av interna kärnbildning av apatit inuti MV innan dess förökning i ECM14,15. In vitro modellering bekräftade induktion av Ca2 +/Pjag komplex bildande i proteoliposomes gjorda av PS och AnxA516. Detta kan tyda på att ansamling av Ca2 +, Pjag, AnxA5 och PS komplex i lipid rafts av Mikrovilli-liknande membranesrepresent kärnbildning kärnan (NC) i apatite inom MVs. Annexins och TNAP också äger kollagen bindande kapacitet som kan vara till hjälp i att placera MVs längs kollagenfibrer och stimulera spridningen av mineralisering i ECM. Fetuin A och osteopontin (OPN)17, är kända som hämmare av apatit bildandet som kan bromsa förökningen av mineralisering på kollagena schavotten. Kärnbildning och förökning är separata händelser, den förstnämnda som föregår den senare, och båda kan vara relevanta för processen av patologiska mineralisering.
För att upptäcka hur kemin av kalciumfosfat komplex kan ändra fysiologiska mineralisering och ektopisk förkalkning, är det nödvändigt att identifiera de mineraler som produceras av celler. Apatites är en grupp av kalcium och fosfat som innehåller mineraler med den allmänna crystal enhet cell formeln Ca10(PO4)6X2, där X = Cl, F, OH. De klassificeras enligt följande18: Fluorapatit (FA) Ca10(PO4)6F2, chlorapatite (CA) Ca10(PO4)6Cl2 och hydroxyapatit (HA) Ca10(PO4 )6(OH)2.
Valet av osteoblast cellinjer att framkalla mineral bildas är avgörande, eftersom varje cellinje uppvisar en tydlig profil av mineralisering. I detta betänkande, Vi jämförde kärnbildning av mineraler av två valda mänsklig cellmodeller av mineralisering: osteoblastiska hFOB 1.19 och osteosarkom Saos-2 celler. Osteosarkom-derived celler används ofta som osteoblastiska modeller och Saos-2-celler har bevarat de mest mogna osteoblastiska karaktär19 medan odifferentierade mänskliga fostrets hFOB celler används allmänt som en modell för normal osteoblastiska differentiering20. Sina mineralisering profiler analyserades av olika metoder: Alizarin Red-S (AR-S) färgning, ultraviolett (UV) ljus visualisering, överföring elektronmikroskopi (TEM) imaging, energy dispersive X-ray mikroanalys (EDX) kvantifiering och ion kartläggning. Fördelen med TEM-EDX jämfört med alternativa tekniker som används i tidigare studier är att det ger kvantitativa och kvalitativa resultat av ion ersättare i apatite kristaller4,5,21. Det övergripande målet med TEM-EDX var att hitta en enkel metod för avbildning och kvantifiering av fördelningen av Ca, F och Cl-joner i olika mineraler från olika typer av celler under olika faser av processen mineralisering. Denna metod har använts framgångsrikt, till exempel för att övervaka växelverkan av zink nanopartiklar med samtidiga kemikalier och deras kombinerade effekter på vattenlevande organismer22. I en annan studie, en koppar fotokatalysator på titanium material i vattenlösning präglades i stor utsträckning genom induktivt kopplad plasma OEC (ICP-OES), N2 physisorption (insats), XRD, UV-vis DRS, FT-IR, Raman spektroskopi och TEM-EDX photoelectrochemical mätningar23. Vårt syfte var att jämföra ursprung och egenskaper av blåsor och mineraler i två cellinjer att förstå mekanismen som styr mineralisering under bendefekter differentiering.
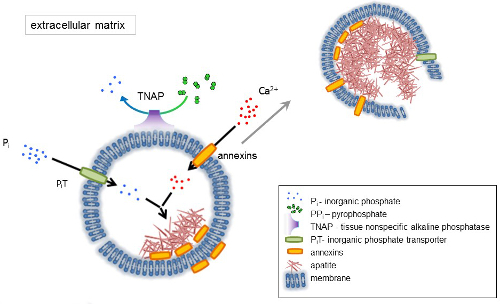
Figur 1 . Systematiken i de första stegen av mineralisering i bendefekter celler med syntesen av extracellulär matrix (ECM) proteiner och frisättning av matrix blåsor (MVs) från membranet. MVs ackumuleras kalcium genom åtgärder av kalcium bindande proteiner, annexins och fosfat, genom åtgärder av ett oorganiskt fosfat transportör (PiT) följt av aktiviteten av vävnad ospecifika alkaliska fosfataser (TNAP), som defosforylerar PPjag att Pjag, därigenom underlätta apatit kärnbildning. Sedan MVs upplösas och släppa apatites till extracellulära medium. Mineraliseringen upprätthålls av den konstant tillförselen av Pjag och Ca2 + i den extracellulära medium4,5. Klicka här för att se en större version av denna siffra.
Protocol
Representative Results
Discussion
I det nuvarande papperet, beskrev vi protokollen för AR-S färgning, UV ljus identifiering av Fluorapatit och TEM-EDX in vitro- imaging av MVs släpptes av mineraliserande celler och mineraler produceras av MVs. Det är möjligt att ta itu med alla metoder som nämns ovan genom att följa vissa vanliga felsökningssteg. För att erhålla optimala resultat, bör flera kritiska moment utföras noggrant. Det första är det bättre att lägga AA (som är sura) följt av β-GP (som är basiskt) för att be…
Disclosures
The authors have nothing to disclose.
Acknowledgements
MK och ASK utfört manuella operationer och LB beredda ritningar och gjorde filmen. ASK skrev manuskriptet, LB skrev manuset och MK beredda tabellen. SM, RB och SP läsa kritiskt tabellen, skriptet och manuskript. Författarna vill tacka Hanna Chomontowska för hennes utmärkta hjälp med ultramicrotomy och Szymon Suski samt Henryk Bilski för deras utmärkta hjälp med TEM-EDX analys. Författarna vill tacka dr Patrick lundar för professionella engelska språket korrigering och Barbara Sobiak för inspelning av instruktionerna.
Detta arbete stöds av grant N N401 140639 från det polska ministeriet för vetenskap och högre utbildning till ASK, med bidrag från de nationella Science Centre, Polen 2016/23/N/NZ4/03313 till LB och 2016/23/N/NZ1/02449 till MK, EU FP7-projektet BIOIMAGINE : BIO-IMAGing i forskning INnovation och utbildning, GA nr 264173, och av de lagstadgade medel av Nencki institut för experimentell biologi, polska vetenskapsakademin.
Materials
| Reagent | |||
| Ham’s DMEM/F12 media mixture | PAA | E15-813 | 1:1, for human fetus hFOB 1.19 SV40 large T antigen transfected osteoblasts (ATCC CRL-11372) |
| McCoy’s 5A medium | PAA | E82312-0025 | for human osteosarcoma Saos-2 cells (ATCC HTB-85) |
| Antibiotics mixture (penicillin/streptomycin) | Sigma | P0781-100ML | 100 U/mL each |
| G-418 | Sigma | 68168 | 0.3 mg/mL |
| FBS | Gibco | 10270 | 10% for hFOB 1.19 and 15% for Saos-2 |
| AA | Sigma | A-5960 | 50 µg/mL |
| ß-GP | Sigma | G9422-100G | 7.5 mM |
| Bio-Gel HTP Gel | Bio-Rad | 130-0420 | for HA |
| FA | synthesized by us | ||
| CA | synthesized by us | ||
| Sodium phosphate buffer Na2HPO4/NaH2PO4 mixture | Sigma | S7907/S8282 | 0.1 M, pH 7.2 |
| PBS | pH 7.0, prepared by us | ||
| AR-S in PBS | Sigma | A5533-25G | 0.5 g/100 mL, pH 5.0 |
| Collagenase type IA | Sigma | C2674 | 500 U/mL |
| SCL buffer | prepared by us | ||
| Deionized wather | produced by us | ||
| Ethanol | POCh | BA6480111 | absolut 99.8% and solutions 25, 50, 75, 90% |
| Uranyl acetate in 50% ethanol | Polysciences Inc. | 21447-25 | 0.25 g/10 mL |
| PD medium | pH 7.4, prepared by us | ||
| Fixation mixture (paraformaldehyde/glutaraldehyde) | Sigma | 158127/G-6257 | 3%:1% |
| Post-fixation OsO4 | Sigma | 75633 | 1% |
| LR White resin in ethanol | Polysciences Inc. | 17411-MUNC 500g | 1:2, 1:1, 100% |
| Acetone | CHEMPUR | 111024800 | pure |
| Tool | |||
| Cryogenic vials | Corning Inc. | 430487 | 1.2 mL |
| Plastic Petri culture dishes | Falcon | 353003 | 100 mm |
| Plastic tubes | Falcon | 352096 and 352070 | 15 and 50 mL |
| Serological pipettes | Falcon and VWR | 357521 and 612-3700 | 1 and 10 mL |
| Plastic microcentrifuge tubes | Sigma | Z688312 and Z628034 | 1.5 mL black and 2 mL transparent |
| Plastic tips | VWR | 613-0364, 613-0239 and 613-1050 | 0.1-10 µL natural, 1-200 µL yellow and 200-1000 µL blue |
| Plastic racks | Light Labs | A-7055-Z, A-7053-C | green for tubes, orange for micro tubes and blue for TEM probes |
| Laminar Hera Save | Thermo Scientific Co. | KS12 | HEPA filter (H14 according to DIN EN 1822) |
| Incubators Hera Cell | Thermo Scientific Co. | 150 | 34°C for hFOB 1.19 and 37°C for Saos-2 |
| Fume hood | POLON | WCS-2 | for TEM stainings |
| Glass bottles | SIMAX | 1632414501050 and 1632414501100 | 50 and 100 mL |
| Quartz glass tubes | SIMAX | 638422010100 | Ø 10 mm, L 100 mm |
| Pump | IBS Integra Biosciences | VACUSAFE comfort | for vacuum |
| Oven | Memmert | UNE 400 | 56°C |
| Porcelain multi-well plate | Rosenthal technik | 229/12 | 12 wells |
| Glass beakers | SIMAX | 632417010025 | 25 mL |
| Glass bottles | Pocord | DIN22 | 10 mL |
| Plastic box | Agar Scientific Ltd. | for darkness | |
| Snap Fit Gelatin Capsules | Agar Scientific Ltd. | G3741 | size 1 |
| Formvar/Carbon 300 Mesh Ni grids in box | Agar Scientific Ltd. | S162N3 | film on the shiny side |
| Silicon cell scraper | Sigma | SIAL0010-100EA | size 1.8/25 cm |
| Syringe with needle | BogMark | 007 | syringe 1 mL 40 U, needle 0.5 x 16 |
| Syringe | Chirana | CH005L | 5 mL |
| Centrifuge | MPW Medical Instruments | MPW-350R | 130 x g and 500 x g |
| UV transluminator | UVP | M-20 | for visible and UV light |
| Ultramicrotome | LKB | NOVA | 700Å sections |
| Block holder | LKB | E6711 | round shape |
| Diamond knife | DiATOME | Ultra 45° | size 3 |
| Eyelash holder | bovine, prepared by us | ||
| Forceps | ROTH | 2855.1 | antistatic for grids |
| Spatulas set | ROTH | E286.1 | antistatic for powders |
| Imaging | |||
| Inverted Light Microscope | Zeiss with Canon | AxioObserver Z1 equipped with PowerShot G9 | Phase contrast, Transmitted light, 20 x objective, RGB filters |
| Transmission Electron Microscope | TEM Jeol Co. with Oxford Instruments and SiS-Olympus | JEM-1400 TEM equipped with full range INCA Energy Dispersive X-ray microanalysis (EDX) System and 11 Megapixel MORADA G2 camera | magnification 50,000X for TEM and 15,000X for STEM and EDX |
| Camera body and lenses | Nikon | Nikon D7100 Nikkor AF Micro 105 mm f/2.8D Nikkor AF-S 50 mm f/1.8G Nikkor AF 28 mm f/2.8D |
for movie recordings |
| Microphone | MXL Mics | Tempo | for voice recordings |
References
- Buckwalter, J. A., Cooper, R. R. Bone structure and function. Instr. Course Lect. 36, 27-28 (1987).
- Anderson, H. C. Molecular biology of matrix vesicles. Clin. Orthop. Relat. Res. 314, 266-280 (1995).
- Anderson, H. C. Matrix vesicles and calcification. Curr Rheumatol. 5 (3), 222-226 (2003).
- Bolean, M., Simão, A. M. S., Barioni, M. B., Favarin, B. Z., Sebinelli, H. G., Veschi, E. A., Janku, T. A. B., Bottini, M., Hoylaerts, M. F., Itri, R., Millán, J. L., Ciancaglini, P. Biophysical aspects of biomineralization. Biophys Rev. 9 (5), 747-760 (2017).
- Bottini, M., Mebarek, S., Anderson, K. L., Strzelecka-Kiliszek, A., Bozycki, L., Simão, A. M. S., Bolean, M., Ciancaglini, P., Bandorowicz Pikula, J., Pikula, S., Magne, D., Volkmann, N., Hanein, D., Millán, J. L., Buchet, R. Matrix vesicles from chondrocytes and osteoblasts: Their biogenesis, properties, functions and biomimetic models. Biochim Biophys Acta. 1862 (3), 532-546 (2018).
- Hessle, L., Johnson, K. A., Anderson, H. C., Narisawa, S., Sali, A., Goding, J. W., Terkeltaub, R., Millan, J. L. Tissue-nonspecific alkaline phosphatase and plasma cell membrane glycoprotein-1 are central antagonistic regulators of bone mineralization. Proc. Natl. Acad. Sci. U. S. A. 99 (14), 9445-9449 (2002).
- Garimella, R., Bi, X., Anderson, H. C., Camacho, N. P. Nature of phosphate substrate as a major determinant of mineral type formed in matrix vesicle-mediated in vitro mineralization: An FTIR imaging study. Bone. 38 (6), 811-817 (2006).
- Thouverey, C., Bechkoff, G., Pikula, S., Buchet, R. Inorganic pyrophosphate as a regulator of hydroxyapatite or calcium pyrophosphate dihydrate mineral deposition by matrix vesicles. Osteoarthr. Cartil. 17, 64-72 (2009).
- Terkeltaub, R. A. Inorganic pyrophosphate generation and disposition in pathophysiology. Am. J. Phys. 281 (1), 1-11 (2001).
- Guicheux, J., Palmer, G., Shukunami, C., Hiraki, Y., Bonjour, J. P., Caverzasio, J. A novel in vitro culture system for analysis of functional role of phosphate transport in endochondral ossification. Bone. 27 (1), 69-74 (2000).
- Yadav, M. C., Bottini, M., Cory, E., Bhattacharya, K., Kuss, P., Narisawa, S., Sah, R. L., Beck, L., Fadeel, B., Farquharson, C., Millán, J. L. Skeletal mineralization deficits and impaired biogenesis and function of chondrocyte-derived matrix vesicles in Phospho1(-/-) and Phospho1/Pi t1 double-knockout mice. J. Bone Miner. Res. 31 (6), 1275-1286 (2016).
- Thouverey, C., Malinowska, A., Balcerzak, M., Strzelecka-Kiliszek, A., Buchet, R., Dadlez, M., Pikula, S. Proteomic characterization of biogenesis and functions of matrix vesicles released from mineralizing human osteoblast-like cells. J. Proteome. 74 (7), 1123-1134 (2011).
- Wang, W., Xu, J., Kirsch, T. Annexin-mediated Ca2+ influx regulates growth plate chondrocyte maturation and apoptosis. J. Biol. Chem. 278 (6), 3762-3769 (2003).
- Nollet, M., Santucci-Darmanin, S., Breuil, V., et al. Autophagy in osteoblasts is involved in mineralization and bone homeostasis. Autophagy. 10 (11), 1965-1977 (2014).
- Boonrungsiman, S., Gentleman, E., Carzaniga, R., Evans, N. D., McComb, D. W., Porter, A. E., Stevens, M. M. The role of intracellular calcium phosphate in osteoblast-mediated bone apatite formation. Proc. Natl. Acad. Sci. U. S. A. 109 (35), 14170-14175 (2012).
- Genge, B. R., Wu, L. N., Wuthier, R. E. In vitro modeling of matrix vesicle nucleation: synergistic stimulation of mineral formation by annexin A5 and phosphatidylserine. J. Biol. Chem. 282 (36), 26035-26045 (2007).
- Jahnen-Dechent, W., Schäfer, B., Ketteler, M., McKee, M. D. Mineral chaperones: a role for fetuin-A and osteopontin in the inhibition and regression of pathologic calcification. J. Mol. Med. (Berl). 86 (4), 379-389 (2008).
- Suchanek, W., Yoshimura, M. Processing and properties of hydroxyapatite-based biomaterials for use as hard tissue replacement implants. J. Miner. Res. 13 (1), 94-117 (1998).
- Pautke, C., Schieker, M., Tischer, T., Kolk, A., Neth, P., Mutschler, W., Milz, S. Characterization of osteosarcoma cell lines MG-63, Saos-2 and U-2 OS in comparison to human osteoblasts. Anticancer Res. 24 (6), 3743-3748 (2004).
- Yen, M. -. L., Chien, C. -. C., Chiu, I. -. M., Huang, H. -. I., Chen, Y. -. C., Hu, H. -. I., Yen, B. L. Multilineage differentiation and characterization of the human fetal osteoblastic 1.19 cell line: a possible in vitro model of human mesenchymal progenitors. Stem Cells. 25 (1), 125-131 (2007).
- Brittle, S. W., Foose, D. P., O’Neil, K. A., Sikon, J. M., Johnson, J. K., Stahler, A. C., Ryan, J. D., Higgins, S. R., Sizemore, I. E. A raman-based imaging method for characterizing the molecular adsorption and spatial distribution of silver nanoparticles to hydrated mineral surfaces. Environ Sci Technol. , (2018).
- Liu, N., Wang, Y., Ge, F., Liu, S., Xiao, H. Antagonistic effect of nano-ZnO and cetyltrimethyl ammonium chloride on the growth of Chlorella vulgaris: Dissolution and accumulation of nano-ZnO. Chemosphere. 196, 566-574 (2018).
- Tasbihi, M., Kočì, K., Troppová, I., Edelmannová, M., Reli, M., Čapek, L., Schomäcker, R. Photocatalytic reduction of carbon dioxide over Cu/TiO2 photocatalysts. Environ Sci Pollut Res Int. , (2017).
- Chen, N. X., O’Neill, K. D., Chen, X., Moe, S. M. Annexin-Mediated Matrix Vesicle Calcification in Vascular Smooth Muscle Cells. J. Bone Miner. Res. 23 (11), 1798-1805 (2008).
- Strzelecka-Kiliszek, A., Bozycki, L., Mebarek, S., Buchet, R., Pikula, S. Characteristics of minerals in vesicles produced by human osteoblasts hFOB 1.19 and osteosarcoma Saos-2 cells stimulated for mineralization. J. Inorg. Bioch. 171, 100-107 (2017).
- Thouverey, C., Strzelecka-Kiliszek, A., Balcerzak, M., Buchet, R., Pikula, S. Matrix vesicles originate from apical membranę microvilli of mineralizing osteoblast-like Saos-2 cells. J. Cell. Biochem. 106 (1), 127-138 (2009).
- Cazalbou, S., Eichert, D., Ranz, X., Drouet, C., Combes, C., Harmand, M. F., Rey, C. Ion exchanges in apatites for biomedical application. J. Mater. Sci. Mater. Med. 16 (5), 405-409 (2005).
- Kraus, D. Consolidated data analysis and presentation using an open-source add-in for the Microsoft Excel® spreadsheet software. Med. Writ. 23 (1), 25-28 (2014).
- Kawasaki, K., Buchanan, A. V., Weiss, K. M. Biomineralization in humans: making the hard choices in life. Annu. Rev. Genet. 43, 119-142 (2009).
- Bonucci, E. Bone mineralization. Front. Biosci. 17, 100-128 (2012).
- Veis, A., Dorvee, J. R. Biomineralization mechanisms: A new paradigm for crystal nucleation in organic matrices. Calcif. Tissue Int. 93 (4), 307-315 (2013).
- Nudelman, F., Lausch, A. J., Sommerdijk, N. A., Sone, E. D. In vitro models of collagen biomineralization. J. Struct. Biol. 183 (2), 258-269 (2013).
- Alliston, T. Biological regulation of bone quality. Curr. Osteoporos. Rep. 12 (3), 366-375 (2014).
- Wang, W., Kirsch, T. Retinoic acid stimulates annexin-mediated growth plate chondrocyte mineralization. J. Cell Biol. 157 (6), 1061-1069 (2002).
- Wang, W., Xu, J., Kirsh, T. Annexin V and terminal differentiation of growth plate chondrocytes. Exp. Cell Res. 305 (1), 156-165 (2005).

