Visualización de la proximidad inducida por caspasas inflamatorias en macrófagos derivados de monocitos humanos
Summary
Este protocolo describe el flujo de trabajo para obtener macrófagos derivados de monocitos (MDM) a partir de muestras de sangre humana, un método simple para introducir eficientemente reporteros de complementación de fluorescencia bimolecular de caspasa inflamatoria (BiFC) en MDM humanos sin comprometer la viabilidad y el comportamiento celular, y un enfoque basado en imágenes para medir la activación de la caspasa inflamatoria en células vivas.
Abstract
Las caspasas inflamatorias incluyen caspasa-1, -4, -5, -11 y -12 y pertenecen al subgrupo de caspasas iniciadoras. La caspasa-1 es necesaria para garantizar la correcta regulación de la señalización inflamatoria y se activa por dimerización inducida por proximidad después del reclutamiento a inflamasomas. La caspasa-1 es abundante en el linaje celular monocítico e induce la maduración de las citoquinas proinflamatorias interleucina (IL)-1β e IL-18 a moléculas secretadas activas. Las otras caspasas inflamatorias, caspasa-4 y -5 (y su homólogo murino caspasa-11) promueven la liberación de IL-1β al inducir piroptosis. La complementación de fluorescencia bimolecular de caspasa (BiFC) es una herramienta utilizada para medir la proximidad inflamatoria inducida por caspasa como una lectura de la activación de la caspasa. El prodominio caspasa-1, -4 o -5, que contiene la región que se une al inflamasoma, se fusiona con fragmentos no fluorescentes de la proteína fluorescente amarilla Venus (Venus-N [VN] o Venus-C [VC]) que se asocian para reformar el complejo fluorescente de Venus cuando las caspasas experimentan proximidad inducida. Este protocolo describe cómo introducir a estos reporteros en macrófagos primarios derivados de monocitos humanos (MDM) utilizando nucleofection, tratar las células para inducir la activación de la caspasa inflamatoria y medir la activación de la caspasa mediante fluorescencia y microscopía confocal. La ventaja de este enfoque es que se puede utilizar para identificar los componentes, los requisitos y la localización del complejo de activación de la caspasa inflamatoria en las células vivas. Sin embargo, se deben considerar controles cuidadosos para evitar comprometer la viabilidad y el comportamiento de las células. Esta técnica es una herramienta poderosa para el análisis de interacciones dinámicas de caspasa a nivel de inflamasoma, así como para el interrogatorio de las cascadas de señalización inflamatoria en MDM vivos y monocitos derivados de muestras de sangre humana.
Introduction
Las caspasas son una familia de proteasas de cisteína aspartato que se pueden agrupar en caspasas iniciadoras y caspasas verdugo. Las caspasas verdugosas comprenden caspasa-3, -6 y -7. Se encuentran naturalmente en las células como dímeros y son escindidos por las caspasas iniciadoras para ejecutar la apoptosis1. Las caspasas iniciadoras incluyen caspasa humana-1, -2, -4, -5, -8, -9, -10 y -12. Se encuentran como zimógenos inactivos (pro-caspasas) que se activan por dimerización inducida por proximidad y se estabilizan mediante escisión autoprotolítica 2,3. Las caspasas inflamatorias son un subconjunto de las caspasas iniciadoras2 y abarcan caspasas-1, -4, -5 y -12 en humanos, y caspasa-1, -11 y -12 enratones 4,5. En lugar de un papel apoptótico, juegan un papel central en la inflamación. Median el procesamiento proteolítico y la secreción de pro-interleucina (IL)-1β y pro-IL-18 6,7, que son las primeras citoquinas que se liberan en respuesta a invasores patógenos 8,9. Caspasa-1 se activa al reclutar en su plataforma de activación; un complejo proteico de gran peso molecular denominado inflamasoma (Figura 1A)10. La dimerización de la caspasa-4, -5 y -11 ocurre independientemente de estas plataformas a través de una vía inflamasómica no canónica 11,12.
Los inflamasomas canónicos son complejos de proteínas multiméricas citosólicas que consisten en una proteína sensora de inflamasoma, la proteína adaptadora ASC (proteína similar a una mota asociada a la apoptosis que contiene una CARD) y la proteína efectora caspasa-110. Los inflamasomas canónicos más estudiados son la familia de receptores similares a NOD que contienen un dominio de pirina (NLRP), NLRP1 y NLRP3, la familia NLR que contiene una CARD (NLRC), NLRC4 y la ausente en el melanoma 2 (AIM2). Cada uno de ellos contiene un dominio de pirina, un CARD o ambos dominios. El dominio CARD media la interacción entre las caspasas que contienen CARD y sus activadores ascendentes. Por lo tanto, la molécula de andamio ASC, que se compone de un dominio de pirina N-terminal (PYD) y un motivo CARD C-terminal 13,14, es necesaria para el reclutamiento de caspasa-1 a los inflamasomas NLRP1 10, NLRP315 y AIM216.
Cada inflamasoma lleva el nombre de su proteína sensora única que reconoce distintos estímulos proinflamatorios (Figura 1B). Los activadores de esta vía se denominan estímulos canónicos. Los inflamasomas sirven como sensores para los componentes microbianos y el estrés tisular, y se ensamblan para desencadenar una respuesta inflamatoria robusta a través de la activación de las caspasas inflamatorias17. El ensamblaje del inflamasoma inicia la activación de la caspasa-1 para mediar la maduración y secreción de sus principales sustratos pro-IL-1β y pro-IL-18. Este proceso se produce a través de un mecanismo de dos pasos. En primer lugar, un estímulo de cebado regula al alza la expresión de ciertas proteínas inflamasomas y pro-IL-1β a través de la activación de la vía NF-κB. En segundo lugar, un estímulo intracelular (canónico) induce el ensamblaje del inflamasoma y el reclutamiento de procaspasa-1 6,7.
Caspasa-4 y caspasa-5 son los ortólogos humanos de la caspasa murina-1111. Se activan de manera independiente del inflamasoma por el lipopolisacárido intracelular (LPS), una molécula que se encuentra en la membrana externa de la bacteria Gram-negativa18,19,20, y por el hemo extracelular, un producto de la hemólisis de glóbulos rojos21. Se ha propuesto que el LPS se une directamente al motivo CARD de estas proteínas e induce su oligomerización20. La activación de la caspasa-4 o caspasa-5 promueve la liberación de IL-1β al inducir una forma inflamatoria de muerte celular llamada piroptosis a través de la escisión de la proteína formadora de poros gasdermin D (GSDMD)18,19. Además, el eflujo de iones potásicos resultantes de la caspasa-4 y la muerte piroptótica mediada por GSDMD induce la activación del inflamasoma NLRP3 y la posterior activación de la caspasa-1 22,23. Por lo tanto, la caspasa-4, -5 y -11 se consideran sensores intracelulares para LPS que son capaces de inducir la activación de la piroptosis y la caspasa-1 en respuesta a estímulos específicos11,24.
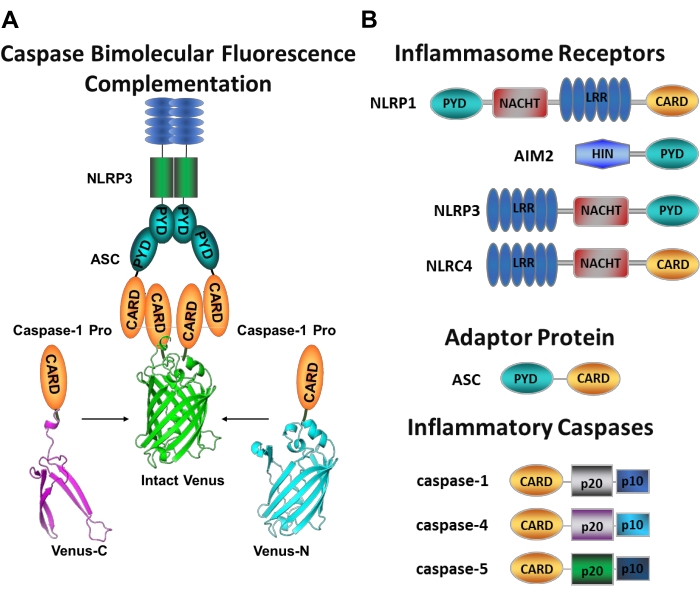
Figura 1: Ensayo de caspasas inflamatorias y complementación de fluorescencia caspasa-bimolecular (BiFC). (A) Diagrama que muestra el sistema caspasa-BiFC, donde dos prodominios de caspasa-1 (C1-pro) unidos a cada fragmento no fluorescente de Venus (Venus-C o Venus-N) se reclutan para la plataforma de activación NLRP3, obligando a Venus a replegarse y fluorescenciar. Este complejo aparece como una mancha verde bajo el microscopio y sirve como una lectura para la proximidad inflamatoria inducida por la caspasa, que es el primer paso en la activación de la caspasa iniciadora. (B) Esquema que muestra la organización del dominio de los componentes del inflamasoma y las caspasas inflamatorias. Haga clic aquí para ver una versión más grande de esta figura.
Medir la activación específica de las caspasas iniciadoras es difícil, y no hay muchos métodos disponibles para hacerlo mediante enfoques de imágenes. La complementación de fluorescencia bimolecular de caspasa (BiFC) se puede utilizar para visualizar la activación de la caspasa inflamatoria directamente en células vivas (Figura 1A)25. Esta técnica ha sido recientemente adaptada para su uso en macrófagos derivados de monocitos humanos (MDM)21. Caspasa BiFC mide el primer paso en la activación de la caspasa inflamatoria, proximidad inducida para facilitar la dimerización. Se utiliza la expresión de plásmidos que codifican el prodominio caspasa que contiene CARD fusionado con fragmentos no fluorescentes de la proteína fluorescente amarilla fotostable Venus (Venus-C [VC]) y Venus-N [VN]). Cuando los dos prodominios de caspasa se reclutan en su plataforma de activación o experimentan proximidad inducida, las dos mitades de Venus se acercan y se ven obligadas a replegarse y fluorescenciar (ver Figura 1A, B). Esto proporciona una lectura en tiempo real de la activación específica de la caspasa inflamatoria.
Los MDM humanos expresan abundantemente genes inflamasomas y receptores de reconocimiento de patrones que identifican señales de peligro y productos patógenos. Esto proporciona un tipo de célula ideal para el interrogatorio de las vías inflamatorias de la caspasa. Además, pueden derivarse de sangre periférica e incluso de muestras de pacientes para evaluar la activación de la caspasa inflamatoria en un estado de enfermedad específico. Este protocolo describe cómo introducir a los reporteros de caspasa BiFC en MDM utilizando nucleofection, un método de transfección basado en electroporación, cómo tratar las células para inducir la activación inflamatoria de la caspasa y cómo visualizar los complejos activos de caspasa utilizando enfoques de microscopía. Además, esta metodología se puede adaptar para determinar la composición molecular de estos complejos, la localización subcelular, la cinética y el tamaño de estas estructuras altamente ordenadas 25,26,27.
Protocol
Representative Results
Discussion
Este protocolo describe el flujo de trabajo para obtener macrófagos a partir de monocitos aislados de muestras de sangre humana y un método para introducir eficientemente los reporteros biFC de caspasa inflamatoria en MDM humano sin comprometer la viabilidad y el comportamiento celular.
Este protocolo aprovecha la técnica BiFC35 para etiquetar las caspasas inflamatorias en el dominio de reclutamiento de caspasa (CARD) con fragmentos no fluorescentes de la proteína f…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Agradecemos a los miembros del laboratorio de LBH pasados y presentes que contribuyeron al desarrollo de esta técnica. Este laboratorio cuenta con el apoyo de NIH/NIDDK T32DK060445 (BEB), NIH/NIDDK F32DK121479 (BEB), NIH/NIGMS R01GM121389 (LBH). La figura 2 se dibujó utilizando el software Biorender.
Materials
| 48 well tissue culture2:34 plates | Genesee Scientific | 25-108 | |
| 10 cm Tissue Culture Dishes | VWR | 25382-166 | |
| 2 Mercaptoethanol 1000x | Thermo Fisher Scientific | 21985023 | |
| 8 well chambered coverglass with 1.5 HP coverglass | Cellvis | c8-1.5H-N | |
| AutoMACS columns | Miltenyi (Biotec) | 130-021-101 | For automated separation using AutoMACS Pro Separator only |
| AutoMACS Pro Separator | Miltenyi (Biotec) | 130-092-545 | For automated separation using AutoMACS Pro Separator only |
| AutoMACS Pro Washing Solution | Miltenyi (Biotec) | 130-092-987 | For automated separation using AutoMACS Pro Separator only |
| AutoMACS Rinsing Solution | Miltenyi (Biotec) | 130-091-222 | For automated separation using AutoMACS Pro Separator only |
| AutoMacs running buffer | Miltenyi (Biotec) | 130-091-221 | For manual or automated separation using QuadroMACS or AutoMACS pro Separator |
| Axio Observer Z1 motorized inverted microscope equipped with a CSU-X1A 5000 spinning disk unit | Zeiss | Any confocal microscope equipped with a laser module fitted with laser lines of 568 nm (RFP) and 488 or 512 nm (GFP or YFP) wavelengths can be used | |
| AxioObserver A1, Research Grade Inverted Microscope | Zeiss | Any epifluorescence microscope with fluorescence filters capable of exciting 568 nm (RFP) and 488 or 512 nm (GFP or YFP) wavelengths can be used | |
| CD14+ MICROBEADS | Miltenyi (Biotec) | 130-050-201 | For manual or automated separation using QuadroMACS or AutoMACS pro Separator |
| DPBS without calcium chloride and magnesium chloride | Sigma | D8537-6x500ML | |
| DsRed mito plasmid | Clontech | 632421 | Similar plasmids that can be used as fluorescent reporters can be found on Addgene |
| Fetal Bovine Serum | Thermo Fisher Scientific | 10437028 | |
| Ficoll-Paque PLUS 6 x 100 mL | Sigma | GE17-1440-02 | |
| GlutaMAX Supplement (100x) | Thermo Fisher Scientific | 35050079 | |
| GM-CSF | Thermo Fisher Scientific | PHC2011 | |
| Hemin BioXtra, from Porcine, ≥96.0% (HPLC) | Sigma | 51280-1G | |
| HEPES | Thermo Fisher Scientific | 15630106 | |
| Inflammatory caspase BiFC plasmids | Available by request from LBH lab | ||
| LPS-EB Ultrapure | Invivogen | TLRL-3PELPS | |
| LS Columns | Miltenyi (Biotec) | 130-042-401 | For manual separation using QuadroMACS Separator only |
| MACS 15 mL Tube Rack | Miltenyi (Biotec) | 130-091-052 | For manual separation using QuadroMACS Separator only |
| MACS MultiStand | Miltenyi (Biotec) | 130-042-303 | For manual separation using QuadroMACS Separator only |
| mCherry plasmid | Yungpeng Wang Lab | Similar plasmids that can be used as fluorescent reporters can be found on Addgene | |
| Neon Transfection System | Thermo Fisher Scientific | MPK5000 | Includes Neon electroporation device, pipette and pipette station |
| Neon Transfection System 10 µL Kit | Thermo Fisher Scientific | MPK1096 | Includes resuspension buffer R, resuspension buffer T, electrolytic buffer E, 96 x 10 µL Neon tips and Neon electroporation tubes |
| Nigericin sodium salt, ready made solution | Sigma | SML1779-1ML | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | 15140122 | |
| Poly-D-Lysine Hydrobromide | Sigma | P7280-5mg | |
| QuadroMACS Separator | Miltenyi (Biotec) | 130-090-976 | For manual separation using QuadroMACS Separator only |
| qVD-OPh | Fisher (ApexBio) | 50-101-3172 | |
| RPMI 1640 Medium | Thermo Fisher Scientific | 11875119 | |
| Trypsin-EDTA (0.25%), phenol red | Thermo Fisher Scientific | 25200072 | |
| UltraPure 0.5 M EDTA, pH 8.0 | Thermo Fisher Scientific | 15575020 | |
| Zeiss Zen 2.6 (blue edition) software | Zeiss | Any software used to operate the confocal microscope of choice |
References
- Boatright, K. M., et al. A unified model for apical caspase activation. Molecular Cell. 11 (2), 529-541 (2003).
- Pop, C., Salvesen, G. S. Human caspases: activation, specificity, and regulation. Journal of Biological Chemistry. 284 (33), 21777-21781 (2009).
- Boice, A., Bouchier-Hayes, L. Targeting apoptotic caspases in cancer. Biochimica et Biophysica Acta (BBA) – Molecular Cell Research. 1867 (6), 118688 (2020).
- Bolívar, B. E., Vogel, T. P., Bouchier-Hayes, L. Inflammatory caspase regulation: maintaining balance between inflammation and cell death in health and disease. The FEBS Journal. 286 (14), 2628-2644 (2019).
- Martinon, F., Tschopp, J. Inflammatory caspases: linking an intracellular innate immune system to autoinflammatory diseases. Cell. 117 (5), 561-574 (2004).
- Lamkanfi, M., Vishva, M. D. Mechanisms and functions of inflammasomes. Cell. 157 (5), 1013-1022 (2014).
- Viganò, E., et al. Human caspase-4 and caspase-5 regulate the one-step noncanonical inflammasome activation in monocytes. Nature Communications. 6, 8761 (2015).
- Cerretti, D. P., et al. Molecular cloning of the interleukin-1 beta converting enzyme. Science. 256 (5053), 97 (1992).
- van de Veerdonk, F. L., Netea, M. G., Dinarello, C. A., Joosten, L. A. Inflammasome activation and IL-1β and IL-18 processing during infection. Trends in Immunology. 32 (3), 110-116 (2011).
- Martinon, F., Burns, K., Tschopp, J. The inflammasome: a molecular platform triggering activation of inflammatory caspases and processing of proIL-beta. Molecular Cell. 10 (2), 417-426 (2002).
- Kayagaki, N., et al. Noncanonical inflammasome activation targets caspase-11. Nature. 479 (7371), 117-121 (2011).
- Kayagaki, N., et al. Noncanonical inflammasome activation by intracellular LPS independent of TLR4. Science. 341 (6151), 1246-1249 (2013).
- Masumoto, J., et al. ASC, a novel 22-kDa protein, aggregates during apoptosis of human promyelocytic leukemia HL-60 cells. The Journal of Biological Chemistry. 274 (48), 33835-33838 (1999).
- Bertin, J., DiStefano, P. S. The PYRIN domain: a novel motif found in apoptosis and inflammation proteins. Cell Death and Differentiation. 7 (12), 1273-1274 (2000).
- Agostini, L., et al. NALP3 forms an IL-1beta-processing inflammasome with increased activity in Muckle-Wells autoinflammatory disorder. Immunity. 20 (3), 319-325 (2004).
- Bürckstümmer, T., et al. An orthogonal proteomic-genomic screen identifies AIM2 as a cytoplasmic DNA sensor for the inflammasome. Nature Immunology. 10 (3), 266-272 (2009).
- Latz, E., Xiao, T. S., Stutz, A. Activation and regulation of the inflammasomes. Nature Reviews Immunology. 13 (6), 397-411 (2013).
- Kayagaki, N., et al. Caspase-11 cleaves gasdermin D for noncanonical inflammasome signalling. Nature. 526 (7575), 666-671 (2015).
- Shi, J., et al. Cleavage of GSDMD by inflammatory caspases determines pyroptotic cell death. Nature. 526 (7575), 660-665 (2015).
- Shi, J., et al. Inflammatory caspases are innate immune receptors for intracellular LPS. Nature. 514 (7521), 187-192 (2014).
- Bolívar, B. E., et al. Noncanonical Roles of Caspase-4 and Caspase-5 in Heme-Driven IL-1β Release and Cell Death. The Journal of Immunology. 206 (8), 1878-1889 (2021).
- Schmid-Burgk, J. L., et al. Caspase-4 mediates noncanonical activation of the NLRP3 inflammasome in human myeloid cells. European Journal of Immunology. 45 (10), 2911-2917 (2015).
- Baker, P. J., et al. NLRP3 inflammasome activation downstream of cytoplasmic LPS recognition by both caspase-4 and caspase-5. European Journal of Immunology. 45 (10), 2918-2926 (2015).
- Cullen, S. P., Kearney, C. J., Clancy, D. M., Martin, S. J. Diverse activators of the NLRP3 inflammasome promote IL-1β secretion by triggering necrosis. Cell Reports. 11 (10), 1535-1548 (2015).
- Sanders, M. G., et al. Single-cell imaging of inflammatory caspase dimerization reveals differential recruitment to inflammasomes. Cell Death & Disease. 6, 1813 (2015).
- Charendoff, C. I., Bouchier-Hayes, L. Lighting up the pathways to caspase activation using bimolecular fluorescence complementation. Journal of Visualized Experiments: JoVE. (133), e57316 (2018).
- Bouchier-Hayes, L., et al. Characterization of cytoplasmic caspase-2 activation by induced proximity. Molecular Cell. 35 (6), 830-840 (2009).
- Riedhammer, C., Halbritter, D., Weissert, R. Peripheral blood mononuclear cells: Isolation, Freezing, thawing, and culture. Methods in Molecular Biology. 1304, 53-61 (2016).
- Betsou, F., Gaignaux, A., Ammerlaan, W., Norris, P. J., Stone, M. Biospecimen science of blood for peripheral blood mononuclear cell (PBMC) functional applications. Current Pathobiology Reports. 7 (2), 17-27 (2019).
- Perregaux, D., et al. IL-1 beta maturation: evidence that mature cytokine formation can be induced specifically by nigericin. The Journal of Immunology. 149 (4), 1294-1303 (1992).
- Cheneval, D., et al. Increased mature interleukin-1β (IL-1β) secretion from THP-1 cells induced by nigericin is a result of activation of p45 IL-1β-converting enzyme processing. Journal of Biological Chemistry. 273 (28), 17846-17851 (1998).
- Fernandes-Alnemri, T., et al. The pyroptosome: a supramolecular assembly of ASC dimers mediating inflammatory cell death via caspase-1 activation. Cell Death and Differentiation. 14 (9), 1590-1604 (2007).
- Lu, A., et al. Unified polymerization mechanism for the assembly of ASC-dependent inflammasomes. Cell. 156 (6), 1193-1206 (2014).
- Muller-Eberhard, U., Javid, J., Liem, H. H., Hanstein, A., Hanna, M. Brief report: Plasma concentrations of hemopexin, haptoglobin and heme in patients with various hemolytic diseases. Blood. 32 (5), 811-815 (1968).
- Shyu, Y. J., Liu, H., Deng, X., Hu, C. D. Identification of new fluorescent protein fragments for bimolecular fluorescence complementation analysis under physiological conditions. Biotechniques. 40 (1), 61-66 (2006).
- Thornberry, N. A., et al. A novel heterodimeric cysteine protease is required for interleukin-1βprocessing in monocytes. Nature. 356 (6372), 768-774 (1992).
- Jensen, K., Anderson, J. A., Glass, E. J. Comparison of small interfering RNA (siRNA) delivery into bovine monocyte-derived macrophages by transfection and electroporation. Veterinary Immunology and Immunopathology. 158 (3-4), 224-232 (2014).
- Tada, Y., Sakamoto, M., Fujimura, T. Efficient gene introduction into rice by electroporation and analysis of transgenic plants: use of electroporation buffer lacking chloride ions. Theoretical and Applied Genetics. 80 (4), 475-480 (1990).
- Bhowmik, P., et al. Targeted mutagenesis in wheat microspores using CRISPR/Cas9. Scientific Reports. 8 (1), 6502 (2018).
- Sansom, D. M., Manzotti, C. N., Zheng, Y. What’s the difference between CD80 and CD86. Trends in Immunology. 24 (6), 314-319 (2003).
- Kurokawa, M., Kornbluth, S. Caspases and kinases in a death grip. Cell. 138 (5), 838-854 (2009).

