アフィニティークロマトグラフィーを用いたヒトマトリックスメタロプロテイナーゼ-3の細菌発現と精製
Summary
hisタグの精製、透析、および活性化は、細菌における可溶性で活性なマトリックスメタロプロテイナーゼ-3触媒ドメインタンパク質発現の収率を増加させるために用いられる。タンパク質画分は、SDS-PAGEゲルを介して分析される。
Abstract
マトリックスメタロプロテイナーゼ(MMP)は、細胞外マトリックス(ECM)の分解およびリモデリング、ならびにいくつかの成長因子およびサイトカインとの相互作用において中心的な役割を果たすメチンチンプロテアーゼのファミリーに属する。特定のMMPの過剰発現は、癌、神経変性疾患、および心血管疾患などのいくつかの疾患において責任がある。MMPは、MMPの過剰発現と相関する疾患を治療できる治療法を開発する標的として、近年注目されている。
溶液中のMMPメカニズムを研究するためには、活性で可溶性MMPの生産のために、より容易で堅牢な組換えタンパク質の発現および精製方法が必要である。しかし、ほとんどのMMPの触媒ドメインは、翻訳後機構の欠如のために可溶性形態で 大腸菌 (E. coli)で発現することができないが、哺乳類の発現系は通常高価であり、収率が低い。MMP封入体は、広範な精製およびリフォールディングの退屈で面倒なプロセスを経なければならず、天然の立体構造におけるMMPの収率を著しく低下させる。本稿では、Rosetta2(DE3)pLysS(以下、R2DPという)細胞を用いて、N末端Hisタグとそれに続くプロドメイン(Hisx6-pro-MMP-3cd)を含むマトリックスメタロプロテイナーゼ-3触媒ドメイン(MMP-3cd)を作製するためのプロトコールを提示する。R2DP細胞は、細菌発現系において通常稀なコドンを含むクロラムフェニコール耐性プラスミドを介して真核生物タンパク質の発現を増強する。組換えタンパク質発現に最適な従来の細胞株BL21(DE3)と比較して、この新しい株を用いた精製により、精製Hisx6-pro-MMP-3cdの収率が向上しました。活性化および脱塩時に、プロドメインはN末端Hisタグとともに切断され、無数の インビトロ用途で 即時使用するための活性MMP-3cdを提供する。この方法は、高価な装置または複雑な融合タンパク質を必要とせず、細菌における組換えヒトMMPの迅速な生産を記載する。
Introduction
ほとんどの複雑な真核生物タンパク質は、発現後に精巧な翻訳後修飾を受け、高度に支援されたタンパク質の折り畳みと補因子が機能的であることを必要とする1。細菌宿主中で大量の可溶性ヒトタンパク質を生産することは、小規模の実験室実験であっても、高いコストと堅牢な発現および精製方法の欠如のために、依然として大きな課題です2,3。MMPsは、分子量の大きいヒトエンドペプチダーゼであり、大腸菌で発現すると通常不溶性封入体として発現される。可溶性ヒトMMPの抽出は、しばしば面倒で時間のかかる可溶化およびリフォールディングプロセスにつながる4。
MMPは、生理学的および病原性プロセスの両方において重要な役割を果たしている。ヒトMMPは、23個の亜鉛エンドペプチダーゼのファミリーであり、構造および基質特異性によって分類され、高度に保存された触媒ドメインにもかかわらず差動的に発現される5,6。MMPsは、不活性なザイモゲンとして分泌され、翻訳後活性化およびそれらの内因性阻害剤を介して調節される、メタロプロテイナーゼ(TIMP)の組織阻害剤7、8、9、10。MMPは当初、ECMの代謝回転における役割が認識されていましたが、発生、形態形成、組織修復、およびリモデリングにも関与しています8。MMPの調節不全は、神経変性疾患、心臓血管疾患、線維性疾患などとともにがんと顕著に関連しています5,7。
堅牢な大規模MMP生産法の開発は、生化学的および細胞ベースのアッセイによるMMPメカニズムの将来の研究の成功を確実にするために不可欠です。Hisx6タグ付きMMPを含む様々なMMPが、MMP活性を変化させることなく、細菌11において以前に発現されてきた12、13、14、15。ただし、これらの方法には、複製が困難な退屈で長い手順が含まれます。
哺乳類細胞は、適切な翻訳後修飾を確保しながら、多くの異なるヒトタンパク質を発現させるためにも使用できます16。哺乳類の発現系は、適切な翻訳後修飾を有する組換えヒトタンパク質を産生するのに理想的な選択であるが、この方法の主な欠点は、初期の低収量、高価な増殖培地および試薬、安定した発現ラインに到達するまでの長いタイムライン、および真菌または細菌などの他の種による汚染のリスクである2,11。.さらに、哺乳動物細胞株におけるMMP産生は、TIMPまたはフィブロネクチン11などの関連する細胞タンパク質から不純物を生じる。哺乳類細胞で観察される遅い細胞増殖とは異なり、細菌発現系は、より単純な培地および増殖要件とともに、短期間で大規模なタンパク質生産を提供する。しかし、細菌発現系には他の関連する細胞タンパク質(すなわちTIMP)がないため、高濃度の活性MMPは自己タンパク質分解による分解を受け、MMP収率が低下する17。
本稿では、MMPs2,3,18の手頃な価格、単純さ、およびより高い収率の生産に成功しているため、大腸菌を発現宿主として用いた組換えHisx6-pro-MMP-3cdの細菌発現、精製、および活性化の詳細な方法を説明する。大腸菌は組換えMMPやその他の複雑なタンパク質に必要なタンパク質折り畳み機構と翻訳後プロセシングを欠いているため、多くの大腸菌株がこれらの制限を克服するように設計されており、大腸菌は組換えヒトMMP-3cdの発現に適した宿主となっています,19,20。.例えば、本研究で用いたR2DP株は、大腸菌でめったに使用されないコドンを含むクロラムフェニコール耐性プラスミドを供給することにより、真核生物の発現を増強する。
このプロトコールに記載されているように、R2DP細胞においてpET-3aベクター(図1)から比較的純粋な封入体を過剰発現させた後、Hisx6-pro-MMP-3触媒ドメイン(MMP-3cd)タンパク質を抽出し、変性させる4。Hisx6-プロ-MMP-3cd3,19をアフィニティータグクロマトグラフィーを用いて精製した。リフォールディングおよび透析時に、プロMMP-3cd(ザイモゲン)を4-アミノフェニル水銀アセテート(APMA)によって活性化し、SDS-PAGE分析を使用して収率およびさらなる精製の必要性を評価する5,21。このプロトコルは、可溶性MMP-3cdの発現、精製、および活性化を例として記載する。しかしながら、同様の発現、および活性化機構を有する他のMMPsおよびヒトプロテアーゼの発現のためのガイドとしても使用され得る(図2)。MMP-3cd以外の他のタンパク質については、このプロトコールを試みる前に、標的タンパク質に最適なバッファー組成と方法を決定することをお勧めします。
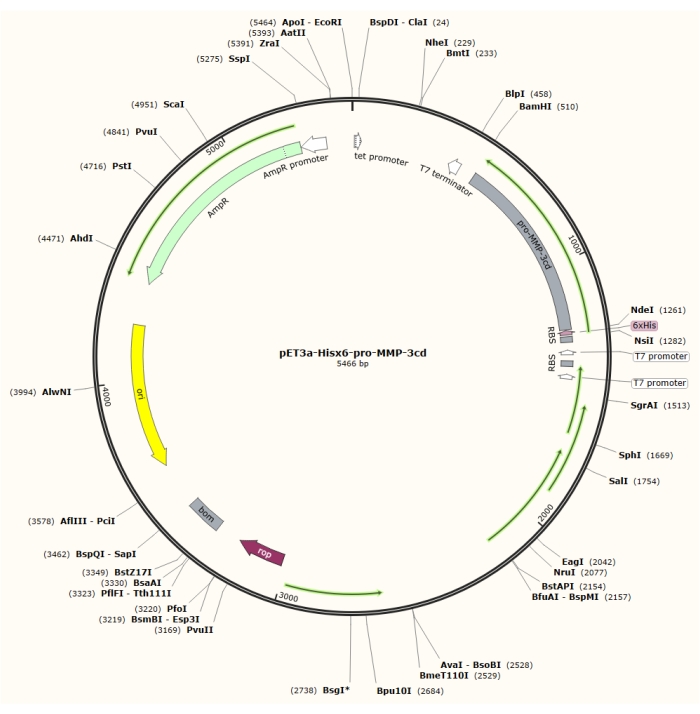
図1:pET-3a-Hisx6-pro-MMP-3cdプラスミドのプラスミドマップ。 このpET-3aベクターは、アンピシリン耐性遺伝子を含む。N末端Hisx6タグ配列をプロMMP-3cdを含むpET-3aベースのベクターにクローニングし、BamHIとNdeI制限部位との間のT7プロモーターの制御下でpET-3a-Hisx6-プロMMP-3cd構築物を作製する。 この図の拡大版を表示するには、ここをクリックしてください。
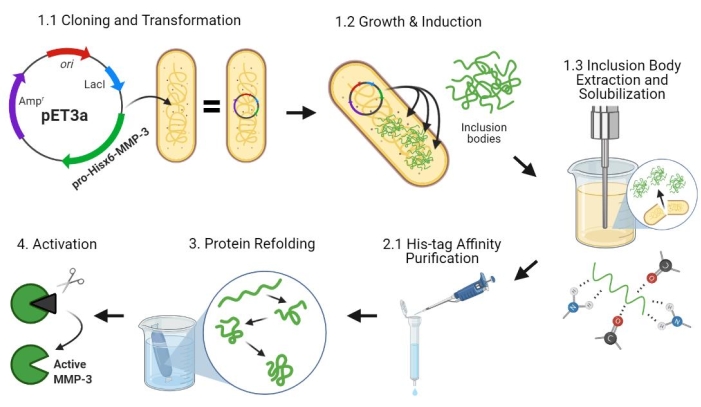
図2:プロMMP-3cdの細菌発現、精製、リフォールディング、および活性化 。 1.1:pET-3a-Hisx6-pro-MMP-3cdプラスミドをBL21(DE3)またはR2DP細胞に形質転換した。2:IPTGを用いてPro-MMP-3cdタンパク質発現を誘導した。1.3:化学溶解および超音波処理は、主に不溶性であり、封入体に見られるHisx6-pro-MMP-3cdタンパク質を抽出するために使用されます。尿素は、封入体からタンパク質を変性および可溶化するために使用された。変性Hisx6-pro-MMP-3cdタンパク質をアフィニティークロマトグラフィー精製により精製した。3. 溶出したHisx6-pro-MMP-3cdは、透析中に緩衝液から尿素を徐々に除去することにより、ゆっくりとリフォールディングした。最後に、リフォールディングされたMMP-3cdタンパク質を、N末端プロペプチドドメインを除去することによってAPMAを用いて活性化した。APMAは、後に脱塩によって溶液から除去される。番号は、これらの手順を説明するプロトコルのセクションに対応しています。略語: MMP-3cd = マトリックスメタロプロテイナーゼ-3触媒ドメイン;APMA=4-アミノフェニル水銀アセテート。 この図の拡大版を表示するには、ここをクリックしてください。
Protocol
Representative Results
Discussion
可溶性、ヒト、組換えMMPの大規模生産は依然として困難な課題である。哺乳類細胞は高いコストと長い待ち時間で機能的なMMPを発現することができますが、大腸菌は精製とリフォールディングが必要な大量のMMP封入体を急速に産生します11,16。R2DP細胞はMMP封入体の収量を大幅に増加させ、より費用対効果が高く生産的なMMPリフォールディン?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
著者らは、フロリダ州ジャクソンビルのメイヨークリニックのEvette Radisky博士とAlexandra Hockla博士が、Hisx6pro-MMP-3cd遺伝子をクローニングするためのテンプレートとしてpET-3a-pro-MMP-3cdプラスミドを提供したこと、および彼らのコメントを、DNAシーケンシングのためにネバダ大学リノ校のネバダゲノミクスセンターのPaul Hartley博士とともに認めたい。著者らはまた、タンパク質発現の一部を支援してくれたCassandra Hergenrader氏にも感謝したい。M.R.-S.NIH-P20 GM103650-COBRE Integrative Neuroscience GrantとUNR R&D mICRO SEED Grant Awardに感謝します。
Materials
| 0.22 µm sterile filter | Sigma Aldrich | SLGP033RS | Used to remove some contaminants from the protein extract before purification, and prevent the Ni-NTA column from clogging |
| 1 L Erlenmeyer flasks | Thermo Fisher Scientific | S76106F | n/a |
| 1 L glass bottles | Thermo Fisher Scientific | 06-414-1D | n/a |
| 1.5 mL microfuge tubes | Thermo Fisher Scientific | 02-682-002 | n/a |
| 15 mL conical tubes | Thermo Fisher Scientific | 339650 | n/a |
| 18 G, 1-in. beveled needle | Amazon | B07S7VBHM2 | Used in combination with the dialysis casette |
| 2 mL desalting column | Thermo Fisher Scientific | 89890 | Removes APMA following activation |
| 2-(N-Morpholino)ethanesulfonic acid (MES) | Thermo Fisher Scientific | AAA1610422 | n/a |
| 250 mL conical bottle cushions | Thermo Fisher Scientific | 05-538-53A | Stabilize conical bottles during large-volume centrifugation |
| 250 mL conical bottles | Thermo Fisher Scientific | 05-538-53 | n/a |
| 400 mL stirred cell | Sigma Aldrich | UFSC40001 | Re-concentrates a much larger volume than the centrifugal filter unit. Rosetta2(DE3)pLysS cells produce high volumes of protein that may exceed the 15 mL limit of the centrifugal filter unit |
| 4-aminophenylmercuric acetate (APMA) | Sigma Aldrich | A9563-5G | Activates MMP-3 by cleaving the propeptide |
| 5 mL syringe | Thermo Fisher Scientific | NC0829167 | Used in combination with the dialysis casette |
| 50 mL conical tubes | Thermo Fisher Scientific | 339650 | Used for storage in many purification steps |
| 50 mL re-concentration tube | Sigma Aldrich | UFC901024D | Used for re-concentrating protein samples after dialysis or removing contaminants |
| Agar | Thermo Fisher Scientific | BP1423-500 | Buffer ingredient that solidifies autoclaved LB media upon cooling |
| Ampicillin | Thermo Fisher Scientific | BP1760-25 | Antibiotic used with pET3a vector; used at 100 µg/mL in LB media |
| BamHI | NEB | R3136S | Restriction enzyme to be used with the pET3a vector |
| Calcium chloride (CaCl2) | Thermo Fisher Scientific | 600-30-23 | The calcium ion stabilizes MMP structure |
| Cell spreaders | Thermo Fisher Scientific | 50-189-7544 | Can be used to spread cells across a petri dish after transformation |
| Chloramphenicol | Thermo Fisher Scientific | 22-055-125GM | Antibiotic used with pET3a vector; used at 34 µg/mL in LB media |
| Dialysis Buffer 1 | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 150 mM NaCl, 10 mM CaCl2, 1 µM ZnCl2, 4 M Urea. |
| Dialysis Buffer 2 | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 150 mM NaCl, 10 mM CaCl2, 1 µM ZnCl2, 2 M Urea. |
| Dialysis Buffer 3 | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 150 mM NaCl, 10 mM CaCl2 , 1 µM ZnCl2. |
| Dialysis clips | Thermo Fisher Scientific | 68011 | Used in combination with snakeskin dialysis tubing |
| Dialysis tubing | Thermo Fisher Scientific | 88243 | Alternative dialysis method that holds much larger sample volumes, but with higher risk of sample loss |
| Digest buffer | NEB | B7204S | Buffer used in digesting the pET3a vector |
| Disposable cuvettes | Thermo Fisher Scientific | 21-200-257 | Used to measure the bacterial culture OD during growth and expression |
| Dithiothreitol (DTT) | Thermo Fisher Scientific | D107125G | Assists with protein denaturation by reducing any disulfide bonds |
| DNA assembly mix | NEB | E2621S | Used to ligate the Hisx6-pro-MMP-3cd PCR product and digested pET3a vector |
| DNase I | NEB | M0303S | Endonuclease for degrading unfavorable DNA contaminants that could later affect protein purification |
| Ethanol | Thermo Fisher Scientific | A995-4 | n/a |
| Ethylenediaminetetraacetic acid (EDTA) | Thermo Fisher Scientific | J15694-AE | Used in denaturation. Prevents oxidation and subsequent formation of disulfide bonds |
| Gel recovery kit | Promega | A9281 | Isolates and purifies DNA from agarose gels |
| Glycerol | Thermo Fisher Scientific | G33-500 | Used for making glycerol stocks, which are frozen at -80 °C |
| Gravity flow column | BioRad | 7321010 | Used for Ni-NTA purification of recombinantly His-tagged proteins |
| Guanidine hydrochloride (GdnHCl) | Thermo Fisher Scientific | AAA135430B | Second chaotropic agent used for disrupting protein secondary structure. |
| High-transformation efficiency cells | NEB | C2987 | High-transformation efficiency cells with greater chance of success for cloning the N-terminal His-tag into the pET3a-pro-MMP-3cd construct |
| HT Elution Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 6 M urea, 250 mM imidazole. Adjust pH to 7.4 |
| HT Equilibration Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 6 M urea. Adjust pH to 7.4 |
| HT Regeneration Buffer | n/a | n/a | 20 mM MES, 0.1 M NaCl. Adjust pH to 5.0 |
| HT Wash Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 6 M urea, 25 mM imidazole. Adjust pH to 7.4 |
| Hydrochloric acid (HCl) | Thermo Fisher Scientific | A144C-212 | Used to pH buffers |
| Imidazole | Thermo Fisher Scientific | AAA1022122 | Mimics the histidine side group. Used to separate non-specifically binding proteins from the his-tagged target protein |
| Inclusion Body Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 1 mM EDTA, 100 mM NaCl, 5 mM DTT, 2% v/v Triton X 100, 0.5 M Urea. Adjust pH to 8.0 |
| Isopropyl-ß-D-thiogalactopyranoside (IPTG) | Thermo Fisher Scientific | FERR0392 | A reagent that induces target gene expression in pET3a. Make 0.5 mL 1 M aliquots, filter sterilize and store in -20 °C |
| LB Amp CamR media | n/a | n/a | To be poured into a sterible 1 L bottle or 1 L flask. For 1 L, add 25 g LB Broth. Sterilize by autoclaving. Once cooled to below 50 °C, add ampicillin to 100 µg/mL and chloramphenicol to 34 µg/mL |
| LB Amp CamR plates | n/a | n/a | To be poured into sterile petri dishes. Pour until the petri dish lid is completely covered. 1 L of media yields 40-60 plates. For 1 L: 25 g LB Broth, 16 g Agar. Sterilize by autoclaving. Once cooled to below 50 °C, add ampicillin to 100 µg/mL and chloramphenicol to 34 µg/mL |
| LB Broth | Thermo Fisher Scientific | BP1426-2 | Pre-mixed with tryptone, yeast extract, and sodium chloride |
| Lysis Buffer | n/a | n/a | 50 mM Tris-HCl (pH 8.0), 1 mM EDTA, 100 mM NaCl, 0.133 g/mL lysozyme, 0.49% v/v Triton X-100. Adjust pH to 8.0 |
| Lysozyme | MP Biomedicals | 195303 | Used in protein extraction. Enzyme that lyses bacterial cell walls |
| Miniprep kit | Promega | A1330 | If successful, extracts the pET3a-pro-MMP-3cd construct from transformants |
| NdeI | NEB | R0111S | Restriction enzyme to be used with the pET3a vector |
| Ni-NTA resin | Thermo Fisher Scientific | PI88221 | Used to bind recombinant his-tagged proteins. This strong interaction can be displaced with higher concentrations of imidazole |
| PCR mix | NEB | M0492S | A PCR reagent for inserting an N-terminal his-tag into the pET3a-pro-MMP-3cd vector |
| pET plasmid | Addgene | n/a | The pET3a vector offers ampicillin resistance, inducible expression of a target gene, and sequencing with T7 primers |
| Petri dishes | VWR | 25384-342 | Used for plating transformants on LB agar media |
| R2DP cells | Novagen | 714033 | BL21 derivatives with enhanced expression of eukaryotic proteins. Contain tRNAs of codons found to be rare in e. coli |
| SOC growth media | NEB | B9020S | Non-selective growth media for rapid growth during transformation |
| Sodium chloride (NaCl) | Thermo Fisher Scientific | BP358-1 | Used in buffers and helps with protein stability |
| Sodium deoxycholate | Thermo Fisher Scientific | PI89905 | Detergent used in protein extraction. Lyses cell walls |
| Solubilization Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 10 mM DTT, 6 M Urea. Adjust pH to 8.0 |
| Tris base | Thermo Fisher Scientific | BP152-1 | Common buffer used in the physiological pH range. Temperature-sensitive |
| Triton X-100 | Thermo Fisher Scientific | M1122980101 | Detergent used for cell lysis |
| Urea | Thermo Fisher Scientific | AAJ75826A7 | First chaotropic agent for disrupting protein secondary structure |
| Zinc chloride (ZnCl2) | Thermo Fisher Scientific | AAA162810E | Stabilizes MMP structure. The zinc ion is found in the catalytic site of MMP-3 |
References
- Portolano, N., et al. Recombinant protein expression for structural biology in HEK 293F suspension cells: A novel and accessible approach. Journal of Visualized Experiments: JoVE. (92), e51897 (2014).
- Subedi, G. P., Johnson, R. W., Moniz, H. A., Moremen, K. W., Barb, A. High yield expression of recombinant human proteins with the transient transfection of HEK293 cells in suspension. Journal of Visualized Experiments: JoVE. (106), e53568 (2015).
- Nilvebrant, J., Alm, T., Hober, S. Orthogonal protein purification facilitated by a small bispecific affinity tag. Journal of Visualized Experiments: JoVE. (59), e3370 (2012).
- Yang, Z., et al. Highly efficient production of soluble proteins from insoluble inclusion bodies by a two-step-denaturing and refolding method. PLoS One. 6 (7), 22981 (2011).
- Hu, X., Beeton, C. Detection of functional matrix metalloproteinases by zymography. Journal of Visualized Experiments: JoVE. (45), e2445 (2010).
- Radisky, E. S., Raeeszadeh-Sarmazdeh, M., Radisky, D. C. Therapeutic potential of matrix metalloproteinase inhibition in breast cancer. Journal of Cellular Biochemistry. 118 (11), 3531-3548 (2017).
- Raeeszadeh-Sarmazdeh, M., Do, L. D., Hritz, B. G. Metalloproteinases and their inhibitors: Potential for the development of new therapeutics. Cells. 9 (5), 1313 (2020).
- Nagase, H., Visse, R., Murphy, G. Structure and function of matrix metalloproteinases and TIMPs. Cardiovascular Research. 69 (3), 562-573 (2006).
- Raeeszadeh-Sarmazdeh, M., et al. Directed evolution of the metalloproteinase inhibitor TIMP-1 reveals that its N- and C-terminal domains cooperate in matrix metalloproteinase recognition. Journal of Biological Chemistry. 294 (24), 9476-9488 (2019).
- Batra, J., et al. Matrix metalloproteinase-10 (MMP-10) interaction with tissue inhibitors of metalloproteinases TIMP-1 and TIMP-2. Journal of Biological Chemistry. 287 (19), 15935-15946 (2012).
- Singh, K. K., Jain, R., Ramanan, H., Saini, D. K., Galea, C. A. Expression and purification of matrix metalloproteinases in Escherichia coli. Matrix Metalloproteases. , 3-16 (2017).
- Manka, S. W., et al. Structural insights into triple-helical collagen cleavage by matrix metalloproteinase 1. Proceedings of the National Academy of Sciences of the United States of America. 109 (31), 12461-12466 (2012).
- Gomis-Ruth, F. X., et al. Mechanism of inhibition of the human matrix metalloproteinase stromelysin-1 by TIMP-1. Nature. 389 (6646), 77-81 (1997).
- Shirian, J., et al. Converting a broad matrix metalloproteinase family inhibitor into a specific inhibitor of MMP-9 and MMP-14. FEBS Letters. 592 (7), 1122-1134 (2018).
- Li, C., et al. Purification of recombinant histidine-tagged catalytic domain of MMP-13 in one step using affinity column and renaturation of it with histidine tag. Journal of Liquid Chromatography & Related Technologies. 37 (15), 2118-2130 (2014).
- Aydin, H., Azimi, F. C., Cook, J. D., Lee, J. E. A convenient and general expression platform for the production of secreted proteins from human cells. Journal of Visualized Experiments: JoVE. (65), e4041 (2012).
- McNiff, M. L., Haynes, E. P., Dixit, N., Gao, F. P., Laurence, J. S. Thioredoxin fusion construct enables high-yield production of soluble, active matrix metalloproteinase-8 (MMP-8) in Escherichia coli. Protein Expression and Purification. 122, 64-71 (2016).
- Maity, R., et al. GST-His purification: A two-step affinity purification protocol yielding full-length purified proteins. Journal of Visualized Experiments: JoVE. (80), e50320 (2013).
- Stefan, A., Ceccarelli, A., Conte, E., Montón Silva, A., Hochkoeppler, A. The multifaceted benefits of protein co-expression in Escherichia coli. Journal of Visualized Experiments: JoVE. (96), e52431 (2015).
- Yadavalli, R., Sam-Yellowe, T. HeLa based cell free expression systems for expression of Plasmodium rhoptry proteins. Journal of Visualized Experiments: JoVE. (100), e52772 (2015).
- Zeytuni, N., Zarivach, R. Purification of the M. magneticum strain AMB-1 magnetosome associated protein MamAΔ41. Journal of Visualized Experiments: JoVE. (37), e1844 (2010).

