Espressione batterica e purificazione della metalloproteinasi-3 della matrice umana mediante cromatografia di affinità
Summary
La purificazione, la dialisi e l’attivazione di His-tag sono impiegate per aumentare le rese di espressione proteica del dominio catalitico solubile e a matrice attiva metalloproteinasi-3 nei batteri. Le frazioni proteiche vengono analizzate tramite gel SDS-PAGE.
Abstract
Le metalloproteinasi della matrice (MMP) appartengono alla famiglia delle proteasi della metzincina con ruoli centrali nella degradazione e nel rimodellamento della matrice extracellulare (ECM), nonché nelle interazioni con diversi fattori di crescita e citochine. La sovraespressione di MMP specifiche è responsabile di diverse malattie come il cancro, le malattie neurodegenerative e le malattie cardiovascolari. Le MMP sono state recentemente al centro dell’attenzione come bersagli per sviluppare terapie in grado di trattare malattie correlate alla sovraespressione di MMP.
Per studiare il meccanismo MMP in soluzione, sono necessari metodi di espressione e purificazione delle proteine ricombinanti più facili e robusti per la produzione di MMP attive e solubili. Tuttavia, il dominio catalitico della maggior parte delle MMP non può essere espresso in Escherichia coli (E. coli) in forma solubile a causa della mancanza di macchinari post-traduzionali, mentre i sistemi di espressione dei mammiferi sono solitamente costosi e hanno rese inferiori. Gli organismi di inclusione MMP devono subire il noioso e laborioso processo di purificazione e ripiegamento estensivo, riducendo significativamente la resa delle MMP in conformazione nativa. Questo documento presenta un protocollo che utilizza le cellule Rosetta2(DE3)pLysS (di seguito denominate R2DP) per produrre il dominio catalitico della metalloproteinasi-3 della matrice (MMP-3cd), che contiene un N-terminal His-tag seguito da pro-domain (Hisx6-pro-MMP-3cd) da utilizzare nella purificazione dell’affinità. Le cellule R2DP migliorano l’espressione delle proteine eucariotiche attraverso un plasmide resistente al cloramfenicolo contenente codoni normalmente rari nei sistemi di espressione batterica. Rispetto alla tradizionale linea cellulare scelta per l’espressione proteica ricombinante, BL21 (DE3), la purificazione con questo nuovo ceppo ha migliorato la resa di Hisx6-pro-MMP-3cd purificato. Al momento dell’attivazione e della desalinizzazione, il dominio pro viene scisso insieme all’N-terminal His-tag, fornendo MMP-3cd attivo per l’uso immediato in innumerevoli applicazioni in vitro . Questo metodo non richiede attrezzature costose o proteine di fusione complesse e descrive la rapida produzione di MMP umane ricombinanti nei batteri.
Introduction
La maggior parte delle proteine eucariotiche complesse subisce elaborate modificazioni post-traduzionali dopo l’espressione, che richiedono un ripiegamento proteico altamente assistito e co-fattori per essere funzionali1. La produzione di grandi quantità di proteine umane solubili in un ospite batterico rimane una sfida significativa a causa dei costi elevati e della mancanza di solidi metodi di espressione e purificazione, anche per esperimenti di laboratorio su scala ridotta2,3. Le MMP, endopeptidasi umane con grande peso molecolare, sono solitamente espresse come corpi di inclusione insolubili quando espresse in E. coli. L’estrazione di MMP umane solubili porta spesso a un laborioso e dispendioso processo di solubilizzazione e ripiegamento4.
Le MMP hanno ruoli critici sia nei processi fisiologici che in quelli patogenetici. Le MMP umane sono una famiglia di 23 endopeptidasi di zinco, classificate per struttura e specificità del substrato, ed espresse in modo differenziale nonostante un dominio catalitico altamente conservato5,6. Le MMP sono secrete come zimogeni inattivi, regolati tramite attivazione post-traduzionale e loro inibitori endogeni, inibitori tissutali delle metalloproteinasi (TIMP)7,8,9,10. Sebbene inizialmente riconosciute per il loro ruolo nel turnover ECM, le MMP sono state anche implicate nello sviluppo, nella morfogenesi, nella riparazione dei tessuti e nel rimodellamento8. La disregolazione delle MMP è stata in particolare collegata al cancro insieme a malattie neurodegenerative, cardiovascolari e fibrotiche, tra le altre malattie5,7.
Lo sviluppo di solidi metodi di produzione MMP su larga scala è fondamentale per garantire il successo di studi futuri sui meccanismi MMP attraverso saggi biochimici e cellulari. Varie MMP sono state precedentemente espresse in batteri11, comprese le MMP con tag Hisx6, senza alterare l’attività MMP12,13,14,15. Tuttavia, questi metodi includono passaggi noiosi e lunghi che potrebbero essere difficili da replicare.
Le cellule di mammifero possono anche essere utilizzate per esprimere molte proteine umane diverse, garantendo al contempo le corrette modifiche post-traduzionali16. Sebbene il sistema di espressione dei mammiferi sia la scelta ideale per produrre proteine umane ricombinanti con adeguate modifiche post-traduzionali, i principali svantaggi di questo metodo sono le basse rese iniziali, i costosi mezzi di crescita e reagenti, le lunghe tempistiche per raggiungere linee di espressione stabili e il rischio di contaminazione con altre specie come funghi o batteri2,11 . Inoltre, la produzione di MMP nelle linee cellulari di mammiferi produce impurità da proteine cellulari associate come TIMP o fibronectine11. A differenza della lenta crescita cellulare osservata nelle cellule di mammifero, il sistema di espressione batterica offre una produzione proteica su larga scala in un breve periodo insieme a mezzi e requisiti di crescita più semplici. Tuttavia, a causa della mancanza di altre proteine cellulari associate (ad esempio, TIMP) nei sistemi di espressione batterica, le MMP attive a concentrazioni più elevate sono soggette a degradazione attraverso l’autoproteolisi, con conseguente scarsa resa MMP17.
Questo documento descrive un metodo dettagliato per l’espressione batterica, la purificazione e l’attivazione di Hisx6-pro-MMP-3cd ricombinante utilizzando E. coli come ospite di espressione grazie alla sua convenienza, semplicità e successo nel produrre rese più elevate di MMP2,3,18. Poiché E. coli non ha il meccanismo di ripiegamento delle proteine e l’elaborazione post-traduzionale necessari per le MMP ricombinanti e altre proteine complesse, molti ceppi di E. coli sono stati progettati per superare queste limitazioni, rendendo E. coli un ospite più adatto per l’espressione di MMP-3cd umano ricombinante,19,20 . Ad esempio, il ceppo R2DP utilizzato in questo studio migliora l’espressione eucariotica fornendo un plasmide resistente al cloramfenicolo contenente codoni raramente usati in E. coli.
Come descritto in questo protocollo, dopo la sovraespressione di corpi di inclusione relativamente puri dal vettore pET-3a (Figura 1) nelle cellule R2DP, le proteine del dominio catalitico Hisx6-pro-MMP-3 (MMP-3cd) vengono estratte e denaturate4. Hisx6-pro-MMP-3cd3,19 è stato purificato utilizzando la cromatografia con tag di affinità. Dopo il ripiegamento e la dialisi, il pro-MMP-3cd (zimogeno) è stato attivato dall’acetato di 4-aminofenilmercurio (APMA) e l’analisi SDS-PAGE viene utilizzata per valutare le rese e la necessità di un’ulteriore purificazione5,21. Questo protocollo descrive l’espressione, la purificazione e l’attivazione di MMP-3cd solubile come esempio. Tuttavia, può anche essere usato come guida per l’espressione di altre MMP e proteasi umane con espressione simile e meccanismi di attivazione (Figura 2). Per altre proteine diverse da MMP-3cd, si consiglia al lettore di determinare le composizioni tampone e i metodi ottimali per la loro proteina bersaglio prima di tentare questo protocollo.
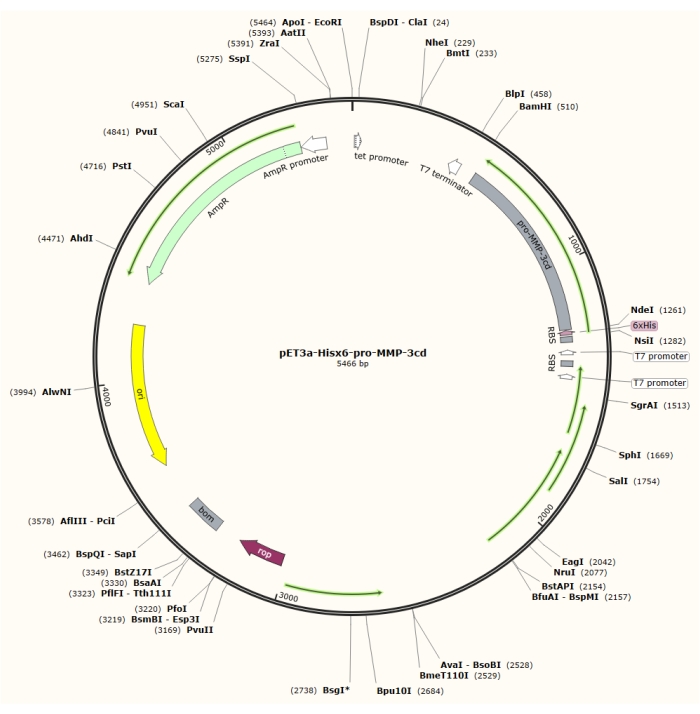
Figura 1: Mappa plasmidica del plasmide pET-3a-Hisx6-pro-MMP-3cd. Il vettore pET-3a include un gene di resistenza all’ampicillina. Una sequenza di tag Hisx6 N-terminale viene clonata nel vettore basato su pET-3a, incluso pro-MMP-3cd, per produrre il costrutto pET-3a-Hisx6-pro-MMP-3cd sotto il controllo del promotore T7 tra i siti di restrizione BamHI e NdeI. Fare clic qui per visualizzare una versione più grande di questa figura.
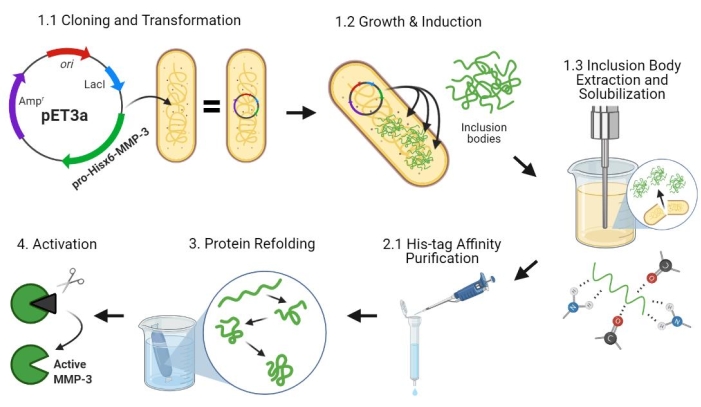
Figura 2: Espressione batterica del plasmide pro-MMP-3cd, purificazione, ripiegamento e attivazione. 1.1: il plasmide pET-3a-Hisx6-pro-MMP-3cd è stato trasformato in cellule BL21(DE3) o R2DP. 1.2: L’espressione proteica Pro-MMP-3cd è stata indotta utilizzando IPTG. 1.3: La lisi chimica e la sonicazione vengono utilizzate per estrarre le proteine Hisx6-pro-MMP-3cd che sono principalmente insolubili e si trovano nei corpi di inclusione. L’urea è stata utilizzata per denaturare e solubilizzare le proteine dai corpi di inclusione. 2.1. La proteina Hisx6-pro-MMP-3cd denaturata è stata purificata tramite purificazione cromatografica di affinità. 3. L’Hisx6-pro-MMP-3cd eluito è stato lentamente ripiegato durante la dialisi attraverso la graduale rimozione dell’urea dal tampone. 4. Infine, la proteina MMP-3cd ripiegata è stata attivata utilizzando APMA rimuovendo il dominio pro-peptide N-terminale. L’APMA viene successivamente rimosso dalla soluzione attraverso la desalinizzazione. I numeri corrispondono alle sezioni di protocollo che descrivono questi passaggi. Abbreviazioni: MMP-3cd = Matrix metalloproteinase-3 catalytic domain; APMA = acetato di 4-aminofenilmercurio. Fare clic qui per visualizzare una versione più grande di questa figura.
Protocol
Representative Results
Discussion
La produzione su larga scala di MMP solubili, umane e ricombinanti rimane un compito impegnativo. Le cellule di mammifero possono esprimere MMP funzionali a costi elevati e lunghi tempi di attesa, mentre E. coli produce rapidamente elevate quantità di corpi di inclusione MMP che devono essere purificati e ripiegati11,16. Le celle R2DP aumentano significativamente la resa degli organismi di inclusione MMP, consentendo un processo di ripiegamento MMP più…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Gli autori vorrebbero ringraziare la dott.ssa Evette Radisky e Alexandra Hockla della Mayo Clinic di Jacksonville, in Florida, per aver fornito il plasmide pET-3a-pro-MMP-3cd come modello per la clonazione del gene Hisx6pro-MMP-3cd e i loro commenti, insieme al Dr. Paul Hartley del Nevada Genomics Center presso l’Università del Nevada, Reno, per il sequenziamento del DNA. Gli autori vorrebbero anche ringraziare Cassandra Hergenrader per aver aiutato con parte dell’espressione proteica. M.R.-S. vorrei ringraziare il NIH-P20 GM103650-COBRE Integrative Neuroscience grant e l’UNR R&D mICRO SEED Grant Award.
Materials
| 0.22 µm sterile filter | Sigma Aldrich | SLGP033RS | Used to remove some contaminants from the protein extract before purification, and prevent the Ni-NTA column from clogging |
| 1 L Erlenmeyer flasks | Thermo Fisher Scientific | S76106F | n/a |
| 1 L glass bottles | Thermo Fisher Scientific | 06-414-1D | n/a |
| 1.5 mL microfuge tubes | Thermo Fisher Scientific | 02-682-002 | n/a |
| 15 mL conical tubes | Thermo Fisher Scientific | 339650 | n/a |
| 18 G, 1-in. beveled needle | Amazon | B07S7VBHM2 | Used in combination with the dialysis casette |
| 2 mL desalting column | Thermo Fisher Scientific | 89890 | Removes APMA following activation |
| 2-(N-Morpholino)ethanesulfonic acid (MES) | Thermo Fisher Scientific | AAA1610422 | n/a |
| 250 mL conical bottle cushions | Thermo Fisher Scientific | 05-538-53A | Stabilize conical bottles during large-volume centrifugation |
| 250 mL conical bottles | Thermo Fisher Scientific | 05-538-53 | n/a |
| 400 mL stirred cell | Sigma Aldrich | UFSC40001 | Re-concentrates a much larger volume than the centrifugal filter unit. Rosetta2(DE3)pLysS cells produce high volumes of protein that may exceed the 15 mL limit of the centrifugal filter unit |
| 4-aminophenylmercuric acetate (APMA) | Sigma Aldrich | A9563-5G | Activates MMP-3 by cleaving the propeptide |
| 5 mL syringe | Thermo Fisher Scientific | NC0829167 | Used in combination with the dialysis casette |
| 50 mL conical tubes | Thermo Fisher Scientific | 339650 | Used for storage in many purification steps |
| 50 mL re-concentration tube | Sigma Aldrich | UFC901024D | Used for re-concentrating protein samples after dialysis or removing contaminants |
| Agar | Thermo Fisher Scientific | BP1423-500 | Buffer ingredient that solidifies autoclaved LB media upon cooling |
| Ampicillin | Thermo Fisher Scientific | BP1760-25 | Antibiotic used with pET3a vector; used at 100 µg/mL in LB media |
| BamHI | NEB | R3136S | Restriction enzyme to be used with the pET3a vector |
| Calcium chloride (CaCl2) | Thermo Fisher Scientific | 600-30-23 | The calcium ion stabilizes MMP structure |
| Cell spreaders | Thermo Fisher Scientific | 50-189-7544 | Can be used to spread cells across a petri dish after transformation |
| Chloramphenicol | Thermo Fisher Scientific | 22-055-125GM | Antibiotic used with pET3a vector; used at 34 µg/mL in LB media |
| Dialysis Buffer 1 | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 150 mM NaCl, 10 mM CaCl2, 1 µM ZnCl2, 4 M Urea. |
| Dialysis Buffer 2 | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 150 mM NaCl, 10 mM CaCl2, 1 µM ZnCl2, 2 M Urea. |
| Dialysis Buffer 3 | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 150 mM NaCl, 10 mM CaCl2 , 1 µM ZnCl2. |
| Dialysis clips | Thermo Fisher Scientific | 68011 | Used in combination with snakeskin dialysis tubing |
| Dialysis tubing | Thermo Fisher Scientific | 88243 | Alternative dialysis method that holds much larger sample volumes, but with higher risk of sample loss |
| Digest buffer | NEB | B7204S | Buffer used in digesting the pET3a vector |
| Disposable cuvettes | Thermo Fisher Scientific | 21-200-257 | Used to measure the bacterial culture OD during growth and expression |
| Dithiothreitol (DTT) | Thermo Fisher Scientific | D107125G | Assists with protein denaturation by reducing any disulfide bonds |
| DNA assembly mix | NEB | E2621S | Used to ligate the Hisx6-pro-MMP-3cd PCR product and digested pET3a vector |
| DNase I | NEB | M0303S | Endonuclease for degrading unfavorable DNA contaminants that could later affect protein purification |
| Ethanol | Thermo Fisher Scientific | A995-4 | n/a |
| Ethylenediaminetetraacetic acid (EDTA) | Thermo Fisher Scientific | J15694-AE | Used in denaturation. Prevents oxidation and subsequent formation of disulfide bonds |
| Gel recovery kit | Promega | A9281 | Isolates and purifies DNA from agarose gels |
| Glycerol | Thermo Fisher Scientific | G33-500 | Used for making glycerol stocks, which are frozen at -80 °C |
| Gravity flow column | BioRad | 7321010 | Used for Ni-NTA purification of recombinantly His-tagged proteins |
| Guanidine hydrochloride (GdnHCl) | Thermo Fisher Scientific | AAA135430B | Second chaotropic agent used for disrupting protein secondary structure. |
| High-transformation efficiency cells | NEB | C2987 | High-transformation efficiency cells with greater chance of success for cloning the N-terminal His-tag into the pET3a-pro-MMP-3cd construct |
| HT Elution Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 6 M urea, 250 mM imidazole. Adjust pH to 7.4 |
| HT Equilibration Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 6 M urea. Adjust pH to 7.4 |
| HT Regeneration Buffer | n/a | n/a | 20 mM MES, 0.1 M NaCl. Adjust pH to 5.0 |
| HT Wash Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 6 M urea, 25 mM imidazole. Adjust pH to 7.4 |
| Hydrochloric acid (HCl) | Thermo Fisher Scientific | A144C-212 | Used to pH buffers |
| Imidazole | Thermo Fisher Scientific | AAA1022122 | Mimics the histidine side group. Used to separate non-specifically binding proteins from the his-tagged target protein |
| Inclusion Body Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 1 mM EDTA, 100 mM NaCl, 5 mM DTT, 2% v/v Triton X 100, 0.5 M Urea. Adjust pH to 8.0 |
| Isopropyl-ß-D-thiogalactopyranoside (IPTG) | Thermo Fisher Scientific | FERR0392 | A reagent that induces target gene expression in pET3a. Make 0.5 mL 1 M aliquots, filter sterilize and store in -20 °C |
| LB Amp CamR media | n/a | n/a | To be poured into a sterible 1 L bottle or 1 L flask. For 1 L, add 25 g LB Broth. Sterilize by autoclaving. Once cooled to below 50 °C, add ampicillin to 100 µg/mL and chloramphenicol to 34 µg/mL |
| LB Amp CamR plates | n/a | n/a | To be poured into sterile petri dishes. Pour until the petri dish lid is completely covered. 1 L of media yields 40-60 plates. For 1 L: 25 g LB Broth, 16 g Agar. Sterilize by autoclaving. Once cooled to below 50 °C, add ampicillin to 100 µg/mL and chloramphenicol to 34 µg/mL |
| LB Broth | Thermo Fisher Scientific | BP1426-2 | Pre-mixed with tryptone, yeast extract, and sodium chloride |
| Lysis Buffer | n/a | n/a | 50 mM Tris-HCl (pH 8.0), 1 mM EDTA, 100 mM NaCl, 0.133 g/mL lysozyme, 0.49% v/v Triton X-100. Adjust pH to 8.0 |
| Lysozyme | MP Biomedicals | 195303 | Used in protein extraction. Enzyme that lyses bacterial cell walls |
| Miniprep kit | Promega | A1330 | If successful, extracts the pET3a-pro-MMP-3cd construct from transformants |
| NdeI | NEB | R0111S | Restriction enzyme to be used with the pET3a vector |
| Ni-NTA resin | Thermo Fisher Scientific | PI88221 | Used to bind recombinant his-tagged proteins. This strong interaction can be displaced with higher concentrations of imidazole |
| PCR mix | NEB | M0492S | A PCR reagent for inserting an N-terminal his-tag into the pET3a-pro-MMP-3cd vector |
| pET plasmid | Addgene | n/a | The pET3a vector offers ampicillin resistance, inducible expression of a target gene, and sequencing with T7 primers |
| Petri dishes | VWR | 25384-342 | Used for plating transformants on LB agar media |
| R2DP cells | Novagen | 714033 | BL21 derivatives with enhanced expression of eukaryotic proteins. Contain tRNAs of codons found to be rare in e. coli |
| SOC growth media | NEB | B9020S | Non-selective growth media for rapid growth during transformation |
| Sodium chloride (NaCl) | Thermo Fisher Scientific | BP358-1 | Used in buffers and helps with protein stability |
| Sodium deoxycholate | Thermo Fisher Scientific | PI89905 | Detergent used in protein extraction. Lyses cell walls |
| Solubilization Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 10 mM DTT, 6 M Urea. Adjust pH to 8.0 |
| Tris base | Thermo Fisher Scientific | BP152-1 | Common buffer used in the physiological pH range. Temperature-sensitive |
| Triton X-100 | Thermo Fisher Scientific | M1122980101 | Detergent used for cell lysis |
| Urea | Thermo Fisher Scientific | AAJ75826A7 | First chaotropic agent for disrupting protein secondary structure |
| Zinc chloride (ZnCl2) | Thermo Fisher Scientific | AAA162810E | Stabilizes MMP structure. The zinc ion is found in the catalytic site of MMP-3 |
References
- Portolano, N., et al. Recombinant protein expression for structural biology in HEK 293F suspension cells: A novel and accessible approach. Journal of Visualized Experiments: JoVE. (92), e51897 (2014).
- Subedi, G. P., Johnson, R. W., Moniz, H. A., Moremen, K. W., Barb, A. High yield expression of recombinant human proteins with the transient transfection of HEK293 cells in suspension. Journal of Visualized Experiments: JoVE. (106), e53568 (2015).
- Nilvebrant, J., Alm, T., Hober, S. Orthogonal protein purification facilitated by a small bispecific affinity tag. Journal of Visualized Experiments: JoVE. (59), e3370 (2012).
- Yang, Z., et al. Highly efficient production of soluble proteins from insoluble inclusion bodies by a two-step-denaturing and refolding method. PLoS One. 6 (7), 22981 (2011).
- Hu, X., Beeton, C. Detection of functional matrix metalloproteinases by zymography. Journal of Visualized Experiments: JoVE. (45), e2445 (2010).
- Radisky, E. S., Raeeszadeh-Sarmazdeh, M., Radisky, D. C. Therapeutic potential of matrix metalloproteinase inhibition in breast cancer. Journal of Cellular Biochemistry. 118 (11), 3531-3548 (2017).
- Raeeszadeh-Sarmazdeh, M., Do, L. D., Hritz, B. G. Metalloproteinases and their inhibitors: Potential for the development of new therapeutics. Cells. 9 (5), 1313 (2020).
- Nagase, H., Visse, R., Murphy, G. Structure and function of matrix metalloproteinases and TIMPs. Cardiovascular Research. 69 (3), 562-573 (2006).
- Raeeszadeh-Sarmazdeh, M., et al. Directed evolution of the metalloproteinase inhibitor TIMP-1 reveals that its N- and C-terminal domains cooperate in matrix metalloproteinase recognition. Journal of Biological Chemistry. 294 (24), 9476-9488 (2019).
- Batra, J., et al. Matrix metalloproteinase-10 (MMP-10) interaction with tissue inhibitors of metalloproteinases TIMP-1 and TIMP-2. Journal of Biological Chemistry. 287 (19), 15935-15946 (2012).
- Singh, K. K., Jain, R., Ramanan, H., Saini, D. K., Galea, C. A. Expression and purification of matrix metalloproteinases in Escherichia coli. Matrix Metalloproteases. , 3-16 (2017).
- Manka, S. W., et al. Structural insights into triple-helical collagen cleavage by matrix metalloproteinase 1. Proceedings of the National Academy of Sciences of the United States of America. 109 (31), 12461-12466 (2012).
- Gomis-Ruth, F. X., et al. Mechanism of inhibition of the human matrix metalloproteinase stromelysin-1 by TIMP-1. Nature. 389 (6646), 77-81 (1997).
- Shirian, J., et al. Converting a broad matrix metalloproteinase family inhibitor into a specific inhibitor of MMP-9 and MMP-14. FEBS Letters. 592 (7), 1122-1134 (2018).
- Li, C., et al. Purification of recombinant histidine-tagged catalytic domain of MMP-13 in one step using affinity column and renaturation of it with histidine tag. Journal of Liquid Chromatography & Related Technologies. 37 (15), 2118-2130 (2014).
- Aydin, H., Azimi, F. C., Cook, J. D., Lee, J. E. A convenient and general expression platform for the production of secreted proteins from human cells. Journal of Visualized Experiments: JoVE. (65), e4041 (2012).
- McNiff, M. L., Haynes, E. P., Dixit, N., Gao, F. P., Laurence, J. S. Thioredoxin fusion construct enables high-yield production of soluble, active matrix metalloproteinase-8 (MMP-8) in Escherichia coli. Protein Expression and Purification. 122, 64-71 (2016).
- Maity, R., et al. GST-His purification: A two-step affinity purification protocol yielding full-length purified proteins. Journal of Visualized Experiments: JoVE. (80), e50320 (2013).
- Stefan, A., Ceccarelli, A., Conte, E., Montón Silva, A., Hochkoeppler, A. The multifaceted benefits of protein co-expression in Escherichia coli. Journal of Visualized Experiments: JoVE. (96), e52431 (2015).
- Yadavalli, R., Sam-Yellowe, T. HeLa based cell free expression systems for expression of Plasmodium rhoptry proteins. Journal of Visualized Experiments: JoVE. (100), e52772 (2015).
- Zeytuni, N., Zarivach, R. Purification of the M. magneticum strain AMB-1 magnetosome associated protein MamAΔ41. Journal of Visualized Experiments: JoVE. (37), e1844 (2010).

