박테리아 발현 및 친화성 크로마토그래피를 이용한 인간 매트릭스 메탈로프로테이나제-3의 정제
Summary
그의 태그 정제, 투석 및 활성화는 박테리아에서 가용성, 활성 매트릭스 메탈로프로테이나제-3 촉매 도메인 단백질 발현의 수율을 증가시키기 위해 사용된다. 단백질 분획은 SDS-PAGE 겔을 통해 분석된다.
Abstract
매트릭스 메탈로프로테이나제(MMPs)는 세포외 매트릭스(ECM) 분해 및 리모델링에서 중심적인 역할을 하는 메친신 프로테아제 패밀리에 속하며, 여러 성장 인자 및 사이토카인과의 상호작용에 속한다. 특정 MMPs의 과발현은 암, 신경 퇴행성 질환 및 심혈관 질환과 같은 여러 질병에 책임이 있다. MMPs는 MMP 과발현과 상관관계가 있는 질환을 치료할 수 있는 치료제를 개발하기 위한 표적으로서 최근 주목의 중심이 되고 있다.
용액 중의 MMP 메카니즘을 연구하기 위해, 활성, 가용성 MMPs의 생산을 위해 보다 용이하고 강력한 재조합 단백질 발현 및 정제 방법이 필요하다. 그러나, 대부분의 MMPs의 촉매 도메인은 번역 후 기계의 부족으로 인해 가용성 형태로 에스케리치아 콜라 이 (E. coli)에서 발현될 수 없는 반면, 포유동물 발현 시스템은 일반적으로 비용이 많이 들고 수율이 낮다. MMP 봉입체는 광범위한 정제 및 재폴딩의 지루하고 힘든 과정을 거쳐야하며, 천연 입체 형태에서 MMP의 수율을 현저하게 감소시켜야합니다. 이 논문은 로제타2(DE3)pLysS(이하 R2DP로 지칭됨) 세포를 사용하여 매트릭스 메탈로프로테이나제-3 촉매 도메인(MMP-3cd)을 생산하는 프로토콜을 제시하며, 이는 친화성 정제에 사용하기 위한 N 말단 His-태그에 이어 프로도메인(Hisx6-pro-MMP-3cd)을 함유한다. R2DP 세포는 박테리아 발현 시스템에서 일반적으로 희귀한 코돈을 함유하는 클로람페니콜 내성 플라스미드를 통해 진핵 단백질의 발현을 향상시킨다. 재조합 단백질 발현을 위해 선택된 전통적인 세포주 BL21(DE3)과 비교하여, 이 새로운 균주를 이용한 정제는 정제된 Hisx6-pro-MMP-3cd의 수율을 향상시켰다. 활성화 및 탈염시, 프로 도메인은 N 말단 His-태그와 함께 절단되어, 무수한 시험관내 적용에서 즉시 사용하기 위한 활성 MMP-3cd를 제공한다. 이 방법은 고가의 장비나 복잡한 융합 단백질을 필요로 하지 않으며, 박테리아에서 재조합 인간 MMPs의 신속한 생산을 기술한다.
Introduction
대부분의 복잡한 진핵 단백질은 발현 후 정교한 번역 후 변형을 거치며, 고도로 보조된 단백질 폴딩 및 보조 인자가 기능적이어야 합니다1. 박테리아 숙주에서 다량의 가용성 인간 단백질을 생산하는 것은 소규모 실험실 실험에서도 높은 비용과 강력한 발현 및 정제 방법의 부족으로 인해 중요한 과제로 남아 있습니다2,3. MMPs, 큰 분자량을 가진 인간 endopeptidases는 일반적으로 대장균 에서 발현될 때 불용성 봉입체로서 발현된다. 가용성 인간 MMP의 추출은 종종 힘들고 시간이 많이 걸리는 가용화 및 재접힘 공정4으로 이어진다.
MMP는 생리적 및 병원성 과정 모두에서 중요한 역할을 한다. 인간 MMPs는 구조 및 기질 특이성에 의해 분류되고, 고도로 보존된 촉매 도메인5,6에도 불구하고 차등적으로 발현되는 23개의 아연 엔도펩티다제의 패밀리이다. MMPs는 비활성 효소원으로서 분비되고, 번역 후 활성화 및 이들의 내인성 억제제, 메탈로프로테이나제 (TIMPs)의 조직 억제제 7,8,9,10을 통해 조절된다. 처음에는 ECM 회전율에서 그들의 역할에 대해 인정되었지만, MMP는 또한 발달, 형태 형성, 조직 복구 및 리모델링에 연루되어 있습니다8. MMPs의 조절 장애는 다른 질병 중에서도 신경 퇴행성, 심장 혈관 및 섬유성 질환과 함께 암과 특히 관련이 있습니다5,7.
강력한 대규모 MMP 생산 방법의 개발은 생화학 및 세포 기반 분석을 통해 MMP 메커니즘에 대한 향후 연구의 성공을 보장하는 데 중요합니다. 다양한 MMP가 MMP 활성을 변경하지 않고 Hisx6-태그된 MMP를 포함하는 박테리아11에서 이전에 발현되었다12,13,14,15. 그러나 이러한 방법에는 복제하기 어려울 수 있는 지루하고 긴 단계가 포함됩니다.
포유동물 세포는 또한 적절한 번역 후 변형을 보장하면서 많은 상이한 인간 단백질을 발현하는데 사용될 수 있다16. 포유동물 발현 시스템이 적절한 번역 후 변형을 갖는 재조합 인간 단백질을 생산하기 위한 이상적인 선택이지만, 이 방법의 주요 단점은 초기 낮은 수율, 값비싼 성장 배지 및 시약, 안정적인 발현 라인에 도달하기 위한 긴 타임라인, 진균 또는 박테리아와 같은 다른 종과의 오염 위험이다2,11 . 더욱이, 포유동물 세포주에서의 MMP 생산은 TIMPs 또는 피브로넥틴11과 같은 관련 세포 단백질로부터의 불순물을 산출한다. 포유류 세포에서 관찰되는 느린 세포 성장과는 달리, 박테리아 발현 시스템은 더 간단한 배지 및 성장 요건과 함께 단기간에 대규모 단백질 생산을 제공합니다. 그러나, 박테리아 발현 시스템에서 다른 관련 세포 단백질(즉, TIMPs)의 부족으로 인해, 더 높은 농도에서의 활성 MMP는 자가단백질 분해를 통해 분해될 수 있고, 결과적으로 불량한 MMP 수율17을 초래한다.
이 논문은 MMPs2,3,18의 더 높은 수율을 생산하는데 있어서 경제성, 단순성 및 성공으로 인해 대장균을 발현 숙주로 사용하는 재조합 Hisx6-pro-MMP-3cd의 박테리아 발현, 정제 및 활성화를 위한 상세한 방법을 기술한다. 대장균은 재조합 MMP 및 기타 복잡한 단백질에 필요한 단백질 폴딩 기계 및 번역 후 처리가 부족하기 때문에 많은 대장균 균주가 이러한 한계를 극복하도록 설계되어 대장균을 재조합 인간 MMP-3cd,19,20의 발현에 더 적합한 숙주로 만들었습니다. . 예를 들어, 본 연구에 사용된 R2DP 균주는 대장균에서 거의 사용되지 않는 코돈을 함유하는 클로람페니콜 내성 플라스미드를 공급함으로써 진핵 발현을 향상시킨다.
이 프로토콜에 기재된 바와 같이, R2DP 세포에서 pET-3a 벡터 (도 1)로부터 비교적 순수한 봉입체를 과발현시킨 후, Hisx6-pro-MMP-3 촉매 도메인 (MMP-3cd) 단백질이 추출되고 변성된다4. Hisx6-pro-MMP-3cd3,19는 친화성 태그 크로마토그래피를 사용하여 정제하였다. 재접힘 및 투석시에, 프로-MMP-3cd (자이모겐)를 4-아미노페닐머큐릭 아세테이트 (APMA)에 의해 활성화시키고, SDS-PAGE 분석은 수율 및 추가 정제의 필요성을 평가하기 위해 사용된다5,21. 이러한 프로토콜은 가용성 MMP-3cd의 발현, 정제 및 활성화를 예로 들어 설명한다. 그러나, 유사한 발현 및 활성화 메카니즘을 갖는 다른 MMPs 및 인간 프로테아제의 발현을 위한 가이드로서 또한 사용될 수 있다(도 2). MMP-3cd 이외의 다른 단백질의 경우, 독자는 이 프로토콜을 시도하기 전에 그들의 표적 단백질에 대한 최적의 완충액 조성물 및 방법을 결정하는 것이 권고된다.
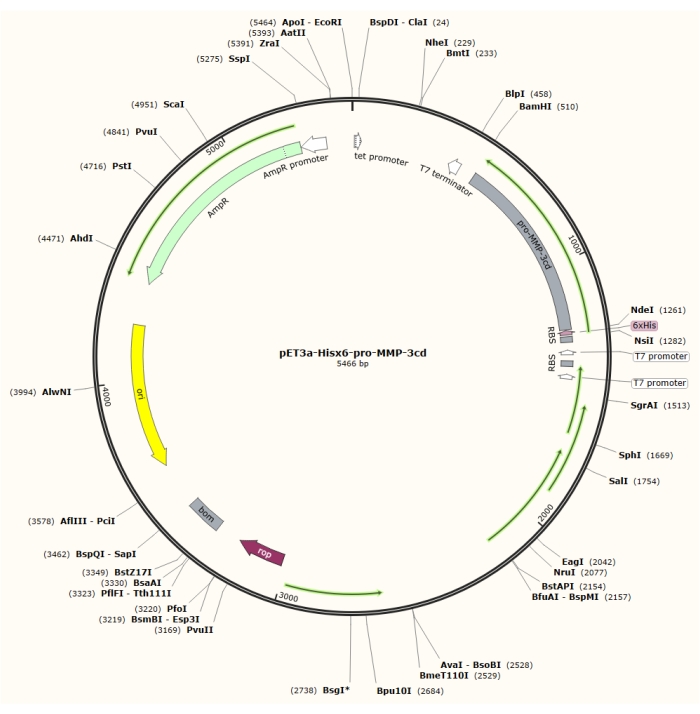
도 1: pET-3a-Hisx6-pro-MMP-3cd 플라스미드의 플라스미드 맵. pET-3a 벡터는 암피실린 내성 유전자를 포함한다. N 말단 Hisx6-태그 서열은 프로-MMP-3cd를 포함하는 pET-3a 기반 벡터 내로 클로닝되어, BamHI 및 NdeI 제한 부위 사이의 T7 프로모터의 제어 하에 pET-3a-Hisx6-pro-MMP-3cd 구축물을 수득한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
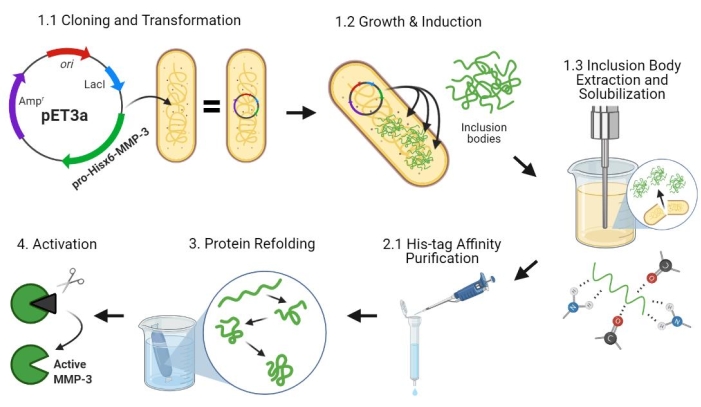
도 2: 프로-MMP-3cd의 박테리아 발현, 정제, 리폴딩 및 활성화. 1.1: pET-3a-Hisx6-pro-MMP-3cd 플라스미드를 BL21(DE3) 또는 R2DP 세포로 형질전환시켰다. 1.2: 프로-MMP-3cd 단백질 발현은 IPTG를 사용하여 유도하였다. 1.3 : 화학적 용해 및 초음파 처리는 주로 불용성이며 봉입체에서 발견되는 Hisx6-pro-MMP-3cd 단백질을 추출하는 데 사용됩니다. 우레아는 봉입체로부터 단백질을 변성시키고 가용화하는데 사용되었다. 2.1. 변성된 Hisx6-pro-MMP-3cd 단백질을 친화성 크로마토그래피 정제를 통해 정제하였다. 3. 용출된 Hisx6-pro-MMP-3cd를 완충제로부터 요소들의 점진적인 제거를 통해 투석 동안 천천히 재접었다. 4. 마지막으로, 재접힌 MMP-3cd 단백질은 N 말단 프로펩타이드 도메인을 제거함으로써 APMA를 사용하여 활성화시켰다. APMA는 나중에 탈염을 통해 용액에서 제거됩니다. 숫자는 이러한 단계를 설명하는 프로토콜 섹션에 해당합니다. 약어: MMP-3cd = 매트릭스 메탈로프로테이나제-3 촉매 도메인; APMA = 4-아미노페닐머큐릭 아세테이트. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Protocol
Representative Results
Discussion
가용성, 인간, 재조합 MMP의 대규모 생산은 여전히 어려운 과제입니다. 포유동물 세포는 높은 비용과 긴 대기 시간으로 기능적 MMP를 발현할 수 있는 반면, 대장균은 정제되고 재접혀져야 하는 다량의 MMP 봉입체를 빠르게 생산한다11,16. R2DP 세포는 MMP 봉입체의 수율을 상당히 증가시켜, 보다 비용 효율적이고 생산적인 MMP 리폴딩 공정을 가능하게 한?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
저자들은 플로리다 주 잭슨빌의 메이요 클리닉에서 에베트 라디스키 박사와 알렉산드라 호클라 박사가 Hisx6pro-MMP-3cd 유전자를 복제하기 위한 주형으로 pET-3a-pro-MMP-3cd 플라스미드를 제공한 것에 대해 인정하고 싶고, 그들의 의견은 리노의 네바다 대학의 네바다 유전체학 센터의 폴 하틀리 박사와 함께 DNA 시퀀싱을 위해 제시하고 싶다. 저자는 또한 단백질 발현의 일부를 도와 준 카산드라 헤르겐라더에게 감사하고 싶습니다. M.R.-S. NIH-P20 GM103650-COBRE 통합 신경 과학 보조금과 UNR R & D mICRO SEED Grant Award에 감사드립니다.
Materials
| 0.22 µm sterile filter | Sigma Aldrich | SLGP033RS | Used to remove some contaminants from the protein extract before purification, and prevent the Ni-NTA column from clogging |
| 1 L Erlenmeyer flasks | Thermo Fisher Scientific | S76106F | n/a |
| 1 L glass bottles | Thermo Fisher Scientific | 06-414-1D | n/a |
| 1.5 mL microfuge tubes | Thermo Fisher Scientific | 02-682-002 | n/a |
| 15 mL conical tubes | Thermo Fisher Scientific | 339650 | n/a |
| 18 G, 1-in. beveled needle | Amazon | B07S7VBHM2 | Used in combination with the dialysis casette |
| 2 mL desalting column | Thermo Fisher Scientific | 89890 | Removes APMA following activation |
| 2-(N-Morpholino)ethanesulfonic acid (MES) | Thermo Fisher Scientific | AAA1610422 | n/a |
| 250 mL conical bottle cushions | Thermo Fisher Scientific | 05-538-53A | Stabilize conical bottles during large-volume centrifugation |
| 250 mL conical bottles | Thermo Fisher Scientific | 05-538-53 | n/a |
| 400 mL stirred cell | Sigma Aldrich | UFSC40001 | Re-concentrates a much larger volume than the centrifugal filter unit. Rosetta2(DE3)pLysS cells produce high volumes of protein that may exceed the 15 mL limit of the centrifugal filter unit |
| 4-aminophenylmercuric acetate (APMA) | Sigma Aldrich | A9563-5G | Activates MMP-3 by cleaving the propeptide |
| 5 mL syringe | Thermo Fisher Scientific | NC0829167 | Used in combination with the dialysis casette |
| 50 mL conical tubes | Thermo Fisher Scientific | 339650 | Used for storage in many purification steps |
| 50 mL re-concentration tube | Sigma Aldrich | UFC901024D | Used for re-concentrating protein samples after dialysis or removing contaminants |
| Agar | Thermo Fisher Scientific | BP1423-500 | Buffer ingredient that solidifies autoclaved LB media upon cooling |
| Ampicillin | Thermo Fisher Scientific | BP1760-25 | Antibiotic used with pET3a vector; used at 100 µg/mL in LB media |
| BamHI | NEB | R3136S | Restriction enzyme to be used with the pET3a vector |
| Calcium chloride (CaCl2) | Thermo Fisher Scientific | 600-30-23 | The calcium ion stabilizes MMP structure |
| Cell spreaders | Thermo Fisher Scientific | 50-189-7544 | Can be used to spread cells across a petri dish after transformation |
| Chloramphenicol | Thermo Fisher Scientific | 22-055-125GM | Antibiotic used with pET3a vector; used at 34 µg/mL in LB media |
| Dialysis Buffer 1 | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 150 mM NaCl, 10 mM CaCl2, 1 µM ZnCl2, 4 M Urea. |
| Dialysis Buffer 2 | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 150 mM NaCl, 10 mM CaCl2, 1 µM ZnCl2, 2 M Urea. |
| Dialysis Buffer 3 | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 150 mM NaCl, 10 mM CaCl2 , 1 µM ZnCl2. |
| Dialysis clips | Thermo Fisher Scientific | 68011 | Used in combination with snakeskin dialysis tubing |
| Dialysis tubing | Thermo Fisher Scientific | 88243 | Alternative dialysis method that holds much larger sample volumes, but with higher risk of sample loss |
| Digest buffer | NEB | B7204S | Buffer used in digesting the pET3a vector |
| Disposable cuvettes | Thermo Fisher Scientific | 21-200-257 | Used to measure the bacterial culture OD during growth and expression |
| Dithiothreitol (DTT) | Thermo Fisher Scientific | D107125G | Assists with protein denaturation by reducing any disulfide bonds |
| DNA assembly mix | NEB | E2621S | Used to ligate the Hisx6-pro-MMP-3cd PCR product and digested pET3a vector |
| DNase I | NEB | M0303S | Endonuclease for degrading unfavorable DNA contaminants that could later affect protein purification |
| Ethanol | Thermo Fisher Scientific | A995-4 | n/a |
| Ethylenediaminetetraacetic acid (EDTA) | Thermo Fisher Scientific | J15694-AE | Used in denaturation. Prevents oxidation and subsequent formation of disulfide bonds |
| Gel recovery kit | Promega | A9281 | Isolates and purifies DNA from agarose gels |
| Glycerol | Thermo Fisher Scientific | G33-500 | Used for making glycerol stocks, which are frozen at -80 °C |
| Gravity flow column | BioRad | 7321010 | Used for Ni-NTA purification of recombinantly His-tagged proteins |
| Guanidine hydrochloride (GdnHCl) | Thermo Fisher Scientific | AAA135430B | Second chaotropic agent used for disrupting protein secondary structure. |
| High-transformation efficiency cells | NEB | C2987 | High-transformation efficiency cells with greater chance of success for cloning the N-terminal His-tag into the pET3a-pro-MMP-3cd construct |
| HT Elution Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 6 M urea, 250 mM imidazole. Adjust pH to 7.4 |
| HT Equilibration Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 6 M urea. Adjust pH to 7.4 |
| HT Regeneration Buffer | n/a | n/a | 20 mM MES, 0.1 M NaCl. Adjust pH to 5.0 |
| HT Wash Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 6 M urea, 25 mM imidazole. Adjust pH to 7.4 |
| Hydrochloric acid (HCl) | Thermo Fisher Scientific | A144C-212 | Used to pH buffers |
| Imidazole | Thermo Fisher Scientific | AAA1022122 | Mimics the histidine side group. Used to separate non-specifically binding proteins from the his-tagged target protein |
| Inclusion Body Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 1 mM EDTA, 100 mM NaCl, 5 mM DTT, 2% v/v Triton X 100, 0.5 M Urea. Adjust pH to 8.0 |
| Isopropyl-ß-D-thiogalactopyranoside (IPTG) | Thermo Fisher Scientific | FERR0392 | A reagent that induces target gene expression in pET3a. Make 0.5 mL 1 M aliquots, filter sterilize and store in -20 °C |
| LB Amp CamR media | n/a | n/a | To be poured into a sterible 1 L bottle or 1 L flask. For 1 L, add 25 g LB Broth. Sterilize by autoclaving. Once cooled to below 50 °C, add ampicillin to 100 µg/mL and chloramphenicol to 34 µg/mL |
| LB Amp CamR plates | n/a | n/a | To be poured into sterile petri dishes. Pour until the petri dish lid is completely covered. 1 L of media yields 40-60 plates. For 1 L: 25 g LB Broth, 16 g Agar. Sterilize by autoclaving. Once cooled to below 50 °C, add ampicillin to 100 µg/mL and chloramphenicol to 34 µg/mL |
| LB Broth | Thermo Fisher Scientific | BP1426-2 | Pre-mixed with tryptone, yeast extract, and sodium chloride |
| Lysis Buffer | n/a | n/a | 50 mM Tris-HCl (pH 8.0), 1 mM EDTA, 100 mM NaCl, 0.133 g/mL lysozyme, 0.49% v/v Triton X-100. Adjust pH to 8.0 |
| Lysozyme | MP Biomedicals | 195303 | Used in protein extraction. Enzyme that lyses bacterial cell walls |
| Miniprep kit | Promega | A1330 | If successful, extracts the pET3a-pro-MMP-3cd construct from transformants |
| NdeI | NEB | R0111S | Restriction enzyme to be used with the pET3a vector |
| Ni-NTA resin | Thermo Fisher Scientific | PI88221 | Used to bind recombinant his-tagged proteins. This strong interaction can be displaced with higher concentrations of imidazole |
| PCR mix | NEB | M0492S | A PCR reagent for inserting an N-terminal his-tag into the pET3a-pro-MMP-3cd vector |
| pET plasmid | Addgene | n/a | The pET3a vector offers ampicillin resistance, inducible expression of a target gene, and sequencing with T7 primers |
| Petri dishes | VWR | 25384-342 | Used for plating transformants on LB agar media |
| R2DP cells | Novagen | 714033 | BL21 derivatives with enhanced expression of eukaryotic proteins. Contain tRNAs of codons found to be rare in e. coli |
| SOC growth media | NEB | B9020S | Non-selective growth media for rapid growth during transformation |
| Sodium chloride (NaCl) | Thermo Fisher Scientific | BP358-1 | Used in buffers and helps with protein stability |
| Sodium deoxycholate | Thermo Fisher Scientific | PI89905 | Detergent used in protein extraction. Lyses cell walls |
| Solubilization Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 10 mM DTT, 6 M Urea. Adjust pH to 8.0 |
| Tris base | Thermo Fisher Scientific | BP152-1 | Common buffer used in the physiological pH range. Temperature-sensitive |
| Triton X-100 | Thermo Fisher Scientific | M1122980101 | Detergent used for cell lysis |
| Urea | Thermo Fisher Scientific | AAJ75826A7 | First chaotropic agent for disrupting protein secondary structure |
| Zinc chloride (ZnCl2) | Thermo Fisher Scientific | AAA162810E | Stabilizes MMP structure. The zinc ion is found in the catalytic site of MMP-3 |
References
- Portolano, N., et al. Recombinant protein expression for structural biology in HEK 293F suspension cells: A novel and accessible approach. Journal of Visualized Experiments: JoVE. (92), e51897 (2014).
- Subedi, G. P., Johnson, R. W., Moniz, H. A., Moremen, K. W., Barb, A. High yield expression of recombinant human proteins with the transient transfection of HEK293 cells in suspension. Journal of Visualized Experiments: JoVE. (106), e53568 (2015).
- Nilvebrant, J., Alm, T., Hober, S. Orthogonal protein purification facilitated by a small bispecific affinity tag. Journal of Visualized Experiments: JoVE. (59), e3370 (2012).
- Yang, Z., et al. Highly efficient production of soluble proteins from insoluble inclusion bodies by a two-step-denaturing and refolding method. PLoS One. 6 (7), 22981 (2011).
- Hu, X., Beeton, C. Detection of functional matrix metalloproteinases by zymography. Journal of Visualized Experiments: JoVE. (45), e2445 (2010).
- Radisky, E. S., Raeeszadeh-Sarmazdeh, M., Radisky, D. C. Therapeutic potential of matrix metalloproteinase inhibition in breast cancer. Journal of Cellular Biochemistry. 118 (11), 3531-3548 (2017).
- Raeeszadeh-Sarmazdeh, M., Do, L. D., Hritz, B. G. Metalloproteinases and their inhibitors: Potential for the development of new therapeutics. Cells. 9 (5), 1313 (2020).
- Nagase, H., Visse, R., Murphy, G. Structure and function of matrix metalloproteinases and TIMPs. Cardiovascular Research. 69 (3), 562-573 (2006).
- Raeeszadeh-Sarmazdeh, M., et al. Directed evolution of the metalloproteinase inhibitor TIMP-1 reveals that its N- and C-terminal domains cooperate in matrix metalloproteinase recognition. Journal of Biological Chemistry. 294 (24), 9476-9488 (2019).
- Batra, J., et al. Matrix metalloproteinase-10 (MMP-10) interaction with tissue inhibitors of metalloproteinases TIMP-1 and TIMP-2. Journal of Biological Chemistry. 287 (19), 15935-15946 (2012).
- Singh, K. K., Jain, R., Ramanan, H., Saini, D. K., Galea, C. A. Expression and purification of matrix metalloproteinases in Escherichia coli. Matrix Metalloproteases. , 3-16 (2017).
- Manka, S. W., et al. Structural insights into triple-helical collagen cleavage by matrix metalloproteinase 1. Proceedings of the National Academy of Sciences of the United States of America. 109 (31), 12461-12466 (2012).
- Gomis-Ruth, F. X., et al. Mechanism of inhibition of the human matrix metalloproteinase stromelysin-1 by TIMP-1. Nature. 389 (6646), 77-81 (1997).
- Shirian, J., et al. Converting a broad matrix metalloproteinase family inhibitor into a specific inhibitor of MMP-9 and MMP-14. FEBS Letters. 592 (7), 1122-1134 (2018).
- Li, C., et al. Purification of recombinant histidine-tagged catalytic domain of MMP-13 in one step using affinity column and renaturation of it with histidine tag. Journal of Liquid Chromatography & Related Technologies. 37 (15), 2118-2130 (2014).
- Aydin, H., Azimi, F. C., Cook, J. D., Lee, J. E. A convenient and general expression platform for the production of secreted proteins from human cells. Journal of Visualized Experiments: JoVE. (65), e4041 (2012).
- McNiff, M. L., Haynes, E. P., Dixit, N., Gao, F. P., Laurence, J. S. Thioredoxin fusion construct enables high-yield production of soluble, active matrix metalloproteinase-8 (MMP-8) in Escherichia coli. Protein Expression and Purification. 122, 64-71 (2016).
- Maity, R., et al. GST-His purification: A two-step affinity purification protocol yielding full-length purified proteins. Journal of Visualized Experiments: JoVE. (80), e50320 (2013).
- Stefan, A., Ceccarelli, A., Conte, E., Montón Silva, A., Hochkoeppler, A. The multifaceted benefits of protein co-expression in Escherichia coli. Journal of Visualized Experiments: JoVE. (96), e52431 (2015).
- Yadavalli, R., Sam-Yellowe, T. HeLa based cell free expression systems for expression of Plasmodium rhoptry proteins. Journal of Visualized Experiments: JoVE. (100), e52772 (2015).
- Zeytuni, N., Zarivach, R. Purification of the M. magneticum strain AMB-1 magnetosome associated protein MamAΔ41. Journal of Visualized Experiments: JoVE. (37), e1844 (2010).

