Высокопроизводительная кристаллизация белка с помощью микродиализа
Summary
Представленный протокол описывает простой подход к скринингу условий кристаллизации белка и роста кристаллов с использованием 96-луночной высокопроизводительной диализной пластины. Использование трубок-диализаторов для крупномасштабного выращивания микрокристаллов также продемонстрировано для серийной кристаллографии и приложений MicroED.
Abstract
Понимание структурно-функциональных взаимосвязей макромолекул, таких как белки, на молекулярном уровне жизненно важно для биомедицины и современных изобретений лекарств. На сегодняшний день рентгеновская кристаллография остается наиболее успешным методом решения трехмерных белковых структур с атомным разрешением. Благодаря недавним достижениям в области серийной кристаллографии, использующим рентгеновские лазеры на свободных электронах (XFEL) или источники синхротронного излучения, кристаллография белков вышла на новый уровень, где способность получать данные с временным разрешением обеспечивает важное механистическое понимание поведения биологических молекул при комнатной температуре. Этот протокол описывает простой рабочий процесс с высокой пропускной способностью (HTP) для скрининга условий кристаллизации с использованием 96-луночной диализной пластины. Эти планшеты соответствуют стандарту Общества биомолекулярного скрининга (SBS) и могут быть легко установлены с помощью любой стандартной кристаллизационной лаборатории. Как только оптимальные условия определены, с помощью диализатора можно получить большое количество кристаллов (сотни микрокристаллов). Чтобы подтвердить надежность и универсальность этого подхода, были кристаллизованы четыре различных белка, в том числе два мембранных белка.
Introduction
За последнее столетие рентгеновская кристаллография сыграла решающую роль в выяснении и понимании структурно-функциональной парадигмы биологических макромолекул. На сегодняшний день он продолжает оставаться одним из наиболее успешных методов выяснения структур атомного разрешения многих уникальных белков, которые имеют решающее значение для фундаментального понимания биохимии клеток, медицины и раннего открытия лекарств 1,2. Однако кристаллизация белка остается узким местом в изучении многих белковых мишеней, особенно мембранных белков и крупных белковых комплексов3. Следовательно, кристаллизация белка почти всегда считается искусством из-за трудоемких методов проб и ошибок, используемых 4,5,6.
Осаждающий агент обычно добавляют в белковый раствор с высокой концентрацией с образованием хорошо упорядоченного, правильного и повторяющегося решетчатого расположения белковых молекул, известных как кристаллы. При благоприятных условиях, таких как температура, рН, концентрация и осаждающий агент, в конечном итоге образуется пересыщенный раствор с последующим зарождением кристаллов и ростом 7,8. Несмотря на то, что было достигнуто много успехов в пробных установках кристаллизации, главным образом с развитием высокопроизводительных роботизированных систем и наличием готовых экранов с «разреженной матрицей», общие подходы к кристаллизации белков в значительной степени оставались неизменными на протяжении многих лет. Распространенные экспериментальные методы кристаллизации белка включают диффузию пара (висячая капля и сидячая капля)9, микропорцию (под маслом)10,11, диффузию со свободным интерфейсом (микрофлюидные устройства)12 и диализ (с использованием кнопок и других методов)13,14,15. Однако существуют и другие, более специализированные установки, такие как мезофазные подходы для кристаллизации мембранных белков16,17. В то время как большинство рентгеновских белковых структур, депонированных в Банке данных о белках, до сих пор были решены путем кристаллизации методами диффузиипара 6,18, другие подходы, такие как кристаллизация диализом, по-видимому, недостаточно используются, вероятно, из-за практических аспектов, связанных с их экспериментальной установкой.
Кристаллизация диализом просто основана на медленной диффузии растворенных веществ (осадителей, ионов, добавок и буферов) через полупроницаемую мембрану, которая одновременно предотвращает циркуляцию белковых молекул. Таким образом, белковый раствор медленно приводится в равновесие, при этом осадитель достигает необходимой концентрации для кристаллизации. Кинетика системы зависит от температуры, концентрации осадка и отсечки молекулярной массы целлюлозной мембраны (MWCO)19. На сегодняшний день наиболее популярной установкой кристаллизации с помощью диализа является использование кнопок микродиализа из прозрачных акриловых листов. Они обычно погружаются в резервуары (в основном с использованием подвесных капельных пластин для диффузии пара), содержащие растворы осаждающих кристаллизации. Однако этот метод с более низкой пропускной способностью также требует специальной сборки для герметизации белкового раствора внутри диализной мембраны, размещенной над кнопочной камерой, как показано на рисунке 1. Кроме того, пузырьки воздуха, застрявшие между диализной мембраной и белковым раствором, являются частой проблемой, которая ухудшает рост кристаллов. Еще одним ограничением метода являются требования к образцам, в соответствии с которыми необходимы гораздо более высокие концентрации и объемы по сравнению с методами диффузии пара для размещения кнопок диализа. Поэтому кристаллизация с помощью кнопок микродиализа воспринимается как непривлекательный метод, особенно для сложных мишеней, таких как мембранные белки, выход очистки которых удручающе низок. Недавно были разработаны микрофлюидные устройства для облегчения кристаллизации белка путем диализа15. Эти чипы также были разработаны, чтобы иметь высокую рентгеновскую прозрачность с низким фоном, что позволяет использовать чипы для сбора данных in situ при комнатной температуре, тем самым устраняя неудобства сбора и криоохлаждения кристаллов. Несмотря на эти достижения, этот подход по-прежнему очень низкопроизводительный и дорогой.
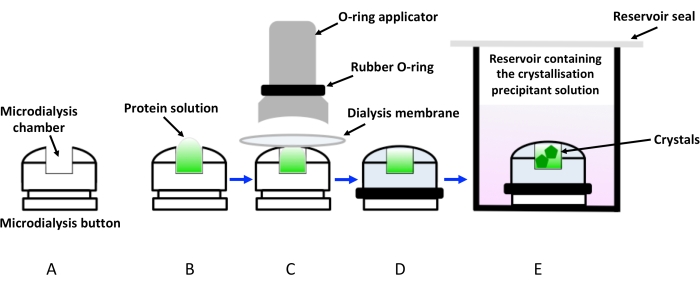
Рисунок 1: Схематическое изображение кристаллизации диализом с использованием кнопок диализа. (А) Схематическое изображение кнопки кристаллизационного диализа. (B) Белковый раствор добавляют в камеру кнопки микродиализа. (C) Диализная мембрана удерживается на кнопке микродиализа с помощью резинового кольца (уплотнительного кольца), приложенного через аппликатор. (D) Кнопка диализа готова к погружению в резервуар, содержащий кристаллизационный раствор (диализирующий раствор), как показано на (E). Флакон с погружной кнопкой диализа должен быть запечатан, чтобы избежать испарения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Здесь представлен простой протокол для скрининга условий кристаллизации белка и роста кристаллов с использованием 96-луночной высокопроизводительной диализной пластины. Эти одноразовые пластины предназначены для использования аналогично кристаллизационным пластинам для диффузии пара (пипетка, затем уплотнение), как показано на рисунке 2. Пластины вмещают до 3,2 мкл белка и 350 мкл диализного раствора. Каждая скважина имеет отдельную регенерированную целлюлозную мембрану для предотвращения перекрестного загрязнения между скважинами. Установка занимает около 10 минут и не требует какого-либо специального оборудования, кроме того, что можно найти во всех стандартных кристаллизационных лабораториях. Четыре различных белка, в том числе два мембранных белка, используются для демонстрации и подтверждения этого подхода в качестве эффективного метода кристаллографии белков с высокой пропускной способностью (HTP).
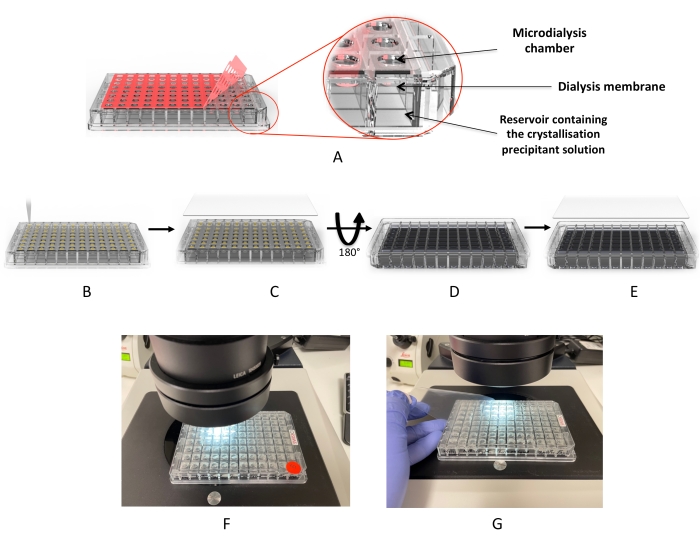
Рисунок 2: Процесс кристаллизации с использованием микродиализной пластины. А) Удаление красной клейкой “покровной пленки”. (B) Дозирование капель белка в каждую из капельных лунок. (C) Колодцы покрыты УФ-пленкой. (D) Пластина перевернута для добавления диализных растворов (или кристаллизационного экрана). (E) Пластина запечатывается и инкубируется. (Ф,Г) Микроскопический осмотр капель. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Использование этой кристаллизации по протоколу диализа было продемонстрировано с использованием пробирки диализатора объемом 0,5 мл (рис. 3) для крупномасштабного (от сотен до тысяч) производства микрокристаллов, пригодных для современных методов сбора данных, таких как серийная кристаллография на установках XFEL 20,21,22,23,24 и синхротронах25,26,27 , а также для подходов MicroED28,29,30.
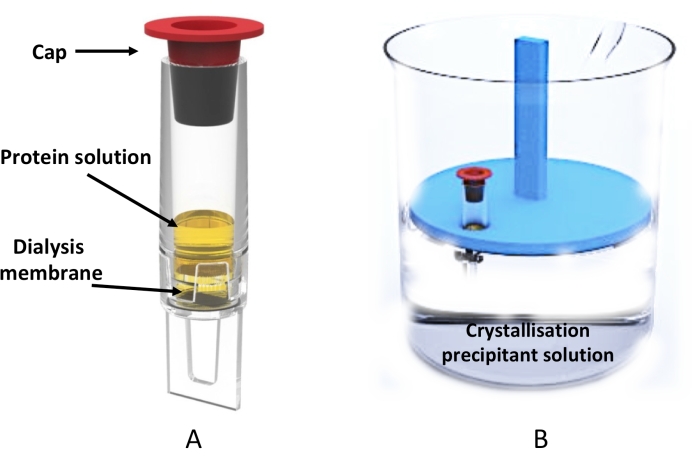
Рисунок 3: Крупномасштабная кристаллизация микродиализа с использованием трубки диализатора . (A) Схематическое изображение пробирки диализатора объемом 0,5 мл. (B) Вид сбоку стакана, содержащего кристаллизационный раствор, и плавающей стойки для трубки, содержащей трубку диализатора. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Protocol
Representative Results
Discussion
В настоящее время кристаллизация диализом является наиболее малоиспользуемым методом кристаллизации, а именно из-за низкой пропускной способности и утомительного характера существующих подходов, таких как микродиализ с помощью кнопок. Здесь простой, но надежный протокол следует рабочему процессу HTP для выращивания кристаллов белка путем диализа через коммерчески доступную микродиализную пластину и пробирку диализатора. В зависимости от целевого белка микродиализная пластина и диализаторная трубка, используемые в процедуре, поставляются с выбором диализной мембраны с MWCO 3, 5, 10 или 30 кДа. Протокол может быть легко настроен на любой стандартной кристаллизационной установке и имеет большое преимущество, заключающееся в том, что он применим как к растворимым, так и к мембранным белкам. Однако белок-белковые и белково-нуклеиновые кислоты не тестировались во время этого протокола.
Как и в любом подходе к кристаллизации с помощью диализа, объемное соотношение между образцом белка и диализным раствором имеет решающее значение. В этом протоколе рекомендуется соотношение 1:100 между образцом и диализным раствором, но, поскольку микродиализная пластина допускает максимальную емкость 350 мкл диализного раствора, эти соотношения могут быть исследованы для получения кристаллических ударов. Объем 1-2 мкл белка используется в представленном протоколе при настройке кристаллизационных пластин. Это необходимо для того, чтобы капли точно схватывались с помощью ручной многоканальной пипетки. Используя электронные пипетки (многоканальные или дозирующие пипетки с повторным дозированием) или роботы для дозирования жидкости HTP, можно точно получить капли меньшего объема, тем самым снижая количество необходимого белка. Кроме того, из-за относительно небольших объемов диализного буфера, необходимого для микродиализной пластины (в отличие от других традиционных методов диализа), можно (без широкого использования ресурсов) исследовать большие химические пространства не только с использованием коммерчески доступных кристаллизационных экранов, но и с оптимизационными экранами (разработанными с учетом начальных условий кристаллизации).
Важнейшим этапом в представленной процедуре ПВТ является своевременное нанесение небольших объемов белка (0,50-3,2 мкл на условие) на диализную пластину для ограничения обезвоживания и потери образца. Это можно легко смягчить, используя многоканальную дозирующую дозаторную дозаторную дозатор или роботизированную систему кристаллизации. Длительное время инкубации, например, более 2 недель, пластин при 20 ° C может привести к обезвоживанию белковых капель или повреждению недавно образовавшихся кристаллов. Хранение диализных пластин в увлажняющей камере или герметичном пакете может смягчить этот эффект. Кроме того, рекомендуется использовать стерильные материалы и методы, чтобы избежать роста бактерий.
Как упоминалось во введении, в последнее время, в связи с возросшей потребностью в понимании структурной динамики белка для механизмов заболевания, взаимодействий связывания белка с лигандом и взаимодействия белка с белком, область рентгеновской кристаллографии белков претерпела революцию благодаря разработке новых и существующих методов кристаллизации, современных подходов к доставке образцов кристаллов, новых поколений источников рентгеновского излучения и новых сложных методов сбора и обработки данных36 ,37,38. Таким образом, появление серийной микрокристаллографии при комнатной температуре, выполненной с использованием XFEL или источников синхротронного излучения, стало замечательным инструментом в структурной биологии, особенно в области мембранных белков39. Тем не менее, тысячи микрокристаллов необходимы для получения достаточного количества данных для надежного структурного решения, что является непростой задачей (по крайней мере, при обычных методах кристаллизации). Описанный здесь метод диализной кристаллизации позволяет производить большое количество микрокристаллов. После того, как условия кристаллизации для производства микрокристаллов (1-10 мкм) были определены с помощью микродиализной пластины, с помощью диализатора объемом 0,5 мл можно получить большое количество микрокристаллов высокой плотности (рис. 5). Эти кристаллы идеально подходят для сбора данных с использованием фиксированных мишеней или систем доставки проб жидкой струей27,40. Кристаллы, полученные с помощью этого метода, также могут быть пригодны для применения MicroED. Однако их, возможно, придется измельчить до подходящего размера и толщины для этого конкретного применения, поскольку электроны гораздо сильнее взаимодействуют с кристаллами, чем рентгеновские фотоны41.
В заключение, описанный здесь подход к кристаллизации диализом дополняет развивающиеся стратегии кристаллизации белка для определения структуры и расширяет диапазон усилий, которые могут быть использованы для определения новых белковых мишеней, которые ранее не увенчались успехом при использовании других традиционных методов.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Мы признаем финансирование со стороны Министерства бизнеса, энергетики и промышленной стратегии Соединенного Королевства (BEIS). Мы благодарим Алекса Р. Джонса и Майка Шоу из Национальной физической лаборатории за их отзывы о рукописи.
Materials
| 0.2 mL tubes | Thermo Scientific | AB0620 | For aliquoting protein solutions. |
| 0.2 µm syringe filter | Sartorius | 17823———-K | Surfactant-free cellulose acetate filters. For filtering dialysis solutions. |
| 0.22 µm membrane filters | Millipore | GSTF04700 | Membrane filters for filtering large volumes of buffers |
| 12-channel, variable 0.5 – 10 µL Research plus pipette | Eppendorf | 3125000028 | For dispensing protein drops onto the Diaplate. |
| 12-channel, variable 30 – 300 µL Eppendorf Research plus pipette | Eppendorf | 3125000060 | For dispensing dialysis solutions on the Diaplate reservoirs. |
| 20 mL syringe | Fisherbrand | 15889152 | For use with syringe filters. |
| 96 well 2.2 mL deep-well plates | Thermo Scientific | AB0788 | Polypropylene deep-well storage plates; for preparing screens using the Hamilton Microlab STARlet. |
| Centrifuge 5425 | Eppendorf | 5405000565 | With rotor FA-24×2 with a maximum g-force of 21,300 x g. |
| Diacon dialyser | SWISSCI | W72010 | Dialyzer tubes with a regenerated cellulose membrane with a molecular weight cut-off of 10 kDa. Ideal for protein solutions of up to 0.5 mL. |
| Diaplate 96-well plate | SWISSCI | W82010 | Microdialysis plate. The Diaplate consists of two sides with a regenerated cellulose membrane in-between with a molecular weight cut-off of 10 kDa. |
| Falcon 50 mL High Clarity PP Centrifuge Tube | Corning | 352070 | For holding dialysis solutions. |
| Floating rack | SWISSCI | n/a | Included in the Diacon kit |
| Floor-standing vibration-free incubator | Molecular Dimensions | MD5-01 | 400 L temperature-controlled incubator set to 20 °C. |
| Leica M205 C stereo microscope | Leica | Planapo 1.0x objective, 7.8x – 160x zoom range with DMC 4500 camera | |
| Lysozyme from chicken egg white | Sigma Aldrich | 62971 | Lyophilized protein |
| Memgold2 | Molecular Dimensions | MD1-64 | Sparse-matrix screen |
| Microlab STARlet | Hamilton | n/a | Liquid handler system. |
| Reservoir cover film | SWISSCI | n/a | Included in the Diaplate kit |
| Reusable bottle top filter | Thermo Scientific | DS0320-5045 | For fitering large volumes of buffers, for use with 0.22 µm membrane filters |
| Sealing paddle | SWISSCI | n/a | Included in the Diaplate kit |
| Thaumatin from Thaumatococcus daniellii | Sigma Aldrich | T7638 | Lyophilized protein |
| UV cover film | SWISSCI | n/a | Included in the Diaplate kit |
References
- Brooks-Bartlett, J. C., Garman, E. F. The nobel science: One hundred years of crystallography. Interdisciplinary Science Reviews. 40 (3), 244-264 (2015).
- Maveyraud, L., Mourey, L. Protein X-ray crystallography and drug discovery. Molecules. 25 (5), (2020).
- Kwan, T. O. C., Axford, D., Moraes, I. Membrane protein crystallography in the era of modern structural biology. Biochemical Society Transactions. 48 (6), 2505-2524 (2020).
- Birch, J., et al. The fine art of integral membrane protein crystallisation. Methods. 147, 150-162 (2018).
- Gorrec, F., Löwe, J. Automated protocols for macromolecular crystallization at the MRC laboratory of molecular biology. Journal of Visualized Experiments. 131 (131), (2018).
- Govada, L., Chayen, N. E. Choosing the method of crystallization to obtain optimal results. Crystals. 9 (2), 106 (2019).
- Chayen, N. E. Turning protein crystallisation from an art into science. Current Opinion in Structural Biology. 14 (5), 577-583 (2004).
- McPherson, A., Gavira, J. A. Introduction to protein crystallization. Acta Crystallographica Section F: Structural Biology Communications. 70 (1), 2-20 (2014).
- Gulbis, J. Protein crystallography: methods and protocols. Crystallography Reviews. 24 (2), 136-143 (2018).
- D’Arcy, A., Bergfors, T., Cowan-Jacob, S. W., Marsh, M. Microseed matrix screening for optimization in protein crystallization: What have we learned. Acta Crystallographica Section:F Structural Biology Communications. 70 (9), 1117-1126 (2014).
- Shaw Stewart, ., D, P., Kolek, S. A., Briggs, R. A., Chayen, N. E., Baldock, P. F. Random microseeding: a theoretical and practical exploration of seed stability and seeding techniques for successful protein crystallization. Crystal Growth & Design. 11 (8), 3432-3441 (2011).
- Junius, N., et al. A microfluidic device for both on-chip dialysis protein crystallization and in situ X-ray diffraction. Lab on a Chip. 20 (2), 296-310 (2020).
- Junius, N., Vahdatahar, E., Oksanen, E., Ferrer, J. L., Budayova-Spano, M. Optimization of crystallization of biological macromolecules using dialysis combined with temperature control. Journal of Applied Crystallography. 53 (3), 686-698 (2020).
- Vahdatahar, E., Junius, N., Budayova-Spano, M. Optimization of crystal growth for neutron macromolecular crystallography. Journal of Visualized Experiments. 169, (2021).
- Jaho, S., et al. Crystallization of proteins on chip by microdialysis for in situ X-ray diffraction studies. Journal of Visualized Experiments. 170, (2021).
- Liu, W., Cherezov, V. Crystallization of membrane proteins in lipidic mesophases. Journal of Visualized Experiments. 49, 2501 (2011).
- Ujwal, R., Abramson, J. High-throughput crystallization of membrane proteins using the lipidic bicelle method. Journal of Visualized Experiments. 59, (2012).
- Parker, J. L., Newstead, S. Membrane protein crystallisation: Current trends and future perspectives. Advances in Experimental Medicine and Biology. 922. , 61-72 (2016).
- Apostolopoulou, V., Junius, N., Sear, R. P., Budayova-Spano, M. Mixing salts and polyethylene glycol into protein solutions: The effects of diffusion across semi-permeable membranes and of convection. Crystal Growth & Design. 20 (6), 3927-3936 (2020).
- Neutze, R., Wouts, R., Vander Spoel, D., Weckert, E., Hajdu, J. Potential for biomolecular imaging with femtosecond X-ray pulses. Nature. 406 (6797), 752-757 (2000).
- Chapman, H. N., et al. Femtosecond X-ray protein nanocrystallography. Nature. 470 (7332), 73-78 (2011).
- Mizohata, E., Nakane, T., Fukuda, Y., Nango, E., Iwata, S. Serial femtosecond crystallography at the SACLA: breakthrough to dynamic structural biology. Biophysical Reviews. 10 (2), 209-218 (2018).
- Nogly, P., et al. Lipidic cubic phase serial millisecond crystallography using synchrotron radiation. IUCrJ. 2 (2), 168-176 (2015).
- Johansson, L. C., et al. XFEL structures of the human MT2 melatonin receptor reveal the basis of subtype selectivity. Nature. 569 (7755), 289-292 (2019).
- Owen, R. L., et al. Low-dose fixed-target serial synchrotron crystallography. Acta Crystallographica Section D: Structural Biology. 73 (4), 373-378 (2017).
- Weinert, T., et al. Serial millisecond crystallography for routine room-temperature structure determination at synchrotrons. Nature communications. 8 (1), 542 (2017).
- Axford, D., et al. Two states of a light-sensitive membrane protein captured at room temperature using thin-film sample mounts. Acta Crystallographica Section D: Structural Biology. 78 (1), 52-58 (2022).
- Nannenga, B. L., Gonen, T. The cryo-EM method microcrystal electron diffraction (MicroED). Nature Methods. 16 (5), 369-379 (2019).
- Nguyen, C., Gonen, T. Beyond protein structure determination with MicroED. Current Opinion in Structural Biology. 64, 51-58 (2020).
- Mu, X., Gillman, C., Nguyen, C., Gonen, T. An overview of microcrystal electron diffraction (MicroED). Annual Review of Biochemistry. 90, 431-450 (2021).
- Kwan, T. O. C., et al. Selection of biophysical methods for characterisation of membrane proteins. International Journal of Molecular Sciences. 22 (10), 2605 (2019).
- Pos, K. M., Purification Diederichs, K. crystallization and preliminary diffraction studies of AcrB, an inner-membrane multi-drug efflux protein. Acta Crystallographica Section D: Biological Crystallography. 58 (10), 1865-1867 (2002).
- Guan, L., Mirza, O., Verner, G., Iwata, S., Kaback, H. R. Structural determination of wild-type lactose permease. Proceedings of the National Academy of Sciences. 104 (39), 15294-15298 (2007).
- Kwan, T. O. C., Reis, R., Moraes, I. In situ measurements of polypeptide samples by dynamic light scattering: membrane proteins, a case study. Methods in Molecular Biology. , 189-202 (2021).
- Seddon, A. M., Curnow, P., Booth, P. J. Membrane proteins, lipids and detergents: not just a soap opera. Biochimica et Biophysica Acta (BBA)-Biomembranes. (1-2), 105-117 (2004).
- Wickstrand, C., et al. A tool for visualizing protein motions in time-resolved crystallography. Structural Dynamics. 7 (2), 024701 (2020).
- Orville, A. M. Recent results in time resolved serial femtosecond crystallography at XFELs. Current Opinion in Structural Biology. 65, 193-208 (2020).
- Schulz, E. C., Yorke, B. A., Pearson, A. R., Mehrabi, P. Best practices for time-resolved serial synchrotron crystallography. Acta Crystallographica Section D: Structural Biology. 78 (1), 14-29 (2022).
- Neutze, R., Brändén, G., Schertler, G. F. Membrane protein structural biology using X-ray free eletron lasers. Current Opinion in Structural Biology. 33, 115-125 (2015).
- Wierstall, U. Liquid sample delivery techniques for serial femtosecond crystallography. Philosophical Transactions of the Royal Society B: Biological Sciences. 369 (1647), 20130337 (2014).
- Shi, D., Nannenga, B. L., Iadanza, M. G., Gonen, T. Three-dimensional electron crystallography of protein microcrystals. eLife. 2, 01345 (2013).

