High-Throughput Eiwitkristallisatie via microdialyse
Summary
Het gepresenteerde protocol beschrijft een eenvoudige aanpak voor het screenen van eiwitkristallisatieomstandigheden en kristalgroei met behulp van een 96-well high-throughput dialyseplaat. Het gebruik van dialysatorbuizen voor de grootschalige groei van microkristallen wordt ook gedemonstreerd voor seriële kristallografie en MicroED-toepassingen.
Abstract
Het begrijpen van de structuur-functierelaties van macromoleculen, zoals eiwitten, op moleculair niveau is van vitaal belang voor de biogeneeskunde en de ontdekking van moderne geneesmiddelen. Tot op heden blijft röntgenkristallografie de meest succesvolle methode voor het oplossen van driedimensionale eiwitstructuren met atomaire resolutie. Met recente vooruitgang in seriële kristallografie, hetzij met behulp van röntgenvrije elektronenlasers (XFELs) of synchrotronlichtbronnen, is eiwitkristallografie gevorderd naar de volgende grens, waar het vermogen om tijd-opgeloste gegevens te verkrijgen belangrijke mechanistische inzichten biedt in het gedrag van biologische moleculen bij kamertemperatuur. Dit protocol beschrijft een eenvoudige high-throughput (HTP) workflow voor het screenen van kristallisatiecondities door het gebruik van een 96-well dialyseplaat. Deze platen volgen de standaard van de Society for Biomolecular Screening (SBS) en kunnen eenvoudig worden opgezet met behulp van elk standaard kristallisatielaboratorium. Zodra de optimale omstandigheden zijn geïdentificeerd, kunnen grote hoeveelheden kristallen (honderden microkristallen) worden geproduceerd met behulp van de dialysator. Om de robuustheid en veelzijdigheid van deze aanpak te valideren, werden vier verschillende eiwitten gekristalliseerd, waaronder twee membraaneiwitten.
Introduction
In de afgelopen eeuw is röntgenkristallografie van cruciaal belang geweest bij het ophelderen en begrijpen van het structuur-functieparadigma van biologische macromoleculen. Tot op heden blijft het een van de meest succesvolle methoden bij het ophelderen van atomaire resolutiestructuren van veel uniek verschillende eiwitten die cruciaal zijn voor het fundamentele begrip van celbiochemie, geneeskunde en vroege ontdekking van geneesmiddelen 1,2. Eiwitkristallisatie blijft echter een knelpunt bij het bestuderen van veel eiwitdoelen, met name membraaneiwitten en grote eiwitcomplexen3. Bijgevolg wordt eiwitkristallisatie bijna altijd als een kunst beschouwd vanwege de arbeidsintensieve trial-and-error-benaderingen die 4,5,6 worden gebruikt.
Een neerslagmiddel wordt meestal in hoge concentratie aan een eiwitoplossing toegevoegd om een goed geordende, regelmatige en herhalende roosterindeling van eiwitmoleculen te vormen, bekend als kristallen. Onder gunstige omstandigheden, zoals temperatuur, pH, concentratie en precipitant middel, vormt zich uiteindelijk een oververzadigde oplossing, gevolgd door kristalkernvorming en groei 7,8. Hoewel er veel vooruitgang is geboekt in de opstelling van kristallisatieproeven, voornamelijk met de ontwikkeling van robotsystemen met hoge doorvoer en de beschikbaarheid van kant-en-klare “schaarse matrix” -schermen, zijn de algemene benaderingen van eiwitkristallisatie in de loop der jaren grotendeels ongewijzigd gebleven. Veel voorkomende experimentele eiwitkristallisatietechnieken zijn dampdiffusie (hangende druppel en zittende druppel)9, microbatch (onder olie)10,11, vrije interfacediffusie (microfluïdische apparaten)12 en dialyse (met behulp van knoppen en andere technieken)13,14,15. Er bestaan echter ook andere, meer gespecialiseerde opstellingen, zoals mesofasebenaderingen voor het kristalliseren van membraaneiwitten16,17. Hoewel de meerderheid van de röntgeneiwitstructuren die in de Protein Data Bank zijn afgezet tot nu toe zijn opgelost door kristallisatie door dampdiffusiemethoden 6,18, lijken andere benaderingen, zoals kristallisatie door dialyse, onderbenut te zijn, waarschijnlijk vanwege de praktische aspecten die verband houden met hun experimentele opstelling.
Kristallisatie door dialyse is eenvoudigweg afhankelijk van de langzame diffusie van opgeloste stoffen (precipitanten, ionen, additieven en buffers) door een semi-permeabel membraan dat tegelijkertijd voorkomt dat eiwitmoleculen circuleren. Op deze manier wordt de eiwitoplossing langzaam in evenwicht gebracht, waarbij de precipitant de noodzakelijke concentratie bereikt om te kristalliseren. De kinetiek van het systeem is afhankelijk van de temperatuur, de precipitantconcentratie en de cellulosemembraanmoleculaire gewichtsafsnijding (MWCO)19. Tot op heden is de meest populaire kristallisatie-opstelling door dialyse het gebruik van microdialyseknoppen gemaakt van transparante acrylplaten. Deze worden meestal ondergedompeld in reservoirs (meestal met behulp van dampdiffusie hangende druppelplaten) met de kristallisatie precipitant oplossingen. Deze methode met een lagere doorvoer vereist echter ook een specifieke assemblage om de eiwitoplossing in het dialysemembraan dat over de knoopkamer is geplaatst, af te dichten, zoals geïllustreerd in figuur 1. Bovendien zijn luchtbellen die vastzitten tussen het dialysemembraan en de eiwitoplossing een veel voorkomend probleem dat de kristalgroei schaadt. Een andere beperking van de methode zijn de monstervereisten, waarbij veel hogere concentraties en volumes nodig zijn in vergelijking met dampdiffusiemethoden, om de dialyseknoppen te accommoderen. Daarom is kristallisatie met behulp van microdialyseknoppen gezien als een onaantrekkelijke methode, vooral voor moeilijke doelen zoals membraaneiwitten, waarvan de zuiveringsopbrengsten frustrerend laag zijn. Onlangs zijn microfluïdische apparaten ontwikkeld om eiwitkristallisatie door dialyse te vergemakkelijken15. Deze chips zijn ook ontworpen om een hoge röntgentransparantie met een lage achtergrond te hebben, waardoor de chips kunnen worden gebruikt voor in-situ gegevensverzameling bij kamertemperatuur, waardoor het ongemak van het oogsten en cryokoelen van kristallen wordt geëlimineerd. Ondanks deze vooruitgang is de aanpak nog steeds zeer laag en duur.
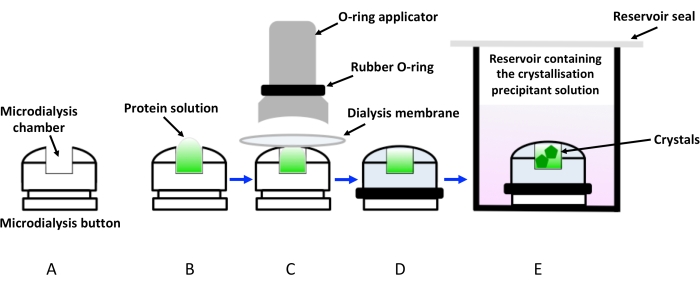
Figuur 1: Schematische weergave van kristallisatie door dialyse met behulp van dialyseknoppen. (A) Schematische weergave van een kristallisatiedialyseknop. (B) De eiwitoplossing wordt toegevoegd aan de microdialyseknopkamer. (C) Het dialysemembraan wordt tegen de microdialyseknop gehouden met behulp van een rubberen ring (O-ring) die via een applicator wordt aangebracht. (D) De dialyseknop is klaar om te worden ondergedompeld in het reservoir met de kristallisatieoplossing (dialyseoplossing), zoals weergegeven in (E). De injectieflacon met de ondergedompelde dialyseknop moet worden afgesloten om verdamping te voorkomen. Klik hier om een grotere versie van deze figuur te bekijken.
Hier wordt een eenvoudig protocol gepresenteerd voor het screenen van eiwitkristallisatiecondities en kristalgroei met behulp van de 96-well high-throughput dialyseplaat. Deze wegwerpplaten zijn ontworpen om op dezelfde manier te worden gebruikt als de dampdiffusiekristallisatieplaten (pipet dan verzegelen), zoals weergegeven in figuur 2. De platen bieden plaats aan maximaal 3,2 μL eiwit en 350 μL dialyseoplossing. Elke put is voorzien van een afzonderlijk geregenereerd cellulosemembraan om kruisbesmetting tussen de putten te voorkomen. De installatie duurt ongeveer 10 minuten om te voltooien en vereist geen gespecialiseerde apparatuur naast wat te vinden is in alle standaard kristallisatielaboratoria. Vier verschillende eiwitten, waaronder twee membraaneiwitten, worden gebruikt om deze aanpak te demonstreren en te valideren als een effectieve methode voor high-throughput (HTP) eiwitkristallografie.
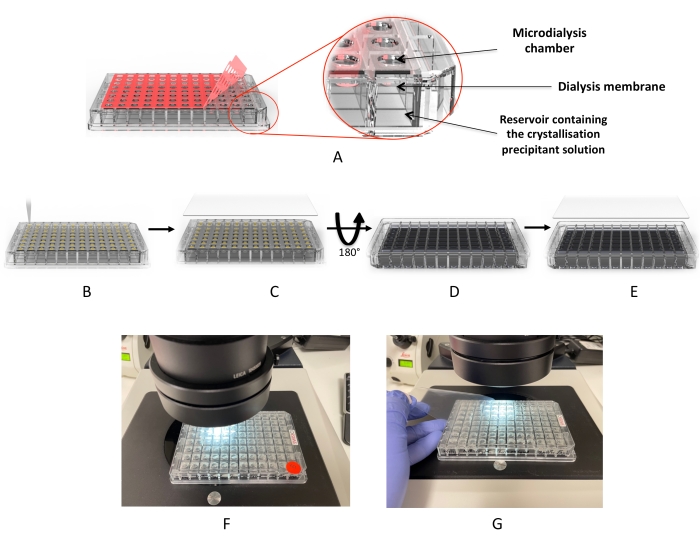
Figuur 2: Kristallisatieworkflow met behulp van de microdialyseplaat . (A) Verwijdering van de rode kleefstof “afdekfolie”. (B) Het doseren van de eiwitdruppels in elk van de druppelputten. (C) De putten zijn bedekt met de UV-“afdekfolie”. (D) De plaat wordt omgekeerd om de dialyseoplossingen (of kristallisatiescherm) toe te voegen. (E) De plaat wordt verzegeld en geïncubeerd. (F,G) Microscoop inspectie van de druppels. Klik hier om een grotere versie van deze figuur te bekijken.
Het gebruik van deze kristallisatie door dialyseprotocol werd gedemonstreerd met behulp van de 0,5 ml dialysatorbuis (figuur 3) voor de grootschalige (honderden tot duizenden) productie van microkristallen, geschikt voor state-of-the-art gegevensverzamelingsmethoden zoals seriële kristallografie in zowel XFEL-faciliteiten 20,21,22,23,24 als synchrotrons25,26,27 , evenals voor MicroED 28,29,30-benaderingen.
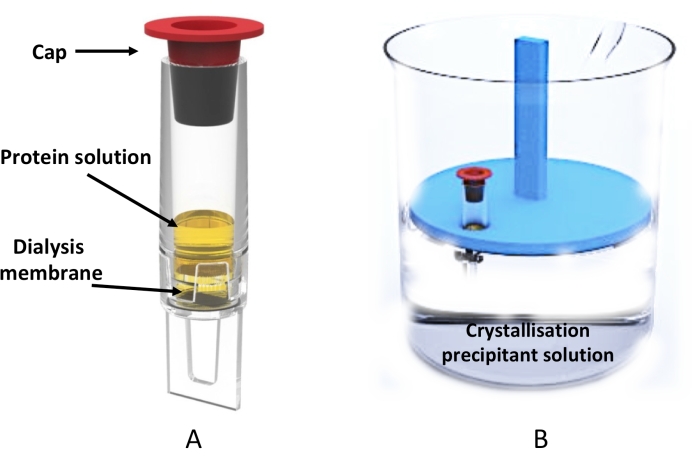
Figuur 3: Grootschalige microdialysekristallisatie met behulp van de dialysatorbuis. (A) Schematische weergave van de 0,5 ml dialysatorbuis. (B) Zijaanzicht van een bekerglas met de kristallisatieoplossing en het drijvende buizenrek met een dialysatorbuis. Klik hier om een grotere versie van deze figuur te bekijken.
Protocol
Representative Results
Discussion
Momenteel is kristallisatie door dialyse de meest onderbenutte kristallisatiemethode, namelijk vanwege de lage doorvoer en de vervelende aard van de bestaande benaderingen, zoals microdialyse met knoppen. Hier volgt een eenvoudig maar robuust protocol een HTP-workflow voor eiwitkristalgroei door dialyse via een in de handel verkrijgbare microdialyseplaat en dialysatorbuis. Afhankelijk van het doeleiwit hebben de microdialyseplaat en de dialyseerbuis die in de procedure worden gebruikt, de keuze uit een dialysemembraan met een MWCO van 3, 5, 10 of 30 kDa. Het protocol kan eenvoudig worden opgezet in elke standaard kristallisatiefaciliteit en heeft het grote voordeel dat het toepasbaar is op zowel oplosbare als membraaneiwitten. Eiwit-eiwit en eiwit-nucleïnezuurcomplexen werden echter niet getest tijdens dit protocol.
Zoals bij elke kristallisatiebenadering door dialyse, is de volumeverhouding tussen het eiwitmonster en de dialyseoplossing van cruciaal belang. In dit protocol wordt een verhouding van 1:100 tussen het monster en de dialyseoplossing aanbevolen, maar aangezien de microdialyseplaat een maximale capaciteit van 350 μL dialyseoplossing mogelijk maakt, kunnen deze verhoudingen worden onderzocht om kristaltreffers te verkrijgen. Een volume van 1-2 μL eiwit wordt gebruikt in het gepresenteerde protocol bij het opzetten van kristallisatieplaten. Dit is om ervoor te zorgen dat druppels nauwkeurig worden ingesteld met een handmatige meerkanaalspipet. Door gebruik te maken van elektronische pipetten (meerkanaals of herhaalde doseerpipetten) of HTP-vloeistofdoseerrobots kunnen druppels met lagere volumes nauwkeurig worden bereikt, waardoor de benodigde hoeveelheid eiwit wordt verlaagd. Bovendien is het, vanwege de relatief lage volumes dialysebuffer die nodig zijn voor de microdialyseplaat (in tegenstelling tot andere conventionele dialysemethoden), mogelijk (zonder het uitgebreide gebruik van middelen) om grote chemische ruimtes te verkennen, niet alleen met behulp van commercieel beschikbare kristallisatieschermen, maar ook met optimalisatieschermen (ontworpen rond de initiële kristallisatie-hitconditie).
Een cruciale stap in de gepresenteerde HTP-procedure is de tijdige toepassing van kleine eiwitvolumes (0,50-3,2 μL per aandoening) op de dialyseplaat om uitdroging en monsterverlies te beperken. Dit kan eenvoudig worden verzacht door een meerkanaalspipet, een herhaaldoseerpipet of een robotkristallisatiesysteem te gebruiken. De lange incubatietijd, zoals meer dan 2 weken, van de platen bij 20 °C kan leiden tot uitdroging van de eiwitdruppels of schade aan de recent gevormde kristallen. Het houden van de dialyseplaten in een bevochtigingskamer of een afsluitbare zak kan dit effect verlichten. Bovendien wordt het gebruik van steriele materialen en technieken aanbevolen om bacteriegroei te voorkomen.
Zoals vermeld in de inleiding, onlangs, met de toegenomen behoefte om eiwitstructuurdynamiek voor ziektemechanismen, eiwit-ligandbindingsinteracties en eiwit-eiwitinteracties te begrijpen, is het veld van eiwit-röntgenkristallografie revolutionair veranderd door de ontwikkeling van nieuwe en bestaande kristallisatietechnieken, moderne benaderingen van kristalmonsterafgifte, nieuwe generaties röntgenbronnen en nieuwe geavanceerde methoden voor gegevensverzameling en -verwerking36 ,37,38. Daarom is de komst van seriële microkristallografie bij kamertemperatuur, uitgevoerd met behulp van XFELs of synchrotronlichtbronnen, naar voren gekomen als een opmerkelijk hulpmiddel in de structurele biologie, met name op het gebied van membraaneiwitten39. Er zijn echter duizenden microkristallen nodig om voldoende gegevens te genereren voor een robuuste structuuroplossing, wat geen gemakkelijke taak is (althans niet met conventionele kristallisatiemethoden). De hier beschreven dialysekristallisatiemethode maakt de productie van een groot aantal microkristallen mogelijk. Zodra de kristallisatieconditie voor de productie van microkristallen (1-10 μm) is bepaald met behulp van een microdialyseplaat, kunnen grote hoeveelheden microkristallen met hoge dichtheid worden geproduceerd met behulp van het 0,5 ml dialysatorapparaat (figuur 5). Deze kristallen zijn bij uitstek geschikt voor gegevensverzameling met behulp van vaste doelen of vloeistofstraalmonsterafgiftesystemen27,40. Kristallen verkregen via deze methode kunnen ook geschikt zijn voor MicroED-toepassingen. Deze moeten echter mogelijk worden gefreesd tot een geschikte grootte en dikte voor deze specifieke toepassing, omdat elektronen veel sterker interageren met kristallen dan röntgenfotonen41.
Kortom, de hier beschreven kristallisatie door dialysebenadering draagt bij aan de evoluerende strategieën in eiwitkristallisatie voor structuurbepaling en breidt het scala aan inspanningen uit die kunnen worden gebruikt om nieuwe eiwitdoelen te bepalen die eerder niet succesvol waren met andere conventionele methoden.
Disclosures
The authors have nothing to disclose.
Acknowledgements
We erkennen financiering van het Department of Business, Energy and Industrial Strategy (BEIS) van het Verenigd Koninkrijk. We bedanken Alex R. Jones en Mike Shaw van het National Physical Laboratory voor hun feedback op het manuscript.
Materials
| 0.2 mL tubes | Thermo Scientific | AB0620 | For aliquoting protein solutions. |
| 0.2 µm syringe filter | Sartorius | 17823———-K | Surfactant-free cellulose acetate filters. For filtering dialysis solutions. |
| 0.22 µm membrane filters | Millipore | GSTF04700 | Membrane filters for filtering large volumes of buffers |
| 12-channel, variable 0.5 – 10 µL Research plus pipette | Eppendorf | 3125000028 | For dispensing protein drops onto the Diaplate. |
| 12-channel, variable 30 – 300 µL Eppendorf Research plus pipette | Eppendorf | 3125000060 | For dispensing dialysis solutions on the Diaplate reservoirs. |
| 20 mL syringe | Fisherbrand | 15889152 | For use with syringe filters. |
| 96 well 2.2 mL deep-well plates | Thermo Scientific | AB0788 | Polypropylene deep-well storage plates; for preparing screens using the Hamilton Microlab STARlet. |
| Centrifuge 5425 | Eppendorf | 5405000565 | With rotor FA-24×2 with a maximum g-force of 21,300 x g. |
| Diacon dialyser | SWISSCI | W72010 | Dialyzer tubes with a regenerated cellulose membrane with a molecular weight cut-off of 10 kDa. Ideal for protein solutions of up to 0.5 mL. |
| Diaplate 96-well plate | SWISSCI | W82010 | Microdialysis plate. The Diaplate consists of two sides with a regenerated cellulose membrane in-between with a molecular weight cut-off of 10 kDa. |
| Falcon 50 mL High Clarity PP Centrifuge Tube | Corning | 352070 | For holding dialysis solutions. |
| Floating rack | SWISSCI | n/a | Included in the Diacon kit |
| Floor-standing vibration-free incubator | Molecular Dimensions | MD5-01 | 400 L temperature-controlled incubator set to 20 °C. |
| Leica M205 C stereo microscope | Leica | Planapo 1.0x objective, 7.8x – 160x zoom range with DMC 4500 camera | |
| Lysozyme from chicken egg white | Sigma Aldrich | 62971 | Lyophilized protein |
| Memgold2 | Molecular Dimensions | MD1-64 | Sparse-matrix screen |
| Microlab STARlet | Hamilton | n/a | Liquid handler system. |
| Reservoir cover film | SWISSCI | n/a | Included in the Diaplate kit |
| Reusable bottle top filter | Thermo Scientific | DS0320-5045 | For fitering large volumes of buffers, for use with 0.22 µm membrane filters |
| Sealing paddle | SWISSCI | n/a | Included in the Diaplate kit |
| Thaumatin from Thaumatococcus daniellii | Sigma Aldrich | T7638 | Lyophilized protein |
| UV cover film | SWISSCI | n/a | Included in the Diaplate kit |
References
- Brooks-Bartlett, J. C., Garman, E. F. The nobel science: One hundred years of crystallography. Interdisciplinary Science Reviews. 40 (3), 244-264 (2015).
- Maveyraud, L., Mourey, L. Protein X-ray crystallography and drug discovery. Molecules. 25 (5), (2020).
- Kwan, T. O. C., Axford, D., Moraes, I. Membrane protein crystallography in the era of modern structural biology. Biochemical Society Transactions. 48 (6), 2505-2524 (2020).
- Birch, J., et al. The fine art of integral membrane protein crystallisation. Methods. 147, 150-162 (2018).
- Gorrec, F., Löwe, J. Automated protocols for macromolecular crystallization at the MRC laboratory of molecular biology. Journal of Visualized Experiments. 131 (131), (2018).
- Govada, L., Chayen, N. E. Choosing the method of crystallization to obtain optimal results. Crystals. 9 (2), 106 (2019).
- Chayen, N. E. Turning protein crystallisation from an art into science. Current Opinion in Structural Biology. 14 (5), 577-583 (2004).
- McPherson, A., Gavira, J. A. Introduction to protein crystallization. Acta Crystallographica Section F: Structural Biology Communications. 70 (1), 2-20 (2014).
- Gulbis, J. Protein crystallography: methods and protocols. Crystallography Reviews. 24 (2), 136-143 (2018).
- D’Arcy, A., Bergfors, T., Cowan-Jacob, S. W., Marsh, M. Microseed matrix screening for optimization in protein crystallization: What have we learned. Acta Crystallographica Section:F Structural Biology Communications. 70 (9), 1117-1126 (2014).
- Shaw Stewart, ., D, P., Kolek, S. A., Briggs, R. A., Chayen, N. E., Baldock, P. F. Random microseeding: a theoretical and practical exploration of seed stability and seeding techniques for successful protein crystallization. Crystal Growth & Design. 11 (8), 3432-3441 (2011).
- Junius, N., et al. A microfluidic device for both on-chip dialysis protein crystallization and in situ X-ray diffraction. Lab on a Chip. 20 (2), 296-310 (2020).
- Junius, N., Vahdatahar, E., Oksanen, E., Ferrer, J. L., Budayova-Spano, M. Optimization of crystallization of biological macromolecules using dialysis combined with temperature control. Journal of Applied Crystallography. 53 (3), 686-698 (2020).
- Vahdatahar, E., Junius, N., Budayova-Spano, M. Optimization of crystal growth for neutron macromolecular crystallography. Journal of Visualized Experiments. 169, (2021).
- Jaho, S., et al. Crystallization of proteins on chip by microdialysis for in situ X-ray diffraction studies. Journal of Visualized Experiments. 170, (2021).
- Liu, W., Cherezov, V. Crystallization of membrane proteins in lipidic mesophases. Journal of Visualized Experiments. 49, 2501 (2011).
- Ujwal, R., Abramson, J. High-throughput crystallization of membrane proteins using the lipidic bicelle method. Journal of Visualized Experiments. 59, (2012).
- Parker, J. L., Newstead, S. Membrane protein crystallisation: Current trends and future perspectives. Advances in Experimental Medicine and Biology. 922. , 61-72 (2016).
- Apostolopoulou, V., Junius, N., Sear, R. P., Budayova-Spano, M. Mixing salts and polyethylene glycol into protein solutions: The effects of diffusion across semi-permeable membranes and of convection. Crystal Growth & Design. 20 (6), 3927-3936 (2020).
- Neutze, R., Wouts, R., Vander Spoel, D., Weckert, E., Hajdu, J. Potential for biomolecular imaging with femtosecond X-ray pulses. Nature. 406 (6797), 752-757 (2000).
- Chapman, H. N., et al. Femtosecond X-ray protein nanocrystallography. Nature. 470 (7332), 73-78 (2011).
- Mizohata, E., Nakane, T., Fukuda, Y., Nango, E., Iwata, S. Serial femtosecond crystallography at the SACLA: breakthrough to dynamic structural biology. Biophysical Reviews. 10 (2), 209-218 (2018).
- Nogly, P., et al. Lipidic cubic phase serial millisecond crystallography using synchrotron radiation. IUCrJ. 2 (2), 168-176 (2015).
- Johansson, L. C., et al. XFEL structures of the human MT2 melatonin receptor reveal the basis of subtype selectivity. Nature. 569 (7755), 289-292 (2019).
- Owen, R. L., et al. Low-dose fixed-target serial synchrotron crystallography. Acta Crystallographica Section D: Structural Biology. 73 (4), 373-378 (2017).
- Weinert, T., et al. Serial millisecond crystallography for routine room-temperature structure determination at synchrotrons. Nature communications. 8 (1), 542 (2017).
- Axford, D., et al. Two states of a light-sensitive membrane protein captured at room temperature using thin-film sample mounts. Acta Crystallographica Section D: Structural Biology. 78 (1), 52-58 (2022).
- Nannenga, B. L., Gonen, T. The cryo-EM method microcrystal electron diffraction (MicroED). Nature Methods. 16 (5), 369-379 (2019).
- Nguyen, C., Gonen, T. Beyond protein structure determination with MicroED. Current Opinion in Structural Biology. 64, 51-58 (2020).
- Mu, X., Gillman, C., Nguyen, C., Gonen, T. An overview of microcrystal electron diffraction (MicroED). Annual Review of Biochemistry. 90, 431-450 (2021).
- Kwan, T. O. C., et al. Selection of biophysical methods for characterisation of membrane proteins. International Journal of Molecular Sciences. 22 (10), 2605 (2019).
- Pos, K. M., Purification Diederichs, K. crystallization and preliminary diffraction studies of AcrB, an inner-membrane multi-drug efflux protein. Acta Crystallographica Section D: Biological Crystallography. 58 (10), 1865-1867 (2002).
- Guan, L., Mirza, O., Verner, G., Iwata, S., Kaback, H. R. Structural determination of wild-type lactose permease. Proceedings of the National Academy of Sciences. 104 (39), 15294-15298 (2007).
- Kwan, T. O. C., Reis, R., Moraes, I. In situ measurements of polypeptide samples by dynamic light scattering: membrane proteins, a case study. Methods in Molecular Biology. , 189-202 (2021).
- Seddon, A. M., Curnow, P., Booth, P. J. Membrane proteins, lipids and detergents: not just a soap opera. Biochimica et Biophysica Acta (BBA)-Biomembranes. (1-2), 105-117 (2004).
- Wickstrand, C., et al. A tool for visualizing protein motions in time-resolved crystallography. Structural Dynamics. 7 (2), 024701 (2020).
- Orville, A. M. Recent results in time resolved serial femtosecond crystallography at XFELs. Current Opinion in Structural Biology. 65, 193-208 (2020).
- Schulz, E. C., Yorke, B. A., Pearson, A. R., Mehrabi, P. Best practices for time-resolved serial synchrotron crystallography. Acta Crystallographica Section D: Structural Biology. 78 (1), 14-29 (2022).
- Neutze, R., Brändén, G., Schertler, G. F. Membrane protein structural biology using X-ray free eletron lasers. Current Opinion in Structural Biology. 33, 115-125 (2015).
- Wierstall, U. Liquid sample delivery techniques for serial femtosecond crystallography. Philosophical Transactions of the Royal Society B: Biological Sciences. 369 (1647), 20130337 (2014).
- Shi, D., Nannenga, B. L., Iadanza, M. G., Gonen, T. Three-dimensional electron crystallography of protein microcrystals. eLife. 2, 01345 (2013).

