إنتاج الهيدروجين واستخدامه في مفاعل غشائي
Summary
تتيح المفاعلات الغشائية الهدرجة في الظروف المحيطة دون إدخال H2 المباشر. يمكننا تتبع إنتاج الهيدروجين واستخدامه في هذه الأنظمة باستخدام قياس الطيف الكتلي للغلاف الجوي (atm-MS) وقياس الطيف الكتلي اللوني للغاز (GC-MS).
Abstract
تستهلك الهدرجة الصناعية ~ 11 طن متري من غاز H2 المشتق من الأحفوري سنويا. اخترعت مجموعتنا مفاعلا غشائيا لتجاوز الحاجة إلى استخدام غاز H2 لكيمياء الهدرجة. مصدر المفاعل الغشائي الهيدروجين من الماء ويدفع التفاعلات باستخدام الكهرباء المتجددة. في هذا المفاعل ، تفصل قطعة رقيقة من Pd حجرة إنتاج الهيدروجين الكهروكيميائية عن حجرة الهدرجة الكيميائية. يعمل Pd في المفاعل الغشائي ك (i) غشاء انتقائي للهيدروجين ، (ii) كاثود ، و (iii) محفز للهدرجة. هنا ، نبلغ عن استخدام مطياف الكتلة الجوية (atm-MS) وقياس الطيف الكتلي اللوني للغاز (GC-MS) لإثبات أن التحيز الكهروكيميائي المطبق عبر غشاء Pd يتيح الهدرجة الفعالة دون إدخال H2 المباشر في مفاعل غشائي. باستخدام atm-MS ، قمنا بقياس تغلغل الهيدروجين بنسبة 73٪ ، مما مكن من هدرجة البروبيوفينون إلى بروبيل بنزين بانتقائية 100٪ ، كما تم قياسها بواسطة GC-MS. على عكس الهدرجة الكهروكيميائية التقليدية ، والتي تقتصر على تركيزات منخفضة من المواد الأولية المذابة في إلكتروليت بروتوني ، فإن الفصل المادي لإنتاج الهيدروجين عن الاستخدام في المفاعل الغشائي يتيح الهدرجة في أي مذيب أو بأي تركيز. إن استخدام تركيزات عالية ومجموعة واسعة من المذيبات مهم بشكل خاص لقابلية توسيع المفاعل وتسويقه في المستقبل.
Introduction
تستخدم تفاعلات الهدرجة الكيميائية الحرارية في ~ 20٪ من جميع التخليق الكيميائي1. تتطلب هذه التفاعلات كميات كبيرة من غاز H 2 ، والتي عادة ما تكون مشتقة من الوقود الأحفوري ، ودرجات حرارة تتراوح بين 150 درجة مئوية و 600 درجة مئوية ، وضغوط تصل إلى 200 ضغطجوي 2. الهدرجة الكهروكيميائية هي طريقة جذابة لتجاوز هذه المتطلبات ودفع تفاعلات الهدرجة باستخدام الماء والكهرباء المتجددة3. بالنسبة للهدرجة الكهروكيميائية التقليدية ، يتم إذابة مادة وسيطة غير مشبعة في إلكتروليت بروتوني في خلية كهروكيميائية. عند تطبيق جهد على الخلية، تحدث أكسدة الماء عند المصعد، بينما تحدث الهدرجة عند المهبط. في إعداد التفاعل هذا، تحدث كل من أكسدة الماء الكهروكيميائية والهدرجة الكيميائية في بيئة التفاعل نفسها. يتم إذابة الركيزة العضوية في إلكتروليت بروتوني لتمكين كل من تقسيم الماء الكهروكيميائي وهدرجة المادة الخام. يمكن أن يؤدي قرب هذه التفاعلات إلى تكوين منتج ثانوي وقاذورات القطب عندما يكون المتفاعل عرضة للهجوم النووي أو إذا كان تركيز المتفاعل مرتفعا جدا (>0.25 M)4.
دفعت هذه التحديات مجموعتنا إلى استكشاف طرق بديلة لدفع تفاعلات الهدرجة الكهروكيميائية5،6،7. نتج عن هذا البحث استخدام غشاء Pd ، والذي يستخدم تقليديا في فصل غاز الهيدروجين8. نستخدمه كقطب كهربائي للماء على جانب المفاعل الكهروكيميائي. يتيح هذا التطبيق الجديد لغشاء البلاديوم الفصل المادي لموقع أكسدة الماء الكهروكيميائية من موقع الهدرجة الكيميائية. يتكون تكوين المفاعل الناتج من جزأتين: 1) حجرة كهروكيميائية لإنتاج الهيدروجين. و 2) حجرة كيميائية للهدرجة (الشكل 1). يتم إنشاء البروتونات في المقصورة الكهروكيميائية عن طريق تطبيق جهد عبر أنود Pt وغشاء Pd ، والذي يعمل أيضا ككاثود. ثم تهاجر هذه البروتونات إلى غشاء Pd ، حيث يتم اختزالها إلى ذرات هيدروجين ممتزة على السطح. يمكن تقسيم الحجرة الكهروكيميائية لتشمل غشاء تبادل كاتيوني اختياري لتسهيل هجرة البروتون هذه. تتخلل ذرات الهيدروجين الممتصة سطحيا من خلال المواقع الثماني السطوح الخلالية لشبكة Pd fcc9 وتظهر على الوجه المقابل للغشاء في حجرة الهدرجة ، حيث تتفاعل مع الروابط غير المشبعة لمادة وسيطة معينة لتشكيل منتجات مهدرجة7،10،11،12،13،14،15،16. لذلك ، يعمل Pd في المفاعل الغشائي ك (i) غشاء انتقائي للهيدروجين ، (ii) كاثود ، و (iii) محفز للهدرجة.
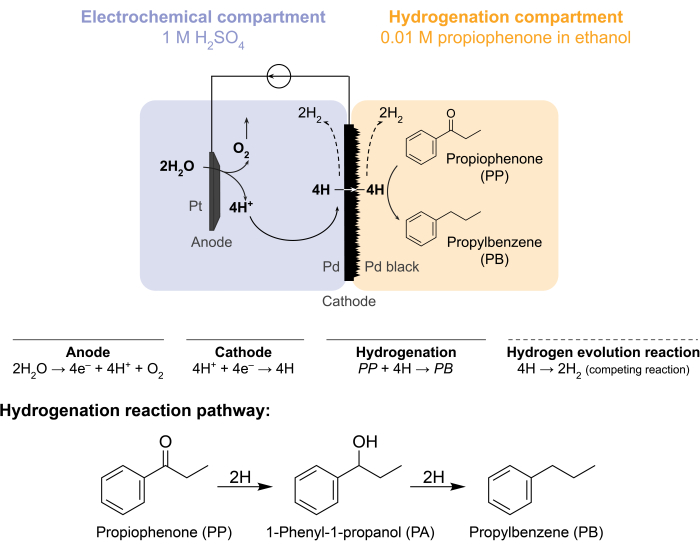
الشكل 1: إضافة الهيدروجين في مفاعل غشائي. أكسدة الماء عند الأنود تنتج البروتونات، والتي يتم اختزالها على كاثود البلاديوم. يتخلل H غشاء Pd ويتفاعل مع البروبيوفينون لتكوين بروبيل بنزين. تطور الهيدروجين هو تفاعل منافس يمكن أن يحدث على جانبي غشاء البلاديوم. بالنسبة لقياس الطيف الكتلي في الغلاف الجوي ، لا يتم استخدام مادة وسيطة كيميائية ، مما يستلزم مغادرة H للمفاعل في شكل غاز H2 في المقصورات الكهروكيميائية أو الهدرجة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
يتم تجميع المفاعل الغشائي عن طريق وضع غشاء Pd بين حجرات الأنود والكاثود للخلية الهيدروجينيةالكهروكيميائية 12. تستخدم الحلقات O المقاومة للمواد الكيميائية لتثبيت الغشاء في مكانه وضمان ختم خال من التسرب. تحتوي المقصورة الكهروكيميائية للمفاعل الغشائي على محلول مائي غني بالهيدروجين. في هذه الدراسة ، نستخدم 1 M H 2 SO4 وأنود يتكون من سلك Pt مغلف بقطعة 5 سم2من شبكة البلاتين. يتم غمر الأنود في محلول المنحل بالكهرباء من خلال ثقب في الجزء العلوي من المقصورة الكهروكيميائية. تحتوي حجرة الهدرجة الكيميائية على مادة وسيطة للمذيبات والهدرجة7،10،11،12،16،17. يتم استخدام الفتحة الموجودة في الجزء العلوي من حجرة الخلايا الهيدروجينية لأخذ العينات. تستخدم التجارب الموضحة هنا 0.01 M بروبيوفينون في الإيثانول كتغذية للهدرجة. ومع ذلك ، يمكن أن تختلف المواد الأولية (والتركيز) لتناسب الاحتياجات التجريبية. على سبيل المثال، يمكن إذابة مادة أولية تحتوي على سلسلة هيدروكربونية طويلة ومجموعة ألكاين وظيفية في البنتان لتحسين الذوبانية11. يمكن أن يكون التيار المؤثر للتفاعل بين 5 mA/cm2 و300 mA/cm2. تتم جميع ردود الفعل تحت درجة الحرارة والضغط المحيطين.
يستخدم قياس الطيف الكتلي الجوي (atm-MS) لقياس نسبة الهيدروجين في المقصورة الكهروكيميائية التي تتخلل حجرة الهدرجة11,12. هذا القياس مهم لفهم مدخلات الطاقة المطلوبة للمفاعل الغشائي ، لأنه يكشف عن أقصى استخدام ممكن للهيدروجين (أي مقدار الهيدروجين الذي يتم إنتاجه والذي يمكن استخدامه بالفعل في تفاعلات الهدرجة). يتم حساب تغلغل الهيدروجين من خلال غشاء Pd عن طريق قياس كمية H2 التي تتطور من كل من المقصورات الكهروكيميائية والهدرجة11,12. تعني قيمة التخلل بنسبة 100٪ أن كل الهيدروجين المنتج في المقصورة الكهروكيميائية يتم نقله عبر غشاء Pd إلى حجرة الهدرجة ثم يتحد لاحقا لتكوين غاز الهيدروجين. تعني قيمة التخلل البالغة <100٪ أن تطور الهيدروجين يحدث في المقصورة الكهروكيميائية قبل أن يتخلل الغشاء. نظرا لأن H2 يتم إنتاجه إما من حجرة الكهروكيميائية أو الهدرجة ، فإنه يدخل الجهاز ويتأين إلى H2+. يختار القطب الرباعي شظايا m / z = +2 ، ويتم قياس الشحنة المقابلة بواسطة الكاشف. المؤامرة التي تم الحصول عليها بواسطة هذه التقنية هي الشحنة الأيونية بمرور الوقت. يتم قياس الشحنة الأيونية لحجرة الهدرجة أولا ، وعندما تستقر الإشارة ، يتم تغيير القنوات لقياس المقصورة الكهروكيميائية. يتم حساب نفاذية الهيدروجين بقسمة متوسط الشحنة الأيونية في حجرة الهدرجة على إجمالي الشحنة الأيونية المقاسة في المفاعل (المعادلة 1)11,12. لحساب تغلغل الهيدروجين ، يتم قياس H2 من الهدرجة والمقصورات الكهروكيميائية بشكل منفصل باستخدام atm-MS.
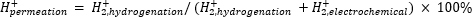 (مكافئ 1)
(مكافئ 1)
يستخدم قياس الطيف الكتلي اللوني للغاز (GC-MS) لمراقبة تقدم تفاعل الهدرجة12،14،15،16. لجمع البيانات على سبيل المثال ، تمتلئ حجرة الهدرجة في المفاعل ب 0.01 M بروبيوفينون في الإيثانول. من خلال تطبيق جهد عبر مصعد Pt ومهبط Pd ، يتم توفير الهيدروجين التفاعلي إلى حجرة الهدرجة. ثم تقوم ذرات الهيدروجين التفاعلية بهدرجة المواد الخام غير المشبعة ، ويتم قياس المنتجات باستخدام GC-MS ، حيث تكون العينة مجزأة ومتأينة. من خلال تحليل كتلة هذه الشظايا ، يمكن تحديد تكوين محلول الهدرجة ، ويمكن حساب معدلات التفاعل12،14،15،16.
Protocol
Representative Results
Discussion
يتيح غشاء Pd نفاذية الهيدروجين والهدرجة الكيميائية. لذلك ، فإن تحضير هذا الغشاء مهم لفعالية مفاعل الغشاء. يتم ضبط حجم غشاء Pd وعلم البلورات والسطح لتحسين النتائج التجريبية. على الرغم من أن معدن Pd يمكن أن يطور الهيدروجين بأي سمك ، إلا أن أغشية Pd يتم لفها إلى 25 ميكرومتر. يضمن هذا التوحيد القياس?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
نحن ممتنون للمجلس الكندي لأبحاث العلوم الطبيعية والهندسة (RGPIN-2018-06748) ، والمؤسسة الكندية للابتكار (229288) ، والمعهد الكندي للأبحاث المتقدمة (BSE-BERL-162173) ، وكراسي الأبحاث الكندية للدعم المالي. تم إجراء هذا البحث جزئيا بفضل التمويل المقدم من صندوق كندا الأول للتميز البحثي ، وبرنامج المواد الكمومية والتقنيات المستقبلية. نشكر بن هيرينج في مرفق الأدوات المشتركة في جامعة كولومبيا البريطانية للمساعدة في تطوير أداة GC-MS والطريقة. نشكر الدكتورة مونيكا ستولار على مساهماتها في تطوير وتحرير هذه المخطوطة. وأخيرا، نشكر مجموعة بيرلينغيت بأكملها في جامعة كولومبيا البريطانية على دعمها المستمر وتعاونها في دراسة المفاعل الغشائي.
Materials
| Ag/AgCl Reference Electrode | BASi research products | MW-2021 | Reference electrode |
| Analytical Balance | Cole-Parmer | RK-11219-03 | Instrument |
| Atmospheric Mass Spectrometer | ESS CatalySys | NA | Instrument |
| Bench Power Supply | Newark | 1550 | Instrument |
| Conductive Copper Foil Electrical Tape | McMaster Carr | 76555A711 | Electrochemical cell assembly |
| Dichloromethane | Sigma Aldrich | 270997 | Reagent |
| Electric Rolling Press with Dual Micrometer | MTI Corporation | MR100A | Equipment |
| Electrochemical glass H-cell | University of British Columbia glass blowing | NA | Electrochemical cell assembly |
| ESS catalysis QUADSTAR | ESS CatalySys | NA | Software |
| Ethanol | Sigma Aldrich | 493511 | Reagent |
| Flat Rolling Mill | Pepetolls | 18700A | Equipment |
| Gas Chromatography Mass Spectrometer | Agilent | NA | Instrument |
| GC-MS vial | Agilent | 5067-0205 | Vial for GC-MS |
| Hexanes | Sigma Aldrich | 1.0706 | Reagent |
| Hydrochloric Acid | Sigma Aldrich | 258148 | Reagent |
| Hydrogen peroxide solution (30% v/v) | Sigma Aldrich | H1009 | Reagent |
| Isopropyl Alcohol | Sigma Aldrich | W292907 | Reagent |
| Masshunter Aquisition Software | Agilent | G1617FA | Software |
| Micropipette (100 µL – 1000 µL) | Gilson | F123602 | instrument |
| Micropipette (20 µL – 200 µL) | Gilson | F123601 | Instrument |
| Mitutoyo Digital Micrometer | Uline | H-2780 | Instrument |
| Muffle Furnace | MTI Corporation | KSL-1100X | Equipment |
| Nitric acid | Sigma Aldrich | 438073 | Reagent |
| Nitrogen gas | Sigma Aldrich | 608661 | Reagent |
| Palladium (II) Chloride | Sigma Aldrich | 520659 | Reagent |
| Pd wafer bar, 1 oz, 99.95% | Silver Gold Bull. | NA | Reagent |
| Platinum Auxiliary Electrode | BASi research products | MW-1032 | Anode |
| Potentiostat | Metrohm | PGSTAT302N | Instrument |
| Propiophenone | Sigma Aldrich | P51605 | Reagent |
| Proton Exchange Membrane, Nafion 212 | Fuel cell store | NA | Electrochemical cell assembly |
| Sulfuric acid | Sigma Aldrich | 258105 | Reagent |
References
- Rytter, E., Hillestad, M., Austbø, B., Lamb, J. J., Sarker, S., Lamb, J. J., Pollet, B. G. Chapter six – Thermochemical production of fuels. Hydrogen, Biomass and Bioenergy. , 89-117 (2020).
- Arpe, H. -. J. . Industrial Organic Chemistry. , (2017).
- Orella, M. J., Román-Leshkov, Y., Brushett, F. R. Emerging opportunities for electrochemical processing to enable sustainable chemical manufacturing. Current Opinion in Chemical Engineering. 20, 159-167 (2018).
- May, A. S., Biddinger, E. J. Strategies to control electrochemical hydrogenation and hydrogenolysis of furfural and minimize undesired side reactions. ACS Catalysis. 10 (5), 3212-3221 (2020).
- Tang, B. Y., Bisbey, R. P., Lodaya, K. M., Toh, W. L., Surendranath, Y. Reaction environment impacts charge transfer but not chemical reaction steps in hydrogen evolution catalysis. ChemRxiv. , (2022).
- Iwakura, C., Yoshida, Y., Inoue, H. A new hydrogenation system of 4-methylstyrene using a palladinized palladium sheet electrode. Journal of Electroanalytical Chemistry. 431 (1), 43-45 (1997).
- Inoue, H., Abe, T., Iwakura, C. Successive hydrogenation of styrene at a palladium sheet electrode combined with electrochemical supply of hydrogen. Chemical Communications. , 55-56 (1996).
- Conde, J. J., Maroño, M., Sánchez-Hervás, J. M. Pd-based membranes for hydrogen separation: Review of alloying elements and their influence on membrane properties. Separation and Purification Reviews. 46 (2), 152-177 (2017).
- Wicke, E., Brodowsky, H., Züchner, H., Alefeld, G., VÖlkl, J. Hydrogen in palladium and palladium alloys. Hydrogen in Metals II. Topics in Applied Physics., edited by Alefeld, G., Völkl, J. 29, (1978).
- Sato, T., Sato, S., Itoh, N. Using a hydrogen-permeable palladium membrane electrode to produce hydrogen from water and hydrogenate toluene. International Journal Hydrogen Energy. 41 (12), 5419-5427 (2016).
- Sherbo, R. S., Delima, R. S., Chiykowski, V. A., MacLeod, B. P., Berlinguette, C. P. Complete electron economy by pairing electrolysis with hydrogenation. Nature Catalysis. 1, 501-507 (2018).
- Sherbo, R. S., Kurimoto, A., Brown, C. M., Berlinguette, C. P. Efficient electrocatalytic hydrogenation with a palladium membrane reactor. Journal of American Chemical Society. 141 (19), 7815-7821 (2019).
- Kurimoto, A., Sherbo, R. S., Cao, Y., Loo, N. W. X., Berlinguette, C. P. Electrolytic deuteration of unsaturated bonds without using D2. Nature Catalysis. 3, 719-726 (2020).
- Jansonius, R. P., et al. Hydrogenation without H2 using a palladium membrane flow cell. Cell Reports Physical Science. 1 (7), 100105 (2020).
- Huang, A., et al. Electrolysis can be used to resolve hydrogenation pathways at palladium surfaces in a membrane reactor. Journal of American Chemical Society Au. 1 (3), 336-343 (2021).
- Delima, R. S., et al. Selective hydrogenation of furfural using a membrane reactor. Energy and Environmental Science. 15 (1), 215-224 (2021).
- Sato, T., Takada, A., Itoh, N. Low-temperature hydrogenation of toluene by electrolysis of water with hydrogen permeable palladium membrane electrode. Chemistry Letters. 46 (4), 477-480 (2017).
- Maoka, T., Enyo, M. Overpotential decay transients and the reaction mechanism on the Pd-H2 electrode. Surface Technology. 8 (5), 441-450 (1979).
- Kurimoto, A., et al. Physical separation of H2 activation from hydrogenation chemistry reveals the specific role of secondary metal catalysts. Angewandte Chemie International Edition. 60 (21), 11937-11942 (2021).

