Wasserstofferzeugung und -nutzung in einem Membranreaktor
Summary
Membranreaktoren ermöglichen die Hydrierung unter Umgebungsbedingungen ohne direktenH2-Eintrag . Wir können die Wasserstofferzeugung und -nutzung in diesen Systemen mit Hilfe der atmosphärischen Massenspektrometrie (atm-MS) und der Gaschromatographie-Massenspektrometrie (GC-MS) verfolgen.
Abstract
Die industrielle Hydrierung verbraucht jährlich ~11 Mio. t fossilesH2-Gas . Unsere Gruppe hat einen Membranreaktor erfunden, um die Notwendigkeit zu umgehen,H2-Gas für die Hydrierchemie zu verwenden. Der Membranreaktor bezieht Wasserstoff aus Wasser und treibt Reaktionen mit erneuerbarem Strom an. In diesem Reaktor trennt ein dünnes Stück Pd einen elektrochemischen Wasserstoffproduktionsraum von einem chemischen Hydrierungsraum. Das Pd im Membranreaktor fungiert als (i) wasserstoffselektive Membran, (ii) als Kathode und (iii) als Katalysator für die Hydrierung. In dieser Arbeit berichten wir über den Einsatz der atmosphärischen Massenspektrometrie (atm-MS) und der Gaschromatographie-Massenspektrometrie (GC-MS), um zu zeigen, dass eine angewandte elektrochemische Vorspannung über eine Pd-Membran eine effiziente Hydrierung ohne direktenH2-Input in einem Membranreaktor ermöglicht. Mit atm-MS wurde eine Wasserstoffpermeation von 73% gemessen, was die Hydrierung von Propiophenon zu Propylbenzol mit 100% Selektivität ermöglichte, gemessen mittels GC-MS. Im Gegensatz zur konventionellen elektrochemischen Hydrierung, die sich auf geringe Konzentrationen des in einem protischen Elektrolyten gelösten Ausgangsmaterials beschränkt, ermöglicht die physikalische Trennung der Wasserstofferzeugung von der Nutzung im Membranreaktor eine Hydrierung in jedem Lösungsmittel und in jeder Konzentration. Die Verwendung hoher Konzentrationen und einer breiten Palette von Lösungsmitteln ist besonders wichtig für die Skalierbarkeit des Reaktors und die zukünftige Kommerzialisierung.
Introduction
Thermochemische Hydrierungsreaktionen werden in ~20% der gesamten chemischen Synthese verwendet1. Diese Reaktionen erfordern große Mengen anH2-Gas , das in der Regel aus fossilen Brennstoffen gewonnen wird, Temperaturen zwischen 150 °C und 600 °C und Drücke bis zu 200 atm2. Die elektrochemische Hydrierung ist eine attraktive Möglichkeit, diese Anforderungen zu umgehen und Hydrierreaktionen mit Wasser und erneuerbarem Strom voranzutreiben3. Bei der konventionellen elektrochemischen Hydrierung wird ein ungesättigter Rohstoff in einem protischen Elektrolyten in einer elektrochemischen Zelle gelöst. Wenn ein Potential an die Zelle angelegt wird, findet an der Anode eine Wasseroxidation statt, während an der Kathode die Hydrierung erfolgt. In diesem Reaktionsaufbau finden sowohl die elektrochemische Wasseroxidation als auch die chemische Hydrierung in der gleichen Reaktionsumgebung statt. Das organische Substrat wird in einem protischen Elektrolyten gelöst, um sowohl die elektrochemische Wasserspaltung als auch die Hydrierung des Ausgangsmaterials zu ermöglichen. Die Nähe dieser Reaktionen kann zur Bildung von Nebenprodukten und zur Verschmutzung der Elektroden führen, wenn der Reaktant für einen nukleophilen Angriff anfällig ist oder wenn die Reaktantenkonzentration zu hoch ist (>0,25 M)4.
Diese Herausforderungen veranlassten unsere Gruppe, alternative Wege zu erforschen, um Hydrierungsreaktionen elektrochemisch anzutreiben 5,6,7. Diese Suche ergab die Verwendung einer Pd-Membran, die herkömmlicherweise in der Wasserstoffgastrennung8 verwendet wird. Wir verwenden es als Elektrode für die Wasserelektrolyse auf der elektrochemischen Reaktorseite. Diese neuartige Anwendung einer Palladiummembran ermöglicht die physikalische Trennung des Ortes der elektrochemischen Wasseroxidation vom Ort der chemischen Hydrierung. Die resultierende Reaktorkonfiguration hat zwei Kompartimente: 1) einen elektrochemischen Kompartiment für die Wasserstoffproduktion; und 2) ein chemisches Kompartiment für die Hydrierung (Abbildung 1). Protonen werden im elektrochemischen Kompartiment erzeugt, indem ein Potential an die Pt-Anode und die Pd-Membran angelegt wird, die auch als Kathode dient. Diese Protonen wandern dann in die Pd-Membran, wo sie zu oberflächenadsorbierten Wasserstoffatomen reduziert werden. Das elektrochemische Kompartiment kann unterteilt werden, um eine optionale Kationenaustauschermembran einzuschließen, um diese Protonenmigration zu erleichtern. Die oberflächenadsorbierten Wasserstoffatome durchdringen die interstitiellen oktaedrischen Stellen des Pd-fcc-Gitters9 und treten auf der gegenüberliegenden Seite der Membran im Hydrierungskompartiment aus, wo sie mit den ungesättigten Bindungen eines gegebenen Ausgangsmaterials zu hydrierten Produkten 7,10,11,12,13,14,15,16 reagieren . Das Pd im Membranreaktor fungiert daher als (i) eine wasserstoffselektive Membran, (ii) eine Kathode und (iii) ein Katalysator für die Hydrierung.
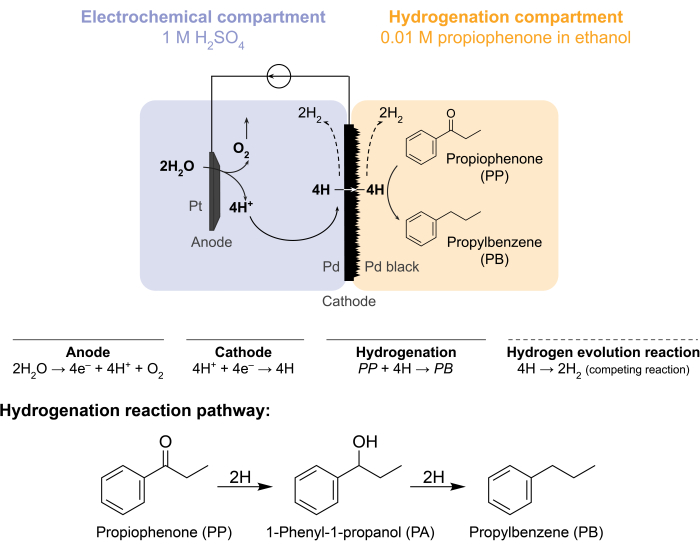
Abbildung 1: Hydrierung in einem Membranreaktor. Bei der Wasseroxidation an der Anode entstehen Protonen, die an der Palladiumkathode reduziert werden. H durchdringt die Pd-Membran und reagiert mit Propiophenon zu Propylbenzol. Die Wasserstoffentwicklung ist eine konkurrierende Reaktion, die auf beiden Seiten der Palladiummembran stattfinden kann. Für die atmosphärische Massenspektrometrie wird kein chemischer Rohstoff verwendet, so dass H den Reaktor in Form vonH2-Gas entweder in den elektrochemischen oder Hydrierungskammern verlassen muss. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Der Membranreaktor wird durch Einklemmen einer Pd-Membran zwischen das Anoden- und Kathodenkompartiment einer elektrochemischen H-Zelle12 zusammengebaut. Chemikalienbeständige O-Ringe werden verwendet, um die Membran zu befestigen und eine leckagefreie Abdichtung zu gewährleisten. Der elektrochemische Raum des Membranreaktors enthält eine wasserstoffreiche wässrige Lösung. In dieser Studie verwenden wir 1 M H 2 SO4 und eine Anode, die aus einem Pt-Draht besteht, der von einem 5 cm2Stück Platingewebe umhüllt ist. Die Anode wird durch ein Loch in der Oberseite des elektrochemischen Fachs in die Elektrolytlösung getaucht. Der chemische Hydrierungsraum enthält ein Lösungsmittel und einen Hydrierungsrohstoff 7,10,11,12,16,17. Das Loch an der Oberseite des H-Zell-Fachs dient der Probenahme. Die hier gezeigten Experimente verwenden 0,01 M Propiophenon in Ethanol als Hydrierungsfutter. Das Ausgangsmaterial (und die Konzentration) können jedoch variiert werden, um den experimentellen Anforderungen gerecht zu werden. Beispielsweise kann ein Ausgangsmaterial, das eine lange Kohlenwasserstoffkette und eine funktionelle Alkingruppe enthält, in Pentan gelöst werden, um die Löslichkeitzu verbessern 11. Der angelegte Strom für die Reaktion kann zwischen 5 mA/cm2 und 300 mA/cm2 liegen. Alle Reaktionen werden unter Umgebungstemperatur und -druck durchgeführt.
Die atmosphärische Massenspektrometrie (atm-MS) wird verwendet, um den prozentualen Anteil des Wasserstoffs im elektrochemischen Kompartiment zu messen, der in den Hydrierungsraum durchdringt11,12. Diese Messung ist wichtig, um den Energieaufwand für den Membranreaktor zu verstehen, denn sie gibt Aufschluss über die maximal mögliche Wasserstoffausnutzung (d.h. wie viel des produzierten Wasserstoffs tatsächlich für Hydrierreaktionen genutzt werden kann). Die Wasserstoffpermeation durch die Pd-Membran wird berechnet, indem die Menge an H2 gemessen wird, die sowohl aus dem elektrochemischen als auch aus dem Hydrierungskompartimententsteht 11,12. Ein Permeationswert von 100 % bedeutet, dass der gesamte im elektrochemischen Kompartiment erzeugte Wasserstoff durch die Pd-Membran in den Hydrierraum transportiert wird und sich anschließend zu Wasserstoffgas verbindet. Ein Permeationswert von <100 % bedeutet, dass die Wasserstoffentwicklung im elektrochemischen Kompartiment stattfindet, bevor er die Membran durchdringt. DaH2 entweder aus dem elektrochemischen oder dem Hydrierungsraum erzeugt wird, gelangt es in das Gerät und wird zuH2+ ionisiert. Der Quadrupol wählt Fragmente von m/z = +2 aus, und die entsprechende Ladung wird vom Detektor gemessen. Das Diagramm, das mit dieser Technik erhalten wird, ist die Ionenladung über die Zeit. Die Ionenladung wird zuerst für das Hydrierungskompartiment gemessen, und wenn sich das Signal stabilisiert, werden die Kanäle gewechselt, um das elektrochemische Kompartiment zu messen. Die Wasserstoffpermeation wird berechnet, indem die durchschnittliche Ionenladung im Hydrierungsraum durch die im Reaktor gemessene Gesamtionenladung dividiert wird (Gleichung 1)11,12. Zur Berechnung der Wasserstoffpermeation werdenH2 aus dem Hydrierungs- und dem elektrochemischen Kompartiment separat mittels atm-MS gemessen.
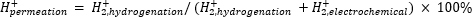 (Gl. 1)
(Gl. 1)
Die Gaschromatographie-Massenspektrometrie (GC-MS) wird verwendet, um den Fortschritt der Hydrierungsreaktionzu überwachen 12,14,15,16. Um Daten für das Beispiel zu sammeln, wird der Hydrierungsraum des Reaktors mit 0,01 M Propiophenon in Ethanol gefüllt. Durch Anlegen eines Potentials an die Pt-Anode und die Pd-Kathode wird dem Hydrierungsraum reaktiver Wasserstoff zugeführt. Die reaktiven Wasserstoffatome hydrieren dann den ungesättigten Rohstoff, und die Produkte werden mit GC-MS quantifiziert, wobei die Probe fragmentiert und ionisiert wird. Durch die Analyse der Masse dieser Fragmente kann die Zusammensetzung der Hydrierlösung bestimmt und Reaktionsgeschwindigkeiten berechnet werden12,14,15,16.
Protocol
Representative Results
Discussion
Die Pd-Membran ermöglicht Wasserstoffpermeation und chemische Hydrierung. Die Herstellung dieser Membran ist daher wichtig für die Wirksamkeit des Membranreaktors. Die Größe der Pd-Membran, die Kristallographie und die Oberfläche werden abgestimmt, um die experimentellen Ergebnisse zu verbessern. Obwohl Pd-Metall in jeder Dicke Wasserstoff entwickeln kann, werden die Pd-Membranen auf 25 μm gewalzt. Diese Standardisierung der Membrandicke stellt sicher, dass die Zeit, die Wasserstoff benötigt, um die Membran zu dur…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Wir danken dem Canadian Natural Sciences and Engineering Research Council (RGPIN-2018-06748), der Canadian Foundation for Innovation (229288), dem Canadian Institute for Advanced Research (BSE-BERL-162173) und den Canada Research Chairs für die finanzielle Unterstützung. Diese Forschung wurde zum Teil dank der Finanzierung durch den Canada First Research Excellence Fund, das Quantum Materials and Future Technologies Program durchgeführt. Wir danken Ben Herring von der UBC Shared Instrument Facility für die Unterstützung bei der Entwicklung des GC-MS-Instruments und der Methode. Wir danken Dr. Monika Stolar für ihre Beiträge zur Entwicklung und Edition dieses Manuskripts. Abschließend danken wir der gesamten Berlinguette-Gruppe an der University of British Columbia für ihre anhaltende Unterstützung und Zusammenarbeit bei der Untersuchung des Membranreaktors.
Materials
| Ag/AgCl Reference Electrode | BASi research products | MW-2021 | Reference electrode |
| Analytical Balance | Cole-Parmer | RK-11219-03 | Instrument |
| Atmospheric Mass Spectrometer | ESS CatalySys | NA | Instrument |
| Bench Power Supply | Newark | 1550 | Instrument |
| Conductive Copper Foil Electrical Tape | McMaster Carr | 76555A711 | Electrochemical cell assembly |
| Dichloromethane | Sigma Aldrich | 270997 | Reagent |
| Electric Rolling Press with Dual Micrometer | MTI Corporation | MR100A | Equipment |
| Electrochemical glass H-cell | University of British Columbia glass blowing | NA | Electrochemical cell assembly |
| ESS catalysis QUADSTAR | ESS CatalySys | NA | Software |
| Ethanol | Sigma Aldrich | 493511 | Reagent |
| Flat Rolling Mill | Pepetolls | 18700A | Equipment |
| Gas Chromatography Mass Spectrometer | Agilent | NA | Instrument |
| GC-MS vial | Agilent | 5067-0205 | Vial for GC-MS |
| Hexanes | Sigma Aldrich | 1.0706 | Reagent |
| Hydrochloric Acid | Sigma Aldrich | 258148 | Reagent |
| Hydrogen peroxide solution (30% v/v) | Sigma Aldrich | H1009 | Reagent |
| Isopropyl Alcohol | Sigma Aldrich | W292907 | Reagent |
| Masshunter Aquisition Software | Agilent | G1617FA | Software |
| Micropipette (100 µL – 1000 µL) | Gilson | F123602 | instrument |
| Micropipette (20 µL – 200 µL) | Gilson | F123601 | Instrument |
| Mitutoyo Digital Micrometer | Uline | H-2780 | Instrument |
| Muffle Furnace | MTI Corporation | KSL-1100X | Equipment |
| Nitric acid | Sigma Aldrich | 438073 | Reagent |
| Nitrogen gas | Sigma Aldrich | 608661 | Reagent |
| Palladium (II) Chloride | Sigma Aldrich | 520659 | Reagent |
| Pd wafer bar, 1 oz, 99.95% | Silver Gold Bull. | NA | Reagent |
| Platinum Auxiliary Electrode | BASi research products | MW-1032 | Anode |
| Potentiostat | Metrohm | PGSTAT302N | Instrument |
| Propiophenone | Sigma Aldrich | P51605 | Reagent |
| Proton Exchange Membrane, Nafion 212 | Fuel cell store | NA | Electrochemical cell assembly |
| Sulfuric acid | Sigma Aldrich | 258105 | Reagent |
References
- Rytter, E., Hillestad, M., Austbø, B., Lamb, J. J., Sarker, S., Lamb, J. J., Pollet, B. G. Chapter six – Thermochemical production of fuels. Hydrogen, Biomass and Bioenergy. , 89-117 (2020).
- Arpe, H. -. J. . Industrial Organic Chemistry. , (2017).
- Orella, M. J., Román-Leshkov, Y., Brushett, F. R. Emerging opportunities for electrochemical processing to enable sustainable chemical manufacturing. Current Opinion in Chemical Engineering. 20, 159-167 (2018).
- May, A. S., Biddinger, E. J. Strategies to control electrochemical hydrogenation and hydrogenolysis of furfural and minimize undesired side reactions. ACS Catalysis. 10 (5), 3212-3221 (2020).
- Tang, B. Y., Bisbey, R. P., Lodaya, K. M., Toh, W. L., Surendranath, Y. Reaction environment impacts charge transfer but not chemical reaction steps in hydrogen evolution catalysis. ChemRxiv. , (2022).
- Iwakura, C., Yoshida, Y., Inoue, H. A new hydrogenation system of 4-methylstyrene using a palladinized palladium sheet electrode. Journal of Electroanalytical Chemistry. 431 (1), 43-45 (1997).
- Inoue, H., Abe, T., Iwakura, C. Successive hydrogenation of styrene at a palladium sheet electrode combined with electrochemical supply of hydrogen. Chemical Communications. , 55-56 (1996).
- Conde, J. J., Maroño, M., Sánchez-Hervás, J. M. Pd-based membranes for hydrogen separation: Review of alloying elements and their influence on membrane properties. Separation and Purification Reviews. 46 (2), 152-177 (2017).
- Wicke, E., Brodowsky, H., Züchner, H., Alefeld, G., VÖlkl, J. Hydrogen in palladium and palladium alloys. Hydrogen in Metals II. Topics in Applied Physics., edited by Alefeld, G., Völkl, J. 29, (1978).
- Sato, T., Sato, S., Itoh, N. Using a hydrogen-permeable palladium membrane electrode to produce hydrogen from water and hydrogenate toluene. International Journal Hydrogen Energy. 41 (12), 5419-5427 (2016).
- Sherbo, R. S., Delima, R. S., Chiykowski, V. A., MacLeod, B. P., Berlinguette, C. P. Complete electron economy by pairing electrolysis with hydrogenation. Nature Catalysis. 1, 501-507 (2018).
- Sherbo, R. S., Kurimoto, A., Brown, C. M., Berlinguette, C. P. Efficient electrocatalytic hydrogenation with a palladium membrane reactor. Journal of American Chemical Society. 141 (19), 7815-7821 (2019).
- Kurimoto, A., Sherbo, R. S., Cao, Y., Loo, N. W. X., Berlinguette, C. P. Electrolytic deuteration of unsaturated bonds without using D2. Nature Catalysis. 3, 719-726 (2020).
- Jansonius, R. P., et al. Hydrogenation without H2 using a palladium membrane flow cell. Cell Reports Physical Science. 1 (7), 100105 (2020).
- Huang, A., et al. Electrolysis can be used to resolve hydrogenation pathways at palladium surfaces in a membrane reactor. Journal of American Chemical Society Au. 1 (3), 336-343 (2021).
- Delima, R. S., et al. Selective hydrogenation of furfural using a membrane reactor. Energy and Environmental Science. 15 (1), 215-224 (2021).
- Sato, T., Takada, A., Itoh, N. Low-temperature hydrogenation of toluene by electrolysis of water with hydrogen permeable palladium membrane electrode. Chemistry Letters. 46 (4), 477-480 (2017).
- Maoka, T., Enyo, M. Overpotential decay transients and the reaction mechanism on the Pd-H2 electrode. Surface Technology. 8 (5), 441-450 (1979).
- Kurimoto, A., et al. Physical separation of H2 activation from hydrogenation chemistry reveals the specific role of secondary metal catalysts. Angewandte Chemie International Edition. 60 (21), 11937-11942 (2021).

