Producción y utilización de hidrógeno en un reactor de membrana
Summary
Los reactores de membrana permiten la hidrogenación en condiciones ambientales sin entrada directa deH2 . Podemos rastrear la producción y utilización de hidrógeno en estos sistemas utilizando espectrometría de masas atmosférica (atm-MS) y espectrometría de masas por cromatografía de gases (GC-MS).
Abstract
La hidrogenación industrial consume ~ 11 Mt de gas H2 derivado de fósiles anualmente. Nuestro grupo inventó un reactor de membrana para evitar la necesidad de utilizar gasH2 para la química de hidrogenación. El reactor de membrana obtiene hidrógeno del agua e impulsa reacciones utilizando electricidad renovable. En este reactor, una pieza delgada de Pd separa un compartimiento de producción de hidrógeno electroquímico de un compartimiento de hidrogenación química. El Pd en el reactor de membrana actúa como (i) una membrana selectiva de hidrógeno, (ii) un cátodo y (iii) un catalizador para la hidrogenación. En este documento, informamos el uso de espectrometría de masas atmosférica (atm-MS) y espectrometría de masas por cromatografía de gases (GC-MS) para demostrar que un sesgo electroquímico aplicado a través de una membrana de Pd permite una hidrogenación eficiente sin entrada directa deH2 en un reactor de membrana. Con atm-MS, medimos una permeación de hidrógeno del 73%, lo que permitió la hidrogenación de propiofenona a propilbenceno con 100% de selectividad, según lo medido por GC-MS. A diferencia de la hidrogenación electroquímica convencional, que se limita a bajas concentraciones de material de partida disuelto en un electrolito prótico, la separación física de la producción de hidrógeno de la utilización en el reactor de membrana permite la hidrogenación en cualquier disolvente o en cualquier concentración. El uso de altas concentraciones y una amplia gama de disolventes es particularmente importante para la escalabilidad del reactor y la futura comercialización.
Introduction
Las reacciones termoquímicas de hidrogenación se utilizan en ~20% de toda la síntesis química1. Estas reacciones requieren grandes cantidades de gasH2 , que generalmente se derivan de combustibles fósiles, temperaturas entre 150 °C y 600 °C, y presiones de hasta 200 atm2. La hidrogenación electroquímica es una forma atractiva de eludir estos requisitos e impulsar reacciones de hidrogenación utilizando agua y electricidad renovable3. Para la hidrogenación electroquímica convencional, una materia prima insaturada se disuelve en un electrolito prótico en una celda electroquímica. Cuando se aplica un potencial a la célula, la oxidación del agua ocurre en el ánodo, mientras que la hidrogenación ocurre en el cátodo. En esta configuración de reacción, tanto la oxidación electroquímica del agua como la hidrogenación química ocurren en el mismo entorno de reacción. El sustrato orgánico se disuelve en un electrolito prótico para permitir tanto la división electroquímica del agua como la hidrogenación de la materia prima. La proximidad de estas reacciones puede conducir a la formación de subproductos y al ensuciamiento del electrodo cuando el reactivo es susceptible al ataque nucleofílico o si la concentración del reactivo es demasiado alta (>0,25 M)4.
Estos desafíos llevaron a nuestro grupo a explorar formas alternativas de conducir electroquímicamente las reacciones de hidrogenación 5,6,7. Esta búsqueda resultó en el uso de una membrana de Pd, que se utiliza convencionalmente en la separación de gas hidrógeno8. Lo usamos como electrodo para la electrólisis del agua en el lado del reactor electroquímico. Esta novedosa aplicación de una membrana de paladio permite la separación física del sitio de oxidación electroquímica del agua del sitio de hidrogenación química. La configuración del reactor resultante tiene dos compartimentos: 1) un compartimento electroquímico para la producción de hidrógeno; y 2) un compartimento químico para hidrogenación (Figura 1). Los protones se generan en el compartimiento electroquímico aplicando un potencial a través del ánodo de Pt y la membrana de Pd, que también sirve como cátodo. Estos protones luego migran a la membrana de Pd, donde se reducen a átomos de hidrógeno adsorbidos en la superficie. El compartimento electroquímico se puede subdividir para incluir una membrana de intercambio catiónico opcional para facilitar esta migración de protones. Los átomos de hidrógeno adsorbidos en superficie penetran a través de los sitios octaédricos intersticiales de la red 9 de Pdfcc y emergen en la cara opuesta de la membrana en el compartimiento de hidrogenación, donde reaccionan con los enlaces insaturados de una materia prima dada para formar productos hidrogenados 7,10,11,12,13,14,15,16. El Pd en el reactor de membrana, por lo tanto, actúa como (i) una membrana selectiva de hidrógeno, (ii) un cátodo y (iii) un catalizador para la hidrogenación.
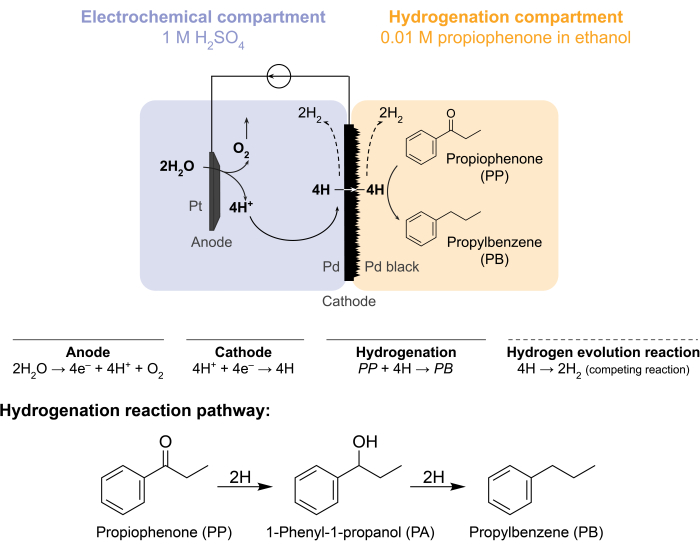
Figura 1: Hidrogenación en un reactor de membrana. La oxidación del agua en el ánodo produce protones, que se reducen en el cátodo de paladio. El H penetra a través de la membrana de Pd y reacciona con propiofenona para formar propilbenceno. La evolución del hidrógeno es una reacción competitiva que puede ocurrir a ambos lados de la membrana de paladio. Para la espectrometría de masas atmosférica, no se utiliza materia prima química, lo que requiere que H abandone el reactor en forma de gasH2 en los compartimentos electroquímicos o de hidrogenación. Haga clic aquí para ver una versión más grande de esta figura.
El reactor de membrana se ensambla intercalando una membrana de Pd entre los compartimentos de ánodo y cátodo de una celda H electroquímica12. Las juntas tóricas resistentes a los productos químicos se utilizan para asegurar la membrana en su lugar y garantizar un sello sin fugas. El compartimiento electroquímico del reactor de membrana contiene una solución acuosa rica en hidrógeno. En este estudio, utilizamos 1 M H 2SO4 y un ánodo que consiste en un alambre de Pt envuelto en una pieza de 5 cm2de malla de platino. El ánodo se sumerge en la solución electrolítica a través de un orificio en la parte superior del compartimiento electroquímico. El compartimento de hidrogenación química contiene un disolvente y una materia prima de hidrogenación 7,10,11,12,16,17. El orificio en la parte superior del compartimiento de células H se utiliza para el muestreo. Los experimentos que se muestran aquí utilizan 0,01 M propiofenona en etanol como alimento de hidrogenación. Sin embargo, el material de partida (y la concentración) se pueden variar para adaptarse a las necesidades experimentales. Por ejemplo, un material de partida que contiene una larga cadena de hidrocarburos y un grupo funcional alquino puede disolverse en pentano para mejorar la solubilidad11. La corriente aplicada para la reacción puede estar entre 5 mA/cm 2 y 300 mA/cm2. Todas las reacciones se llevan a cabo a temperatura y presión ambiente.
La espectrometría de masas atmosférica (ATM-MS) se utiliza para medir el porcentaje de hidrógeno en el compartimiento electroquímico que penetra en el compartimento de hidrogenación11,12. Esta medición es importante para comprender las entradas de energía requeridas para el reactor de membrana, ya que revela la máxima utilización posible de hidrógeno (es decir, cuánto del hidrógeno que se produce se puede usar realmente para reacciones de hidrogenación). La permeación de hidrógeno a través de la membrana de Pd se calcula midiendo la cantidad de H2 que evoluciona desde los compartimentos electroquímico e hidrogenado11,12. Un valor de permeación del 100% significa que todo el hidrógeno producido en el compartimiento electroquímico se transporta a través de la membrana de Pd al compartimiento de hidrogenación y luego se combina para formar gas hidrógeno. Un valor de permeación de <100% significa que la evolución del hidrógeno ocurre en el compartimiento electroquímico antes de penetrar a través de la membrana. Como elH2 se produce desde el compartimiento electroquímico o de hidrogenación, entra en el instrumento y se ioniza a H2+. El cuadrupolo selecciona fragmentos de m/z = +2, y la carga correspondiente es medida por el detector. La gráfica obtenida por esta técnica es la carga iónica a lo largo del tiempo. La carga iónica se mide primero para el compartimiento de hidrogenación, y cuando la señal se estabiliza, los canales se cambian para medir el compartimiento electroquímico. La permeación de hidrógeno se calcula dividiendo la carga iónica media en el compartimento de hidrogenación por la carga iónica total medida en el reactor (Ecuación 1)11,12. Para calcular la permeación de hidrógeno, elH2 de los compartimentos de hidrogenación y electroquímica se mide por separado utilizando atm-MS.
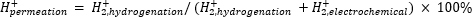 (Ec. 1)
(Ec. 1)
La espectrometría de masas por cromatografía de gases (GC-MS) se utiliza para monitorear el progreso de la reacción de hidrogenación12,14,15,16. Para recopilar datos para el ejemplo, el compartimiento de hidrogenación del reactor se llena con propiofenona 0.01 M en etanol. Al aplicar un potencial a través del ánodo de Pt y el cátodo de Pd, se suministra hidrógeno reactivo al compartimiento de hidrogenación. Los átomos de hidrógeno reactivos luego hidrogenan la materia prima insaturada, y los productos se cuantifican utilizando GC-MS, donde la muestra se fragmenta e ioniza. Al analizar la masa de estos fragmentos, se puede determinar la composición de la solución de hidrogenación y se pueden calcular las velocidades de reacción12,14,15,16.
Protocol
Representative Results
Discussion
La membrana de Pd permite la permeación de hidrógeno y la hidrogenación química. La preparación de esta membrana es, por lo tanto, importante para la eficacia del reactor de membrana. El tamaño de la membrana de Pd, la cristalografía y la superficie se ajustan para mejorar los resultados experimentales. Aunque el metal Pd puede desarrollar hidrógeno en cualquier espesor, las membranas de Pd se enrollan a 25 μm. Esta estandarización del espesor de la membrana asegura que el tiempo que tarda el hidrógeno en pene…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Agradecemos al Consejo Canadiense de Investigación de Ciencias Naturales e Ingeniería (RGPIN-2018-06748), la Fundación Canadiense para la Innovación (229288), el Instituto Canadiense de Investigación Avanzada (BSE-BERL-162173) y las Cátedras de Investigación de Canadá por su apoyo financiero. Esta investigación se llevó a cabo gracias en parte a la financiación del Canada First Research Excellence Fund, Quantum Materials and Future Technologies Program. Agradecemos a Ben Herring en el UBC Shared Instrument Facility por su ayuda con el desarrollo del instrumento y el método GC-MS. Monika Stolar por sus contribuciones al desarrollo y edición de este manuscrito. Finalmente, agradecemos a todo el Grupo Berlinguette de la Universidad de Columbia Británica por su continuo apoyo y colaboración en el estudio del reactor de membrana.
Materials
| Ag/AgCl Reference Electrode | BASi research products | MW-2021 | Reference electrode |
| Analytical Balance | Cole-Parmer | RK-11219-03 | Instrument |
| Atmospheric Mass Spectrometer | ESS CatalySys | NA | Instrument |
| Bench Power Supply | Newark | 1550 | Instrument |
| Conductive Copper Foil Electrical Tape | McMaster Carr | 76555A711 | Electrochemical cell assembly |
| Dichloromethane | Sigma Aldrich | 270997 | Reagent |
| Electric Rolling Press with Dual Micrometer | MTI Corporation | MR100A | Equipment |
| Electrochemical glass H-cell | University of British Columbia glass blowing | NA | Electrochemical cell assembly |
| ESS catalysis QUADSTAR | ESS CatalySys | NA | Software |
| Ethanol | Sigma Aldrich | 493511 | Reagent |
| Flat Rolling Mill | Pepetolls | 18700A | Equipment |
| Gas Chromatography Mass Spectrometer | Agilent | NA | Instrument |
| GC-MS vial | Agilent | 5067-0205 | Vial for GC-MS |
| Hexanes | Sigma Aldrich | 1.0706 | Reagent |
| Hydrochloric Acid | Sigma Aldrich | 258148 | Reagent |
| Hydrogen peroxide solution (30% v/v) | Sigma Aldrich | H1009 | Reagent |
| Isopropyl Alcohol | Sigma Aldrich | W292907 | Reagent |
| Masshunter Aquisition Software | Agilent | G1617FA | Software |
| Micropipette (100 µL – 1000 µL) | Gilson | F123602 | instrument |
| Micropipette (20 µL – 200 µL) | Gilson | F123601 | Instrument |
| Mitutoyo Digital Micrometer | Uline | H-2780 | Instrument |
| Muffle Furnace | MTI Corporation | KSL-1100X | Equipment |
| Nitric acid | Sigma Aldrich | 438073 | Reagent |
| Nitrogen gas | Sigma Aldrich | 608661 | Reagent |
| Palladium (II) Chloride | Sigma Aldrich | 520659 | Reagent |
| Pd wafer bar, 1 oz, 99.95% | Silver Gold Bull. | NA | Reagent |
| Platinum Auxiliary Electrode | BASi research products | MW-1032 | Anode |
| Potentiostat | Metrohm | PGSTAT302N | Instrument |
| Propiophenone | Sigma Aldrich | P51605 | Reagent |
| Proton Exchange Membrane, Nafion 212 | Fuel cell store | NA | Electrochemical cell assembly |
| Sulfuric acid | Sigma Aldrich | 258105 | Reagent |
References
- Rytter, E., Hillestad, M., Austbø, B., Lamb, J. J., Sarker, S., Lamb, J. J., Pollet, B. G. Chapter six – Thermochemical production of fuels. Hydrogen, Biomass and Bioenergy. , 89-117 (2020).
- Arpe, H. -. J. . Industrial Organic Chemistry. , (2017).
- Orella, M. J., Román-Leshkov, Y., Brushett, F. R. Emerging opportunities for electrochemical processing to enable sustainable chemical manufacturing. Current Opinion in Chemical Engineering. 20, 159-167 (2018).
- May, A. S., Biddinger, E. J. Strategies to control electrochemical hydrogenation and hydrogenolysis of furfural and minimize undesired side reactions. ACS Catalysis. 10 (5), 3212-3221 (2020).
- Tang, B. Y., Bisbey, R. P., Lodaya, K. M., Toh, W. L., Surendranath, Y. Reaction environment impacts charge transfer but not chemical reaction steps in hydrogen evolution catalysis. ChemRxiv. , (2022).
- Iwakura, C., Yoshida, Y., Inoue, H. A new hydrogenation system of 4-methylstyrene using a palladinized palladium sheet electrode. Journal of Electroanalytical Chemistry. 431 (1), 43-45 (1997).
- Inoue, H., Abe, T., Iwakura, C. Successive hydrogenation of styrene at a palladium sheet electrode combined with electrochemical supply of hydrogen. Chemical Communications. , 55-56 (1996).
- Conde, J. J., Maroño, M., Sánchez-Hervás, J. M. Pd-based membranes for hydrogen separation: Review of alloying elements and their influence on membrane properties. Separation and Purification Reviews. 46 (2), 152-177 (2017).
- Wicke, E., Brodowsky, H., Züchner, H., Alefeld, G., VÖlkl, J. Hydrogen in palladium and palladium alloys. Hydrogen in Metals II. Topics in Applied Physics., edited by Alefeld, G., Völkl, J. 29, (1978).
- Sato, T., Sato, S., Itoh, N. Using a hydrogen-permeable palladium membrane electrode to produce hydrogen from water and hydrogenate toluene. International Journal Hydrogen Energy. 41 (12), 5419-5427 (2016).
- Sherbo, R. S., Delima, R. S., Chiykowski, V. A., MacLeod, B. P., Berlinguette, C. P. Complete electron economy by pairing electrolysis with hydrogenation. Nature Catalysis. 1, 501-507 (2018).
- Sherbo, R. S., Kurimoto, A., Brown, C. M., Berlinguette, C. P. Efficient electrocatalytic hydrogenation with a palladium membrane reactor. Journal of American Chemical Society. 141 (19), 7815-7821 (2019).
- Kurimoto, A., Sherbo, R. S., Cao, Y., Loo, N. W. X., Berlinguette, C. P. Electrolytic deuteration of unsaturated bonds without using D2. Nature Catalysis. 3, 719-726 (2020).
- Jansonius, R. P., et al. Hydrogenation without H2 using a palladium membrane flow cell. Cell Reports Physical Science. 1 (7), 100105 (2020).
- Huang, A., et al. Electrolysis can be used to resolve hydrogenation pathways at palladium surfaces in a membrane reactor. Journal of American Chemical Society Au. 1 (3), 336-343 (2021).
- Delima, R. S., et al. Selective hydrogenation of furfural using a membrane reactor. Energy and Environmental Science. 15 (1), 215-224 (2021).
- Sato, T., Takada, A., Itoh, N. Low-temperature hydrogenation of toluene by electrolysis of water with hydrogen permeable palladium membrane electrode. Chemistry Letters. 46 (4), 477-480 (2017).
- Maoka, T., Enyo, M. Overpotential decay transients and the reaction mechanism on the Pd-H2 electrode. Surface Technology. 8 (5), 441-450 (1979).
- Kurimoto, A., et al. Physical separation of H2 activation from hydrogenation chemistry reveals the specific role of secondary metal catalysts. Angewandte Chemie International Edition. 60 (21), 11937-11942 (2021).

