<em> Xenopus</em> Ооцитов Cut открыть Вазелин Gap Напряжение-зажим Техника С флуорометрии
Summary
Подход Вазелин разрыв отключения открытым используется для получения низких шумовых записи ионных и стробирования токов от потенциал-зависимых ионных каналов, выраженных в Xenopus ооциты с высоким разрешением быстрой кинетики канала. С небольшим изменением, зажим напряжение флюометрия может быть соединен с протоколом ооцитов вырезом открыт.
Abstract
Ооцит Вазелин разрыв отключение открытой (CoVG) техника зажим напряжения позволяет для анализа электрофизиологических и кинетических свойств гетерологичных ионных каналов в ооцитов. Записи от установки бортового открытым особенно полезны для решения малых токов величина литниковые, быстрого ионной активации текущий и дезактивацию. Основные преимущества над двухэлектродной зажима напряжения (TEVC) техники включают повышенную скорость зажим, улучшение соотношения сигнал-шум, и способность модулировать внутриклеточной и внеклеточной среде.
Здесь мы используем человеческий канал сердечная натрия (HNA V 1.5), выраженную в Xenopus ооцитах, чтобы продемонстрировать настройку бортового открытым и протокол, а также изменения, которые необходимы, чтобы добавить зажим напряжение возможность флуорометрии.
Свойства быстрых активирующих ионных каналов, таких как HNA V 1,5, не могут быть полностью решены около комнатной температуре с использованием TEVC, в whicч полнота ооцита мембраны зажимается, что делает контроль напряжения трудно. Однако, в технике вырезом открыт, выделение только небольшой части клеточной мембраны позволяет быстро зажима, необходимого, чтобы точно записать быструю кинетику, предотвращая канала краткое изложение, связанное с методами патч зажима.
В сочетании с техникой CoVG, ионных каналов кинетики и электрофизиологические свойства могут быть дополнительно анализировали с помощью напряжения зажим флуорометрии, где движение белок отслеживается с помощью цистеина конъюгации внеклеточно, применяемых флуорофоров, вставка генетически кодируемых флуоресцирующих белков, или включения неприродных аминокислот в интересующей области 1. Это дополнительные данные дает кинетическую информацию о потенциал-зависимых конформационных перестроек белка через изменения в микросреды, окружающей флуоресцентные молекулы.
Introduction
Специализированный методы напряжение зажимные разрешить запись ионных токов при контролируемых мембранных потенциалов. Широко используется двухэлектродной зажим напряжения (TEVC) и методы патч зажим обеспечивают надежную электрофизиологические информацию о свойствах многих ионных каналов. Тем не менее, оба этих метода имеют свои недостатки, которые препятствуют приобретению надежных данных для быстрых напряжения натриевых каналов и других каналов быстро активирующих в мембранах, таких как те, из Xenopus ооциты. В Безания и Стефани лаборатории следовательно разработана методика Вазелин разрыв зажим напряжения бортового открытым (CoVG) для ооцитов 2. Методика была широко применяться для записи, Na +, K + и Ca 2 + каналов 3-8.
Во время записи CoVG, гетерологичный белок, экспрессирующих ооцитов мембрана состоит из трех областей. Ионный ток данные записываются с верхней области ооцита какванна, окружающий верхнюю область крепится к командной потенциалом, который может быть легко и быстро изменить. Средней области защищает от токов утечки, будучи прикрепленными к тем же потенциалом, верхней области 9. В нижней области, где отверстие ооцитов (вырезать открыт) происходит с использованием раствора сапонина или канюли. Химические или ручное открывание мембраны в донной области позволяет управлять внутреннего потенциала, который крепится к земле, и оказывает внутрь клетки прилегает к нижней камере раствора. Перфузии решений в нижнюю камеру можно настроить свойства внутренней среды, в то время как обмен решение в верхней камере изменяет внешний антураж. 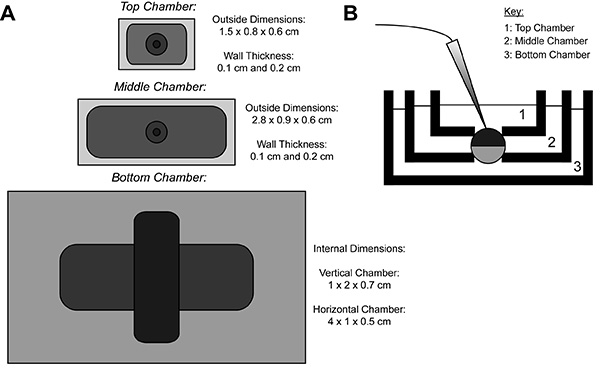
Рисунок 1. Ооцитов Cut-Открыть Напряжение-зажим Ванна Схема установки. () ТопВвиду вниз из трех ванн, разделенных друг от друга. Размеры камер для CoVG отображаются на рисунке. (B) Вид сбоку установки ванны в положении тестирования. Нажмите здесь, чтобы увеличить изображение .
Преимущества метода CoVG включают низкую текущую шум (1 нА при 3 кГц), контроль ионного состава внешней среды, в способности модулировать внутренний СМИ, разрешение быстро времени (20-100 мкс постоянная времени распада Емкость переходные), и стабильные записи в течение нескольких часов 9. К недостаткам можно отнести, что он требует специального оборудования и труднее выполнять по сравнению с двумя напряжения на электродах зажима (TEVC) 10.
В то время как подход CoVG требует высокой специализированное оборудование и сложные процедурные элементы, он может позволить для приобретения Valuспособные электрофизиологические данные. Эти данные, такие как стробирования токов с быстрой кинетики и хвостовые токи 4, могут быть записаны без некоторых проблем, связанных с другими протоколами напряжение зажима включая канала кратком изложении. Незначительные изменения в настройки CoVG может позволить для использования регуляторов температуры и зажим напряжение флуорометрии (VCF). Включение напряжения зажим элементов флуорометрии в сборке CoVG может увеличить выход данных присвоением способность контролировать белка конформационные изменения, одновременно записывая текущее 11-13.
Protocol
Representative Results
Discussion
Ооцит Вазелин техника напряжение на промежутке зажим отключение открытой позволяет быстро разрешения данных, низкий уровень шума, возможность постоянного контроля за внутренним решением и внешнего состава раствора, и стабильные записи над относительно длинных протоколов 19. Эт…
Declarações
The authors have nothing to disclose.
Acknowledgements
Все члены Вашингтонского университета в Сент-Луисе Сердечная молекулярной инженерии Lab. Берроуз Здравствуйте фонд Карьера премии в Научно-интерфейс – 1010299 (с JS).
Materials
| External Solution | Brand | Catalog Number | [Final], weight, or volume |
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 25mM |
| MES Sodium Salt | Sigma-Aldrich | M5057 | 90mM |
| HEPES | Research Products International | H75030 | 20mM |
| Calcium hydroxide | Sigma-Aldrich | 239232 | 2mM |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Internal Solution | |||
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 105mM |
| MES Sodium Salt | Sigma-Aldrich | M5057 | 10mM |
| HEPES | Research Products International | H75030 | 20mM |
| Ethylene glycol-bis(2-aminoethylether)-N,N,N',N'-tetraacetic acid (EGTA) | Sigma-Aldrich | E4378 | 2mM |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Depolarizing Solution | |||
| KCl | Sigma-Aldrich | 221473 | 110mM |
| Magnesium chloride | Sigma-Aldrich | M8266 | 1.5mM |
| Calcium Chloride | Caisson | C021 | 0.8mM |
| HEPES | Research Products International | H75030 | 10mM |
| Pipet Solution | |||
| KCl | Sigma-Aldrich | 221473 | 3M |
| Saponin Solution | |||
| Saponin | Sigma-Aldrich | 47036 | 0.125g |
| Internal Solution | See above | 50mL | |
| Agar Bridge Solution | |||
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 100ml of 1M |
| HEPES | Research Products International | H75030 | 1.2g |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Granulated Agar | Research Products International | A20250 | 3% |
| NMDG Storage Solution | |||
| NMDG, HEPES, MES Hydrate solution | see above | 40ml | |
| Water | 60ml | ||
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| High Performance Oocyte Clamp | Dagan | CA-1B | |
| Data Acquisition System | Axon CNS | Digidata 1440A | |
| Oscilloscope | Tektronix | TDS 210 | |
| Rack Power Filter | APC | G5 | |
| Heating/Cooling Bath Temperature Controller | Dagan | HCC-100A | |
| PC | Dell | Optiplex 990 | |
| pCLAMP 10.3 Voltage Clamp Software | Molecular Devices, LLC | pCLAMP10.3 | |
| TMC Vibration Control TableTop Platform | TMC | 64 SERIES | |
| TMC Vibration Control Air Table | TMC | 20 Series | |
| V1/I Electrode Data Collector | Dagan | part of CA-1B | |
| MX10L Micromanipulator | Siskiyou | MX10L | |
| Bath/Guard (I/V) Headstage (with appropriate connectors) | Dagan | part of CA-1B | |
| Microscope | Omano | OM2300S-JW11 | |
| Temperature Control Bath | Custom or Dagan | Custom or HE-204C | Custom chamber made from materials from Cool Polymers (D-series). Dagan also provides a prefeabricated stage (HE-204C). |
| Custom AgCl Pellet Container | Custom | Custom | Custom machined |
| Ag/AgCl electrode, pellet, 2.0 mm | Warner | E-206 | |
| External Oocyte Bath | Custom or Dagan | Custom or CC-1-T-LB | Custom machined or purchased from Dagan |
| Internal Oocyte Bath | Custom or Dagan | Custom or CC-TG-ND | Custom machined or purchased from Dagan |
| Capillaries for Agar Bridges and Pulled Electrodes | Warner | G150T-4 | |
| Rotatable Mounts for the Microscope, Micromanipulator, and Bath | Siskiyou | SD-1280P | |
| Fiber-Lite | Dolan-Jenner | LMI-600 | |
| Regular Bleach | Clorox | 470174-764 | |
| Xenopus laevis Oocytes | Nasco | LM535M (sexually mature females) | |
| 90 Na+ External Solution | See Solutions sheet | ||
| 10 Na+ Internal Solution | See Solutions sheet | ||
| 3 M KCL | See Solutions sheet | ||
| Saponin | Sigma-Aldrich | 47036 | |
| NMDG Storage Solution | See Solutions sheet | ||
| 5mL transfer pipets | SciMart | GS-52 | |
| Modified KCl electrode injector | BD | 309659 | Plastic syringe tip melted to allow for injection of solution into electrodes. Alternatively, a Microfil by WPI can be purchased. |
| Microvaccum | Custom | Custom | |
| Forceps | VWR | 63040-458 | |
| Oocyte Handling Tools (Pipette Pump) | VWR | 53502-222 | |
| Deionized Water Squirt Bottle | VWR | 16649-911 | |
| Vaseline Petroleum Jelly | Fisher Scientific | 19-086-291 | |
| Additional Materials Required for VCF Recordings: | |||
| VCF Microscope | Nikon | Eclipse FN1 | |
| Nikon CFI APO 40XW NIR Objective | Nikon | N40X-NIR | |
| X-Y Translator System for Fixed-Stage Upright Microscopes | Sutter Instruments | MT500-586 | |
| External VCF Oocyte Bath | Custom | Custom machined. The chamber dimensions are 2.7 x 1.9 x 0.4 cm. | |
| Internal VCF Oocyte Bath | Custom | Custom machined. The chamber dimensions are 1.6 x 1.6 x 0.4 cm. | |
| Modified Temperature Control Bath | Custom | Custom chamber made from materials from Cool Polymers (D-series). The chamber dimensions of the modified temperature controller bath are 2.7 x 1.9 x 0.3 cm for the horizontal chamber, and 1 x 2.5 x 0.5 cm for the vertical chamber. |
Referências
- Kalstrup, T., Blunck, R. Dynamics of internal pore opening in KV channels probed by a fluorescent unnatural amino acid. Proc. Natl. Acad. Sci. U.S.A. 110, 8272-8277 (2013).
- Stefani, E., Bezanilla, F. Cut-open oocyte voltage-clamp technique. Methods Enzymol. 293, 300-318 (1998).
- Muroi, Y., Chanda, B. Local anesthetics disrupt energetic coupling between the voltage-sensing segments of a sodium channel. J. Gen. Physiol. 133, 1-15 (2009).
- Stefani, E., Toro, L., Perozo, E., Bezanilla, F. Gating of Shaker K+ channels: I. Ionic and gating currents. Biophys. J. 66, 996-1010 (1994).
- Wang, S., Liu, S., Morales, M. J., Strauss, H. C., Rasmusson, R. L. A quantitative analysis of the activation and inactivation kinetics of HERG expressed in Xenopus oocytes. J. Physiolt. 502 (Pt 1), 45-60 (1997).
- Neely, A., Garcia-Olivares, J., Voswinkel, S., Horstkott, H., Hidalgo, P. Folding of active calcium channel beta(1b) -subunit by size-exclusion chromatography and its role on channel function. J. Biol. Chem. 279, 21689-21694 (2004).
- Silva, J. R., Goldstein, S. A. Voltage-sensor movements describe slow inactivation of voltage-gated sodium channels I: wild-type skeletal muscle. Na(V)1.4. J. Gen. Physiol. 141, 309-321 (2013).
- Silva, J. R., Goldstein, S. A. Voltage-sensor movements describe slow inactivation of voltage-gated sodium channels II: a periodic paralysis mutation in Na(V)1.4 (L689I). J. Gen. Physiol. 141, 323-334 (2013).
- Taglialatela, M., Toro, L., Stefani, E. Novel voltage clamp to record small, fast currents from ion channels expressed in Xenopus oocytes. Biophys. J. 61, 78-82 (1992).
- Clare, J. J., Trezise, D. J. . Expression and analysis of recombinant ion channels : from structural studies to pharmacological screening. , (2006).
- Cha, A., Zerangue, N., Kavanaugh, M., Bezanilla, F., Susan, G. A. . Methods in enzymology. 296, 566-578 (1998).
- Lakowicz, J. R. . Principles of fluorescence spectroscopy. 3rd edn. , (2006).
- Cha, A., Bezanilla, F. Characterizing voltage-dependent conformational changes in the Shaker K+ channel with fluorescence. Neuron. 19, 1127-1140 (1997).
- Richards, R., Dempski, R. E. Examining the conformational dynamics of membrane proteins in situ with site-directed fluorescence labeling. J. Vis. Exp. , (2011).
- Cohen, S., Au, S., Pante, N. Microinjection of Xenopus laevis oocytes. J. Vis. Exp. , (2009).
- Raynauld, J. P., Laviolette, J. R. The silver-silver chloride electrode: a possible generator of offset voltages and currents. J. Neurosci. Methods. 19, 249-255 (1987).
- Gagnon, D. G., Bissonnette, P., Lapointe, J. Y. Identification of a disulfide bridge linking the fourth and the seventh extracellular loops of the Na+/glucose cotransporter. J. Gen. Physiol. 127, 145-158 (2006).
- Pantazis, A., Olcese, R., Roberts, G. . Cut-Open Oocyte Voltage-Clamp Technique. In: Roberts G. (Ed.) Encyclopedia of Biophysics: SpringerReference. , (2013).

