La<em> Xenopus</em> Ovocitos-Cut abierta vaselina Gap Técnica Voltage-clamp Con Fluorometría
Summary
El enfoque de BPA vaselina de corte abierto se utiliza para obtener bajos grabaciones de ruido de corrientes iónicas y conmutación de canales iónicos dependientes de voltaje expresados en oocitos de Xenopus con alta resolución de la cinética de canal rápido. Con modificaciones menores, fluorometría de fijación de voltaje puede estar acoplado con el protocolo de ovocitos de corte abierto.
Abstract
La brecha vaselina ovocito a cielo abierto (COVG) técnica de fijación de voltaje permite el análisis de las propiedades electrofisiológicas y cinéticos de los canales iónicos heterólogos en ovocitos. Las grabaciones de la instalación a cielo abierto son particularmente útiles para la resolución de bajas corrientes de compuerta magnitud, la rápida activación de corriente iónica y desactivación. Los principales beneficios más de la fijación de voltaje de dos electrodos técnica (TEVC) incluyen el aumento de velocidad de la abrazadera, la mejora de la relación señal-ruido, y la capacidad de modular la intracelular y el medio extracelular.
Aquí, utilizamos el canal de sodio cardíaco humano (HNA V 1.5), expresado en ovocitos de Xenopus, para demostrar la disposición a cielo abierto y el protocolo, así como las modificaciones que se requieren para agregar la capacidad de fluorometría de fijación de voltaje.
Las propiedades de los canales iónicos de activación rápida, tales como HNA V 1.5, no se pueden resolver por completo cerca de la temperatura ambiente usando TEVC, en which la totalidad de la membrana del ovocito se sujeta, haciendo difícil el control de tensión. Sin embargo, en la técnica de cielo abierto, el aislamiento de sólo una pequeña parte de la membrana celular permite la rápida de sujeción requerida para registrar con precisión cinética rápida, mientras que la prevención de canal de carrera hacia abajo asociada con las técnicas de patch clamp.
En conjunción con la técnica COVG, la cinética de los canales iónicos y propiedades electrofisiológicas pueden ensayarse adicionalmente utilizando fluorometría de fijación de voltaje, donde el movimiento de proteínas se realiza un seguimiento a través de cisteína conjugación de fluoróforos aplicadas extracelularmente, la inserción de las proteínas fluorescentes codificadas genéticamente, o la incorporación de aminoácidos no naturales en la región de interés 1. Estos datos adicionales se obtiene información sobre cinética reordenamientos conformacionales dependientes de voltaje de la proteína a través de cambios en el microambiente que rodea la molécula fluorescente.
Introduction
Técnicas de fijación de voltaje especializados permiten la grabación de corrientes iónicas en los potenciales de membrana controlados. Ampliamente utilizado de fijación de voltaje de dos electrodos (TEVC) y las técnicas de patch clamp proporcionan información electrofisiológica fiable sobre las propiedades de muchos canales iónicos. Sin embargo, ambos de estos métodos tienen inconvenientes que impiden la adquisición de datos fiables para los canales de sodio dependientes de voltaje rápidos y otros canales de activación rápida en membranas tales como las de los oocitos de Xenopus. Los laboratorios Bezanilla y Stefani consecuencia desarrollaron la técnica de fijación de voltaje brecha vaselina a cielo abierto (COVG) de ovocitos 2. La técnica se ha aplicado ampliamente para grabar, Na +, K + y Ca 2 + canales 3-8.
Durante la grabación COVG, una membrana del oocito que expresa la proteína heteróloga se divide en tres regiones. Los datos de corriente iónica se graba desde la región superior de la ovocito como labaño que rodea la región de la parte superior se sujeta a un potencial de comando, que se puede cambiar fácil y rápidamente. Los guardias región de Oriente contra corrientes de fuga al ser sujetado al mismo potencial que la región superior 9. La región inferior es que la apertura de los ovocitos (cut-open) se produce mediante el uso de una solución de saponina o una cánula. Químico o la apertura manual de la membrana en la zona del fondo permite el control del potencial interno, que está fijado a tierra, y hace que el interior de la célula contigua con la solución de cámara inferior. La perfusión de soluciones en la cámara inferior puede ajustar las propiedades del medio interno, mientras que el intercambio de solución en la cámara superior altera el entorno externo. 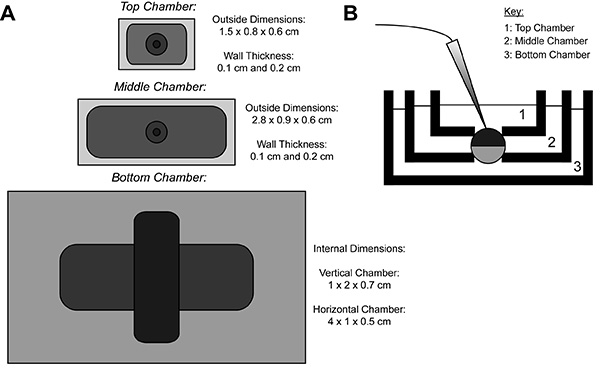
Figura 1. Ovocitos-Cut abierto Voltaje-Clamp Bath esquema de instalación. (A) Topabajo de la vista de los tres cuartos de baño separados el uno del otro. Las dimensiones de las cámaras para COVG se muestran en la figura. (B) Vista lateral de la configuración de los baños en posición de prueba. Haga clic aquí para ver la imagen más grande .
Las ventajas de la técnica de COVG incluyen bajo ruido de corriente (nA 1 a 3 kHz), el control de la composición iónica de los medios de comunicación externos, la capacidad de modular los medios de comunicación interna, el tiempo de resolución rápida (20-100 microsegundos constante de tiempo de decaimiento de la capacidad transitoria), y grabaciones estable durante varias horas 9. Las desventajas son que requiere un equipo especializado y es más difícil de realizar en comparación con dos de fijación de tensión de electrodos (TEVC) 10.
Si bien el enfoque COVG requiere un equipo altamente especializado y elementos de procedimiento intrincados, puede permitir la adquisición de valiosadatos electrofisiológicos capaces. Estos datos, como conmutar corrientes con cinética rápida y corrientes de cola 4, se puede grabar sin algunos de los problemas asociados con otros protocolos de fijación de voltaje, incluyendo canal de decadencia. Pequeñas modificaciones en la configuración COVG pueden permitir el uso de controladores de temperatura y fluorometría fijación de voltaje (VCF). La inclusión de elementos de sujeción de fluorometría de tensión dentro del conjunto COVG puede aumentar la salida de datos por conferir la capacidad de monitorizar los cambios conformacionales de la proteína mientras que al mismo tiempo la grabación actual 11-13.
Protocol
Representative Results
Discussion
La vaselina ovocito técnica de fijación de voltaje brecha de corte abierto permite una rápida resolución de los datos, de poco ruido, aumenta el control sobre la solución interna y composición de la solución externa y grabaciones estables a través de protocolos relativamente largos 19. Estas ventajas establecen esta técnica, aparte de la fijación de voltaje de dos electrodos estándar y técnicas de patch clamp. Aunque se requiere equipo especializado y el protocolo es relativamente difícil, muy po…
Declarações
The authors have nothing to disclose.
Acknowledgements
Todos los miembros de la Universidad de Washington en St. Louis cardiaca Molecular Laboratorio de Ingeniería. A Burroughs Welcome Premio Fondo Carrera en la interfaz de la Ciencia – 1010299 (JS).
Materials
| External Solution | Brand | Catalog Number | [Final], weight, or volume |
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 25mM |
| MES Sodium Salt | Sigma-Aldrich | M5057 | 90mM |
| HEPES | Research Products International | H75030 | 20mM |
| Calcium hydroxide | Sigma-Aldrich | 239232 | 2mM |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Internal Solution | |||
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 105mM |
| MES Sodium Salt | Sigma-Aldrich | M5057 | 10mM |
| HEPES | Research Products International | H75030 | 20mM |
| Ethylene glycol-bis(2-aminoethylether)-N,N,N',N'-tetraacetic acid (EGTA) | Sigma-Aldrich | E4378 | 2mM |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Depolarizing Solution | |||
| KCl | Sigma-Aldrich | 221473 | 110mM |
| Magnesium chloride | Sigma-Aldrich | M8266 | 1.5mM |
| Calcium Chloride | Caisson | C021 | 0.8mM |
| HEPES | Research Products International | H75030 | 10mM |
| Pipet Solution | |||
| KCl | Sigma-Aldrich | 221473 | 3M |
| Saponin Solution | |||
| Saponin | Sigma-Aldrich | 47036 | 0.125g |
| Internal Solution | See above | 50mL | |
| Agar Bridge Solution | |||
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 100ml of 1M |
| HEPES | Research Products International | H75030 | 1.2g |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Granulated Agar | Research Products International | A20250 | 3% |
| NMDG Storage Solution | |||
| NMDG, HEPES, MES Hydrate solution | see above | 40ml | |
| Water | 60ml | ||
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| High Performance Oocyte Clamp | Dagan | CA-1B | |
| Data Acquisition System | Axon CNS | Digidata 1440A | |
| Oscilloscope | Tektronix | TDS 210 | |
| Rack Power Filter | APC | G5 | |
| Heating/Cooling Bath Temperature Controller | Dagan | HCC-100A | |
| PC | Dell | Optiplex 990 | |
| pCLAMP 10.3 Voltage Clamp Software | Molecular Devices, LLC | pCLAMP10.3 | |
| TMC Vibration Control TableTop Platform | TMC | 64 SERIES | |
| TMC Vibration Control Air Table | TMC | 20 Series | |
| V1/I Electrode Data Collector | Dagan | part of CA-1B | |
| MX10L Micromanipulator | Siskiyou | MX10L | |
| Bath/Guard (I/V) Headstage (with appropriate connectors) | Dagan | part of CA-1B | |
| Microscope | Omano | OM2300S-JW11 | |
| Temperature Control Bath | Custom or Dagan | Custom or HE-204C | Custom chamber made from materials from Cool Polymers (D-series). Dagan also provides a prefeabricated stage (HE-204C). |
| Custom AgCl Pellet Container | Custom | Custom | Custom machined |
| Ag/AgCl electrode, pellet, 2.0 mm | Warner | E-206 | |
| External Oocyte Bath | Custom or Dagan | Custom or CC-1-T-LB | Custom machined or purchased from Dagan |
| Internal Oocyte Bath | Custom or Dagan | Custom or CC-TG-ND | Custom machined or purchased from Dagan |
| Capillaries for Agar Bridges and Pulled Electrodes | Warner | G150T-4 | |
| Rotatable Mounts for the Microscope, Micromanipulator, and Bath | Siskiyou | SD-1280P | |
| Fiber-Lite | Dolan-Jenner | LMI-600 | |
| Regular Bleach | Clorox | 470174-764 | |
| Xenopus laevis Oocytes | Nasco | LM535M (sexually mature females) | |
| 90 Na+ External Solution | See Solutions sheet | ||
| 10 Na+ Internal Solution | See Solutions sheet | ||
| 3 M KCL | See Solutions sheet | ||
| Saponin | Sigma-Aldrich | 47036 | |
| NMDG Storage Solution | See Solutions sheet | ||
| 5mL transfer pipets | SciMart | GS-52 | |
| Modified KCl electrode injector | BD | 309659 | Plastic syringe tip melted to allow for injection of solution into electrodes. Alternatively, a Microfil by WPI can be purchased. |
| Microvaccum | Custom | Custom | |
| Forceps | VWR | 63040-458 | |
| Oocyte Handling Tools (Pipette Pump) | VWR | 53502-222 | |
| Deionized Water Squirt Bottle | VWR | 16649-911 | |
| Vaseline Petroleum Jelly | Fisher Scientific | 19-086-291 | |
| Additional Materials Required for VCF Recordings: | |||
| VCF Microscope | Nikon | Eclipse FN1 | |
| Nikon CFI APO 40XW NIR Objective | Nikon | N40X-NIR | |
| X-Y Translator System for Fixed-Stage Upright Microscopes | Sutter Instruments | MT500-586 | |
| External VCF Oocyte Bath | Custom | Custom machined. The chamber dimensions are 2.7 x 1.9 x 0.4 cm. | |
| Internal VCF Oocyte Bath | Custom | Custom machined. The chamber dimensions are 1.6 x 1.6 x 0.4 cm. | |
| Modified Temperature Control Bath | Custom | Custom chamber made from materials from Cool Polymers (D-series). The chamber dimensions of the modified temperature controller bath are 2.7 x 1.9 x 0.3 cm for the horizontal chamber, and 1 x 2.5 x 0.5 cm for the vertical chamber. |
Referências
- Kalstrup, T., Blunck, R. Dynamics of internal pore opening in KV channels probed by a fluorescent unnatural amino acid. Proc. Natl. Acad. Sci. U.S.A. 110, 8272-8277 (2013).
- Stefani, E., Bezanilla, F. Cut-open oocyte voltage-clamp technique. Methods Enzymol. 293, 300-318 (1998).
- Muroi, Y., Chanda, B. Local anesthetics disrupt energetic coupling between the voltage-sensing segments of a sodium channel. J. Gen. Physiol. 133, 1-15 (2009).
- Stefani, E., Toro, L., Perozo, E., Bezanilla, F. Gating of Shaker K+ channels: I. Ionic and gating currents. Biophys. J. 66, 996-1010 (1994).
- Wang, S., Liu, S., Morales, M. J., Strauss, H. C., Rasmusson, R. L. A quantitative analysis of the activation and inactivation kinetics of HERG expressed in Xenopus oocytes. J. Physiolt. 502 (Pt 1), 45-60 (1997).
- Neely, A., Garcia-Olivares, J., Voswinkel, S., Horstkott, H., Hidalgo, P. Folding of active calcium channel beta(1b) -subunit by size-exclusion chromatography and its role on channel function. J. Biol. Chem. 279, 21689-21694 (2004).
- Silva, J. R., Goldstein, S. A. Voltage-sensor movements describe slow inactivation of voltage-gated sodium channels I: wild-type skeletal muscle. Na(V)1.4. J. Gen. Physiol. 141, 309-321 (2013).
- Silva, J. R., Goldstein, S. A. Voltage-sensor movements describe slow inactivation of voltage-gated sodium channels II: a periodic paralysis mutation in Na(V)1.4 (L689I). J. Gen. Physiol. 141, 323-334 (2013).
- Taglialatela, M., Toro, L., Stefani, E. Novel voltage clamp to record small, fast currents from ion channels expressed in Xenopus oocytes. Biophys. J. 61, 78-82 (1992).
- Clare, J. J., Trezise, D. J. . Expression and analysis of recombinant ion channels : from structural studies to pharmacological screening. , (2006).
- Cha, A., Zerangue, N., Kavanaugh, M., Bezanilla, F., Susan, G. A. . Methods in enzymology. 296, 566-578 (1998).
- Lakowicz, J. R. . Principles of fluorescence spectroscopy. 3rd edn. , (2006).
- Cha, A., Bezanilla, F. Characterizing voltage-dependent conformational changes in the Shaker K+ channel with fluorescence. Neuron. 19, 1127-1140 (1997).
- Richards, R., Dempski, R. E. Examining the conformational dynamics of membrane proteins in situ with site-directed fluorescence labeling. J. Vis. Exp. , (2011).
- Cohen, S., Au, S., Pante, N. Microinjection of Xenopus laevis oocytes. J. Vis. Exp. , (2009).
- Raynauld, J. P., Laviolette, J. R. The silver-silver chloride electrode: a possible generator of offset voltages and currents. J. Neurosci. Methods. 19, 249-255 (1987).
- Gagnon, D. G., Bissonnette, P., Lapointe, J. Y. Identification of a disulfide bridge linking the fourth and the seventh extracellular loops of the Na+/glucose cotransporter. J. Gen. Physiol. 127, 145-158 (2006).
- Pantazis, A., Olcese, R., Roberts, G. . Cut-Open Oocyte Voltage-Clamp Technique. In: Roberts G. (Ed.) Encyclopedia of Biophysics: SpringerReference. , (2013).

