荧光成像与一纳米精度(FIONA)
Summary
单荧光团可与纳米精度利用FIONA本地化。这里的FIONA技术的总结报告,以及如何进行FIONA实验进行说明。
Abstract
荧光成像与纳米精度(FIONA)是一个简单而有用的技术,本地化单个荧光基团与纳米精度在XY平面上。在这里,FIONA技术的总结报告,并已使用FIONA进行研究的例子进行了简要介绍。首先,如何设置所需的设备FIONA实验, 也就是说 ,全内反射荧光显微镜(TIRFM),与上对准光学元件的细节进行说明。那么如何进行一个简单的FIONA实验的本地化固定的Cy3-DNA单分子使用合适的协议,其次是利用FIONA来衡量一个截断的肌球蛋白弗吉尼亚州电机标有量子点的36纳米的步长,说明。最后,据报道最近努力FIONA的适用范围扩大至厚的样品。它表明,用水浸物镜和量子点浸泡深在溶胶 – 凝胶和兔眼的角膜(>200微米),为2-3纳米的定位精度都可以实现。
Introduction
围绕1882,阿贝发现,可见光显微镜的分辨率为〜λ/ 2NA,或〜200纳米(其中,λ是波长,NA是数值孔径)1,2。因此,比该尺寸更小的任何对象将显示为在光学显微镜衍射极限的光点。然而,这是可能的,以确定中心的点,即,该对象的位置,以更高的精度3。荧光成像与纳米精度(FIONA)是一个简单而有用的技术,本地化单个荧光基团与纳米精度在XY平面4。定位的精度,σμ( 即 ,平均值的标准误差),取决于所收集的光子的总数, 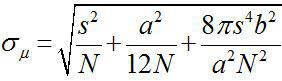 ,其中N是光子计数,s是荧光点的标准偏差,a是成像检测器的像素尺寸,而b是背景3,4的标准偏差。对于荧光发光〜10,000的光子,FIONA可以实现〜1nm的精度4。
,其中N是光子计数,s是荧光点的标准偏差,a是成像检测器的像素尺寸,而b是背景3,4的标准偏差。对于荧光发光〜10,000的光子,FIONA可以实现〜1nm的精度4。
FIONA可以用来精确地确定一个固定的发射器的位置或移动一个(假设图像可采取足够快)。 FIONA可以顺序地被施加到影片的帧,从而跟踪单分子4-8的动作。光保护性试剂可以是必要的,以确保样品不光降解。此外,该荧光物本身可以是任何尺寸的,比衍 射LIMIT- 例如更小或更大,它可以由细胞器(〜1微米)与分散在其膜的许多荧光蛋白。使用FIONA仍然可以得到非常精确的(纳米)平均平均中心的质量的。在定位精度的巨大进步菲奥娜可以解决nanome三元规模的变动随着时间的推移。这已使显微镜到分子尺度4-8。
因为它的发明中,已开发FIONA的变体。例如,明场成像与纳米精度(bFIONA)9,FIONA轻微变形,图像和本地化致密的对象,如黑色素在体内 (深含黑色素的对象)与透射光。此外,FIONA已被用来解决多种染料。例如,单分子的高分辨率成像光漂白(虾)10,11或单分子高分辨率的共定位(SHREC)12已发展到在约10nm的解决两种染料。 (注意,这是分辨率,即可以如何准确地告诉完全相同染料分开。)最近,FIONA分析,以一定的超分辨率显微镜国产化进程作出了贡献,如随机光学RECOnstruction显微镜(STORM)13 – 15和光激活定位显微镜(PALM)16,其中临时暗的荧光团被激发,然后在荧光被本地化。由染料的反复刺激的相当低的浓度(小于每衍射受限斑),然后收集的荧光,通过FIONA他们每个人的分析,我们可以建立一个高分辨率的地图。分辨率则只是受限于光子的数量每种染料推出,以及类似的东西在采集过程中保持静止的样品(包括, 例如 ,在显微镜载物台)。
在本文中,FIONA技术的总结,并简要介绍了已使用FIONA报道进行研究的例子。首先,如何设置所需的设备FIONA实验, 也就是说 ,全内反射荧光显微镜(TIRFM),与上对准光学元件的细节进行说明。那么如何进行简单的FIONA实验上定位固定的Cy3-DNA单分子使用合适的协议,说明。在此之后,利用FIONA的测量单个截头肌球蛋白弗吉尼亚马达标有量子点的36纳米步长给出。肌球蛋白Va为一个重要的processive马达蛋白携带蜂窝货物而沿微丝易位。这里球蛋白弗吉尼亚州建造截断用来删除域无关的步长,并与FLAG标签添加到C端,使其很容易与功能化与抗FLAG抗体的量子点标记的。该实验是在低的ATP进行减缓肌球蛋白和允许使用足够长的曝光时间以获得良好的光子计数在每帧。任何足够亮的荧光标记物可被取代的以下协议。最后,报道近期扩大菲奥娜厚样本应用程序的努力。作为一种证明性的原则,量子点都湿透了在溶胶 – 凝胶和兔眼的角膜,然后成像并使用FIONA本地化。对于成像,具有呐60X水浸物镜= 1.2被使用,因为这一目标具有较长的工作距离比以前使用100倍油浸物镜。以补偿在放大的损失中的目标,一个额外的放大倍率透镜(3.3X或4.0X)插入在发射路径。此外,落射荧光(未TIR)镜需要被用来访问深区域中的厚样品中。它示出在溶胶 – 凝胶和在兔眼的角膜(Z> 200微米),可以用2-3 nm的精度被定位浸泡深量子点。
Protocol
Representative Results
Discussion
FIONA是一种技术来定位具有纳米精度和时间分辨率的荧光发射(有机荧光团或量子点)的位置下降到1毫秒4-8。当足够的光子被收集,该技术允许对多比衍射极限(约200纳米)更精确地确定的荧光发射器的位置,因此该方法将打开的方式来观察哪些还没有被看到与常规的/传统的光学显微镜4 – 8。自从发明,FIONA已成功应用于观察走路多分子马达,如肌球蛋白和驱动蛋白。最近,连同…
Declarações
The authors have nothing to disclose.
Acknowledgements
这项工作是由美国国立卫生研究院资助068625,美国国家科学基金会资助1063188活细胞0822613.特别感谢滨海诺维奇博士贝克曼研究所高级科学技术对兔眼礼物的物理中心的支持。
Materials
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| Double-sided tape | 3M | — | ~ 75 um thick |
| EMCCD camera | Andor Technology | DU-897E-CS0-#BV | |
| Ultrasonic cleaner | Branson | 2510 | |
| Fluorescence filter set | Chroma | 49016 | |
| Actin polymerization buffer | Cytoskeleton | BSA02 | |
| Biotin G-actin | Cytoskeleton | AB07 | |
| G-actin | Cytoskeleton | AKL95 | |
| General actin buffer | Cytoskeleton | BSA01 | |
| Laser shutter (with driver) | Electro-Optical Products Corp. | SH-10-MP | |
| IDL | Exelis Visual Information Solutions | — | |
| Neutravidin | Fisher Scientific | PI-31000 | |
| Coverslip | Fisherbrand | 22X30-1.5 | 0.16-0.19 mm thick |
| Microscope slide | Gold Seal Microslides | 30103X1 | 0.93-1.05 mm thick |
| Plasma cleaner | Harrick Plasma | PDC-001 | |
| Glass bottom dish | In Vitro Scientific | D35-20-1.5-N | |
| Cy3-DNA oligos | Integrated DNA Technologies | — | 5'-Cy3/GCCTCGCTGCCGTCGCCA-3'Bio |
| Fluorescent beads | Invitrogen | T-7280 | |
| Qdot 605-streptavidin | Invitrogen | Q10101MP | |
| Qdot605 | Invitrogen | Q21301MP | |
| Qdot705 | Invitrogen | Q22021MP | |
| Qdot705 Antibody Conjugation Kit | Invitrogen | Q22061MP | |
| Matlab | MathWorks | — | |
| Optical table | Newport Corp | — | RS4000 Series |
| 60X Objective | Nikon | Plan Apo VC 60x WI | |
| 100X Objective | Olympus | PlanApo 100X/1.45 Oil ∞/0.17 | |
| 60X Objective | Olympus | UPlanApo 60X/1.20W | |
| Inverted microscope | Olympus | IX71/IX70/IX81 | |
| Origin | OriginLab | — | |
| Anti-FLAG antibody | Sigma Aldrich | F7425-.2MG | |
| ATP | Sigma Aldrich | A7699 | |
| BME | Sigma Aldrich | 63689-25ML-F | |
| BSA | Sigma Aldrich | A7906 | |
| BSA-biotin | Sigma Aldrich | A8549-10MG | |
| CK | Sigma Aldrich | C3755 | Creatine Phosphokinase from rabbit muscle |
| CP | Sigma Aldrich | P1937 | Phosphocreatine di(tris) salt |
| DTT | Sigma Aldrich | 43815 | DL-Dithiothreitol |
| EGTA | Sigma Aldrich | E3889 | Ethylene glycol-bis(2-aminoethylether)-N,N,N′,N′-tetraacetic acid |
| HCl | Sigma Aldrich | 93363-500G | |
| HEPES | Sigma Aldrich | H0887 | |
| KCl | Sigma Aldrich | P9333 | |
| MgCl2 | Sigma Aldrich | M1028 | |
| NaCl | Sigma Aldrich | S7653 | |
| PCA | Sigma Aldrich | 03930590 | Protocatechuic acid |
| PCD | Sigma Aldrich | P8279 | Protocatechuate-3,4-dioxygenase |
| TMOS | Sigma Aldrich | 341436-25G | Tetramethyl orthosilicate |
| Tris-HCl | Sigma Aldrich | 93363 | |
| Trolox | Sigma Aldrich | 238813 | 6-hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid |
| 1” diameter broadband dielectric mirrors with mounts | Thorlabs | BB1-E02, KM100 | Quantity: 2 |
| ½” diameter posts | Thorlabs | TR4 | Quantity ≥ 6 |
| 10x beam expander | Thorlabs | BE10M-A | |
| 2” diameter broadband dielectric mirrors with mounts | Thorlabs | BB2-E02, KM200 | Quantity: 2 |
| 2” diameter f = 300 mm lens with mount | Thorlabs | LA1256-A, LMR2 | TIR lens |
| Fluorescent alignment target | Thorlabs | VRC2SM1 | |
| Laser safety goggles | Thorlabs | LG3 | |
| ND filter(s) | Thorlabs | FW1AND | |
| Optical beam profiler | Thorlabs | BP209-VIS | |
| Post-mounted iris diaphragm | Thorlabs | ID25 | Quantity: 2 |
| Shearing interferometer | Thorlabs | SI100 | |
| XYZ translation stage, ½” travel | Thorlabs | T12XYZ | |
| Laser | World Star Technologies | TECGL-30 | 532 nm, 30 mW |
Referências
- Abbe, E. The Relation of Aperture and Power in the Microscope. Journal of the Royal Microscopical Society. 2 (3), 300-309 (1882).
- Abbe, E. The Relation of Aperture and Power in the Microscope (continued). Journal of the Royal Microscopical Society. 2 (4), 460-473 (1882).
- Thompson, R. Precise Nanometer Localization Analysis for Individual Fluorescent Probes. Biophysical Journal. 82 (5), 2775-2783 (2002).
- Yildiz, A., et al. Myosin V Walks Hand-Over-Hand: Single Fluorophore Imaging with 1.5-nm Localization. Science. 300 (5628), 2061-2065 (2003).
- Yildiz, A., Tomishige, M., Vale, R. D., Selvin, P. R. Kinesin Walks Hand-Over-Hand. Science. 303 (5658), 676-678 (2004).
- Yildiz, A., et al. Myosin VI Steps via a Hand-over-Hand Mechanism with Its Lever Arm Undergoing Fluctuations when Attached to Actin. Journal of Biological Chemistry. 279 (36), 37223-37226 (2004).
- Yildiz, A., Selvin, P. R. Fluorescence Imaging with One Nanometer Accuracy: Application to Molecular Motors. Accounts of Chemical Research. 38 (7), 574-582 (2005).
- Toprak, E., Yildiz, A., Hoffman, M. T., Rosenfeld, S. S., Selvin, P. R. Why kinesin is so processive. Proceedings of the National Academy of Sciences. 106 (31), (2009).
- Kural, C., et al. Tracking melanosomes inside a cell to study molecular motors and their interaction. Proceedings of the National Academy of Sciences. 104 (13), 5378-5382 (2007).
- Gordon, M. P., Ha, T., Selvin, P. R. Single-molecule high-resolution imaging with photobleaching. Proceedings of the National Academy of Sciences of the United States of America. 101 (17), 6462-6465 (2004).
- Qu, X., Wu, D., Mets, L., Scherer, N. F. Nanometer-localized multiple single-molecule fluorescence microscopy. Proceedings of the National Academy of Sciences of the United States of America. 101 (31), 11298-11303 (2004).
- Churchman, L. S., Ökten, Z., Rock, R. S., Dawson, J. F., Spudich, J. A. Single molecule high-resolution colocalization of Cy3 and Cy5 attached to macromolecules measures intramolecular distances through time. Proceedings of the National Academy of Sciences of the United States of America. 102 (5), 1419-1423 (2005).
- Huang, B., Wang, W., Bates, M., Zhuang, X. Three-Dimensional Super-Resolution Imaging by Stochastic Optical Reconstruction Microscopy. Science. 319 (5864), 810-813 (2008).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nat Meth. 3 (10), 793-796 (2006).
- Bates, M., Huang, B., Dempsey, G. T., Zhuang, X. Multicolor Super-Resolution Imaging with Photo-Switchable Fluorescent Probes. Science. 317 (5845), 1749-1753 (2007).
- Betzig, E., et al. Imaging Intracellular Fluorescent Proteins at Nanometer Resolution. Science. 313 (5793), 1642-1645 (2006).
- Abramoff, M. D., Magalhães, P. J., Ram, S. J. Image processing with ImageJ. Biophotonics international. 11 (7), 36-42 (2004).
- Enderlein, J., Toprak, E., Selvin, P. R. Polarization effect on position accuracy of fluorophore localization. Optics Express. 14 (18), 8111-8120 (2006).
- Cheezum, M. K., Walker, W. F., Guilford, W. H. Quantitative comparison of algorithms for tracking single fluorescent particles. Biophysical Journal. 81 (4), 2378-2388 (2001).
- Rasnik, I., McKinney, S. A., Ha, T. Nonblinking and long-lasting single-molecule fluorescence imaging. Nature Methods. 3 (11), 891-893 (2006).
- Zhuang, X., et al. A Single-Molecule Study of RNA Catalysis and Folding. Science. 288 (5473), 2048-2051 (2000).
- Aitken, C. E., Marshall, R. A., Puglisi, J. D. An Oxygen Scavenging System for Improvement of Dye Stability in Single-Molecule Fluorescence Experiments. Biophysical Journal. 94 (5), 1826-1835 (2008).

