Imagens de fluorescência com um nanômetros Precisão (Fiona)
Summary
Fluorophores individuais podem ser localizados com precisão nanométrica usando FIONA. Aqui um resumo da técnica FIONA é relatado, e como a realização de experimentos Fiona é descrito.
Abstract
Imagens de fluorescência com uma precisão de um nanômetro (Fiona) é uma técnica simples, mas útil para localizar fluorophores individuais com precisão nanométrica no plano xy. Aqui um resumo da técnica FIONA é relatado e exemplos de pesquisas que têm sido realizados utilizando FIONA são descritas resumidamente. Em primeiro lugar, como configurar o equipamento necessário para experimentos de FIONA, ou seja, um total de microscopia de fluorescência de reflexão interna (TIRFM), com detalhes sobre o alinhamento da ótica, é descrito. Em seguida, como para realizar uma experiência simples fIONA em localizar moléculas imobilizadas com Cy3 de ADN individuais utilizando os protocolos apropriados, seguindo-se a utilização de fIONA para medir o tamanho do passo de 36 nm, de um único motor de miosina Va truncado marcado com um quantum dot, é ilustrado. Por fim, o esforço recente para estender a aplicação da FIONA para amostras espessas é relatado. Mostra-se que, utilizando uma objectiva de imersão em água e pontos quânticos embebido profundamente em sol-gel e córneas do olho de coelho (>200 mm), a precisão da localização 2-3 nm pode ser atingida.
Introduction
Por volta de 1882, Ernst Abbe descobriu que a resolução de um microscópio de luz visível é ~ λ / 2NA, ou ~ 200 nm (onde λ é o comprimento de onda e NA é a abertura numérica) 1,2. Por conseguinte, qualquer objecto mais pequeno do que esta dimensão que aparecem como uma mancha de difracção limitada, no microscópio óptico. No entanto, é possível determinar o centro do ponto, isto é, a localização do objecto, com uma precisão muito superior 3. Imagens de fluorescência com uma precisão de um nanômetro (Fiona) é uma técnica simples, mas útil para localizar fluorophores individuais com precisão nanométrica no plano xy 4. A precisão da localização, σ μ (ou seja, o erro padrão da média), depende do número total de fotões recolhidos, 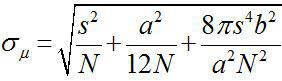 , Onde N é o número de fotões, s é o desvio padrão da mancha fluorescente, um éo tamanho do pixel do detector de imagens, e b é o desvio padrão do fundo de 3,4. Para um fluoróforo que emite fótons ~ 10.000, FIONA pode alcançar ~ 1 nm precisão 4.
, Onde N é o número de fotões, s é o desvio padrão da mancha fluorescente, um éo tamanho do pixel do detector de imagens, e b é o desvio padrão do fundo de 3,4. Para um fluoróforo que emite fótons ~ 10.000, FIONA pode alcançar ~ 1 nm precisão 4.
FIONA pode ser utilizada para determinar com precisão a posição de um emissor estacionário, ou um movimento (assumindo que as imagens podem ser feita suficientemente rápida). FIONA pode ser aplicado, sequencialmente, para os quadros do filme e, assim, controlar o movimento da única molécula 4 a 8. Reagentes foto-proteção pode ser necessário garantir que a amostra não photodegrade. Além disso, o próprio objecto fluorescente pode ser de qualquer tamanho, menor ou maior do que a difracção LIMIT- por exemplo, pode consistir de um organelo (~ 1 mm) com muitas proteínas fluorescentes dispersas sobre a sua membrana. Usando FIONA ainda pode render um (nanômetros) média muito precisos de sua média de centro de massa. A grande melhoria na precisão de localização por Fiona permite resolver nanometer movimentos escala ao longo do tempo. Isso levou microscopia na escala de comprimento molecular 4 a 8.
Desde a sua invenção, as variantes do fIONA têm sido desenvolvidos. Por exemplo, a imagem de campo claro com uma precisão de um nanômetro (bFIONA) 9, uma ligeira variante da FIONA, imagens e localiza objetos densos como melanossomas in vivo (objetos escuros contendo o pigmento melanina) com luz transmitida. Além disso, fIONA tem sido empregue para resolver vários corantes. Por exemplo, uma única molécula de alta resolução de imagem com fotodegradação (camarão) 10,11 ou uma única molécula de alta resolução co-localização (SHREC) 12 foram desenvolvidos para resolver dois corantes dentro de cerca de 10 nm. (Note-se que esta é a resolução, ou seja, a precisão com que se pode contar corantes idênticos separados.) Mais recentemente, a análise FIONA tem contribuído para o processo de localização de certos microscopia de super-resolução, como reco óptica estocásticamicroscopia nstruction (STORM) 13 e 15 e microscopia de localização ativados por foto (PALM) 16, em que fluorophores escuras temporárias está animado, e, em seguida, a fluorescência é localizada. Por várias vezes bastante interessante uma baixa densidade de corantes (menos do que um por difracção limitada local), e, em seguida, recolhendo a fluorescência, a análise de cada um deles por fIONA, pode-se construir um mapa de alta resolução. A resolução é, então, apenas limitado pelo número de fotões cada corante coloca fora, bem como coisas como manter a amostra estacionária (incluindo, por exemplo, a fase de microscópio), durante a aquisição.
Neste trabalho, um resumo da técnica FIONA e descrever brevemente exemplos de pesquisas que têm sido realizadas utilizando FIONA é relatado. Em primeiro lugar, como configurar o equipamento necessário para experimentos de FIONA, ou seja, um total de microscopia de fluorescência de reflexão interna (TIRFM), com detalhes sobre o alinhamento da ótica, é descrito. Então, comorealizar uma experiência simples FIONA em localizar moléculas imobilizadas Cy3-DNA único meio de protocolos apropriados, é ilustrado. Depois disso, o uso de fIONA para medir o tamanho do passo de 36 nm, de um único motor de miosina Va truncado marcado com um quantum dot é apresentado. Miosina Va é uma proteína motora processive essencial que transporta carga celular enquanto translocação ao longo dos filamentos de actina. Aqui uma miosina Va construir truncada é utilizado para remover os domínios irrelevantes para o tamanho do passo, e com um marcador FLAG adicionado ao terminal C para permitir a facilidade de marcação com quantum dots funcionalizados com anticorpos anti-FLAG. Esta experiência é realizada em condições de baixa ATP para abrandar a miosina e permitir a utilização de longos tempos de exposição suficiente para obter uma boa contagem de fotões em cada quadro. Qualquer marcador fluorescente suficientemente brilhante pode ser substituído no seguinte protocolo. Por fim, é relatado recente esforço de estender a aplicação da FIONA a amostras de espessura. Como princípio de prova de, pontos quânticos foram embebidosem sol-gel e córneas do olho de coelho e, em seguida, analisados e localizado com Fiona. Para imagem, uma objectiva de imersão em água 60X com NA = 1.2 foi usado porque este objectivo tem uma distância maior do que trabalhar utilizado anteriormente objetiva de imersão em óleo de 100X. Para compensar a perda na ampliação da objetiva, uma lente extra-ampliação (3.3X ou 4.0X) foi inserido no caminho de emissões. Além disso, a epi-fluorescência (não TIR), microscopia precisa de ser utilizado para acesso a regiões profundas nas amostras grossas. Mostra-se que os pontos quânticos embebidos no fundo do sol-gel e em córneas do olho de coelho (Z> 200 mM) podem ser localizados com precisão 2-3 nm.
Protocol
Representative Results
Discussion
Fiona é uma técnica para localizar a posição de um emissor fluorescente (fluoróforo orgânico ou quantum dot) com precisão nanométrica e resolução temporal de até 1 ms 4 a 8. Quando os fótons suficientes são coletados, esta técnica permite determinar a posição de um emissor fluorescente com muito mais precisão do que o limite de difração (~ 200 nm) e, portanto, esta técnica abre uma maneira de observar o que não tem sido visto com microscopia óptica convencional / tradicional 4 – 8.<…
Declarações
The authors have nothing to disclose.
Acknowledgements
Este trabalho foi financiado pelo NIH Grants 068.625, Subsídios NSF 1063188 e Centro de Física de células vivas 0822613. agradecimentos especiais vão para o Dr. Marina Marjanovic no Instituto Beckman para Ciência Avançada e Tecnologia para o dom de olhos de coelhos.
Materials
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| Double-sided tape | 3M | — | ~ 75 um thick |
| EMCCD camera | Andor Technology | DU-897E-CS0-#BV | |
| Ultrasonic cleaner | Branson | 2510 | |
| Fluorescence filter set | Chroma | 49016 | |
| Actin polymerization buffer | Cytoskeleton | BSA02 | |
| Biotin G-actin | Cytoskeleton | AB07 | |
| G-actin | Cytoskeleton | AKL95 | |
| General actin buffer | Cytoskeleton | BSA01 | |
| Laser shutter (with driver) | Electro-Optical Products Corp. | SH-10-MP | |
| IDL | Exelis Visual Information Solutions | — | |
| Neutravidin | Fisher Scientific | PI-31000 | |
| Coverslip | Fisherbrand | 22X30-1.5 | 0.16-0.19 mm thick |
| Microscope slide | Gold Seal Microslides | 30103X1 | 0.93-1.05 mm thick |
| Plasma cleaner | Harrick Plasma | PDC-001 | |
| Glass bottom dish | In Vitro Scientific | D35-20-1.5-N | |
| Cy3-DNA oligos | Integrated DNA Technologies | — | 5'-Cy3/GCCTCGCTGCCGTCGCCA-3'Bio |
| Fluorescent beads | Invitrogen | T-7280 | |
| Qdot 605-streptavidin | Invitrogen | Q10101MP | |
| Qdot605 | Invitrogen | Q21301MP | |
| Qdot705 | Invitrogen | Q22021MP | |
| Qdot705 Antibody Conjugation Kit | Invitrogen | Q22061MP | |
| Matlab | MathWorks | — | |
| Optical table | Newport Corp | — | RS4000 Series |
| 60X Objective | Nikon | Plan Apo VC 60x WI | |
| 100X Objective | Olympus | PlanApo 100X/1.45 Oil ∞/0.17 | |
| 60X Objective | Olympus | UPlanApo 60X/1.20W | |
| Inverted microscope | Olympus | IX71/IX70/IX81 | |
| Origin | OriginLab | — | |
| Anti-FLAG antibody | Sigma Aldrich | F7425-.2MG | |
| ATP | Sigma Aldrich | A7699 | |
| BME | Sigma Aldrich | 63689-25ML-F | |
| BSA | Sigma Aldrich | A7906 | |
| BSA-biotin | Sigma Aldrich | A8549-10MG | |
| CK | Sigma Aldrich | C3755 | Creatine Phosphokinase from rabbit muscle |
| CP | Sigma Aldrich | P1937 | Phosphocreatine di(tris) salt |
| DTT | Sigma Aldrich | 43815 | DL-Dithiothreitol |
| EGTA | Sigma Aldrich | E3889 | Ethylene glycol-bis(2-aminoethylether)-N,N,N′,N′-tetraacetic acid |
| HCl | Sigma Aldrich | 93363-500G | |
| HEPES | Sigma Aldrich | H0887 | |
| KCl | Sigma Aldrich | P9333 | |
| MgCl2 | Sigma Aldrich | M1028 | |
| NaCl | Sigma Aldrich | S7653 | |
| PCA | Sigma Aldrich | 03930590 | Protocatechuic acid |
| PCD | Sigma Aldrich | P8279 | Protocatechuate-3,4-dioxygenase |
| TMOS | Sigma Aldrich | 341436-25G | Tetramethyl orthosilicate |
| Tris-HCl | Sigma Aldrich | 93363 | |
| Trolox | Sigma Aldrich | 238813 | 6-hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid |
| 1” diameter broadband dielectric mirrors with mounts | Thorlabs | BB1-E02, KM100 | Quantity: 2 |
| ½” diameter posts | Thorlabs | TR4 | Quantity ≥ 6 |
| 10x beam expander | Thorlabs | BE10M-A | |
| 2” diameter broadband dielectric mirrors with mounts | Thorlabs | BB2-E02, KM200 | Quantity: 2 |
| 2” diameter f = 300 mm lens with mount | Thorlabs | LA1256-A, LMR2 | TIR lens |
| Fluorescent alignment target | Thorlabs | VRC2SM1 | |
| Laser safety goggles | Thorlabs | LG3 | |
| ND filter(s) | Thorlabs | FW1AND | |
| Optical beam profiler | Thorlabs | BP209-VIS | |
| Post-mounted iris diaphragm | Thorlabs | ID25 | Quantity: 2 |
| Shearing interferometer | Thorlabs | SI100 | |
| XYZ translation stage, ½” travel | Thorlabs | T12XYZ | |
| Laser | World Star Technologies | TECGL-30 | 532 nm, 30 mW |
Referências
- Abbe, E. The Relation of Aperture and Power in the Microscope. Journal of the Royal Microscopical Society. 2 (3), 300-309 (1882).
- Abbe, E. The Relation of Aperture and Power in the Microscope (continued). Journal of the Royal Microscopical Society. 2 (4), 460-473 (1882).
- Thompson, R. Precise Nanometer Localization Analysis for Individual Fluorescent Probes. Biophysical Journal. 82 (5), 2775-2783 (2002).
- Yildiz, A., et al. Myosin V Walks Hand-Over-Hand: Single Fluorophore Imaging with 1.5-nm Localization. Science. 300 (5628), 2061-2065 (2003).
- Yildiz, A., Tomishige, M., Vale, R. D., Selvin, P. R. Kinesin Walks Hand-Over-Hand. Science. 303 (5658), 676-678 (2004).
- Yildiz, A., et al. Myosin VI Steps via a Hand-over-Hand Mechanism with Its Lever Arm Undergoing Fluctuations when Attached to Actin. Journal of Biological Chemistry. 279 (36), 37223-37226 (2004).
- Yildiz, A., Selvin, P. R. Fluorescence Imaging with One Nanometer Accuracy: Application to Molecular Motors. Accounts of Chemical Research. 38 (7), 574-582 (2005).
- Toprak, E., Yildiz, A., Hoffman, M. T., Rosenfeld, S. S., Selvin, P. R. Why kinesin is so processive. Proceedings of the National Academy of Sciences. 106 (31), (2009).
- Kural, C., et al. Tracking melanosomes inside a cell to study molecular motors and their interaction. Proceedings of the National Academy of Sciences. 104 (13), 5378-5382 (2007).
- Gordon, M. P., Ha, T., Selvin, P. R. Single-molecule high-resolution imaging with photobleaching. Proceedings of the National Academy of Sciences of the United States of America. 101 (17), 6462-6465 (2004).
- Qu, X., Wu, D., Mets, L., Scherer, N. F. Nanometer-localized multiple single-molecule fluorescence microscopy. Proceedings of the National Academy of Sciences of the United States of America. 101 (31), 11298-11303 (2004).
- Churchman, L. S., Ökten, Z., Rock, R. S., Dawson, J. F., Spudich, J. A. Single molecule high-resolution colocalization of Cy3 and Cy5 attached to macromolecules measures intramolecular distances through time. Proceedings of the National Academy of Sciences of the United States of America. 102 (5), 1419-1423 (2005).
- Huang, B., Wang, W., Bates, M., Zhuang, X. Three-Dimensional Super-Resolution Imaging by Stochastic Optical Reconstruction Microscopy. Science. 319 (5864), 810-813 (2008).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nat Meth. 3 (10), 793-796 (2006).
- Bates, M., Huang, B., Dempsey, G. T., Zhuang, X. Multicolor Super-Resolution Imaging with Photo-Switchable Fluorescent Probes. Science. 317 (5845), 1749-1753 (2007).
- Betzig, E., et al. Imaging Intracellular Fluorescent Proteins at Nanometer Resolution. Science. 313 (5793), 1642-1645 (2006).
- Abramoff, M. D., Magalhães, P. J., Ram, S. J. Image processing with ImageJ. Biophotonics international. 11 (7), 36-42 (2004).
- Enderlein, J., Toprak, E., Selvin, P. R. Polarization effect on position accuracy of fluorophore localization. Optics Express. 14 (18), 8111-8120 (2006).
- Cheezum, M. K., Walker, W. F., Guilford, W. H. Quantitative comparison of algorithms for tracking single fluorescent particles. Biophysical Journal. 81 (4), 2378-2388 (2001).
- Rasnik, I., McKinney, S. A., Ha, T. Nonblinking and long-lasting single-molecule fluorescence imaging. Nature Methods. 3 (11), 891-893 (2006).
- Zhuang, X., et al. A Single-Molecule Study of RNA Catalysis and Folding. Science. 288 (5473), 2048-2051 (2000).
- Aitken, C. E., Marshall, R. A., Puglisi, J. D. An Oxygen Scavenging System for Improvement of Dye Stability in Single-Molecule Fluorescence Experiments. Biophysical Journal. 94 (5), 1826-1835 (2008).

