التصوير مضان مع نانومتر دقة واحدة (FIONA)
Summary
يمكن أن تكون مترجمة fluorophores واحدة مع الدقة نانومتر باستخدام FIONA. هنا يقال ملخصا لتقنية FIONA، وكيفية إجراء التجارب FIONA يوصف.
Abstract
مضان التصوير بدقة نانومتر واحد (FIONA) هو تقنية بسيطة ولكنها مفيدة لتوطين fluorophores واحدة مع الدقة نانومتر في الطائرة س ص. هنا ملخص للتقنية FIONA يقال ويتم وصف أمثلة على البحوث التي تم تنفيذها باستخدام FIONA فترة وجيزة. أولا، كيفية إعداد المعدات اللازمة لإجراء التجارب FIONA، أي مجموع الداخلية انعكاس مضان المجهري (TIRFM)، مع تفاصيل عن محاذاة البصريات، يوصف. ثم كيفية إجراء التجربة FIONA بسيطة على توطين وظائفها و Cy3-DNA الجزيئات واحدة باستخدام البروتوكولات المناسبة، تليها استخدام FIONA لقياس 36 نانومتر حجم الخطوة من الميوسين اقتطاع فرجينيا محرك واحد وصفت مع نقطة الكم، ويتضح. وأخيرا، يقال جهد مؤخرا لتوسيع نطاق تطبيق FIONA لعينات سميكة. وتبين أن، وذلك باستخدام الهدف الغمر بالماء ونقاط الكم غارقة في عمق المواد الهلامية سول وقرنيات العين أرنب (>200 ميكرون)، والدقة توطين 2-3 نانومتر يمكن تحقيقه.
Introduction
حوالي عام 1882، وجدت إرنست آبي أن حل المجهر الضوء المرئي هو ~ λ / 2NA، أو ~ 200 نانومتر (حيث λ هو الطول الموجي وNA هي الفتحة العددية) 1،2. لذا فإن أي كائن أصغر من هذا البعد سوف تظهر كبقعة محدودة الحيود في المجهر الضوئي. ومع ذلك، فمن الممكن لتحديد مركز البقعة، وهذا هو، والموقع من وجوه، مع دقة أعلى بكثير 3. مضان التصوير بدقة نانومتر واحد (FIONA) هو تقنية بسيطة ولكنها مفيدة لتوطين fluorophores واحدة مع الدقة نانومتر في الطائرة س ص 4. دقة الترجمة، σ μ (أي الخطأ المعياري للمتوسط)، ويعتمد على عدد الفوتونات التي تم جمعها، 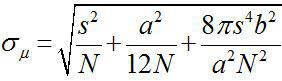 حيث N هو عدد الفوتون، S هو الانحراف المعياري للبقعة الفلورسنت، وغيرحجم بكسل للكشف والتصوير، وب هو الانحراف المعياري للخلفية 3،4. لfluorophore انبعاث الفوتونات ~ 10،000، يمكن تحقيق FIONA ~ 1 نانومتر الدقة 4.
حيث N هو عدد الفوتون، S هو الانحراف المعياري للبقعة الفلورسنت، وغيرحجم بكسل للكشف والتصوير، وب هو الانحراف المعياري للخلفية 3،4. لfluorophore انبعاث الفوتونات ~ 10،000، يمكن تحقيق FIONA ~ 1 نانومتر الدقة 4.
FIONA يمكن استخدامها لتحديد بدقة موقف باعث ثابت أو متحرك واحد (على افتراض الصور يمكن اتخاذها بسرعة كافية). FIONA يمكن تطبيقها بالتتابع إلى الإطارات من الفيلم وبالتالي تتبع حركة جزيء واحد 4- 8. قد تكون الكواشف-صور الوقائية اللازمة لضمان أن العينة لا التحلل الضوئي. وعلاوة على ذلك، الكائن الفلورسنت نفسها قد تكون من أي حجم، أصغر أو أكبر من حيود limit- على سبيل المثال، قد تتكون من عضية (~ 1 ميكرون) مع العديد من البروتينات الفلورية فرقت على غشاء لها. باستخدام FIONA لا تزال تسفر عن دقيقة جدا (نانومتر) بمعدل متوسط الوسط من كتلته. تحسن كبير في دقة الترجمة من قبل FIONA يسمح حل nanomeالحركات ثالثا النطاق مع مرور الوقت. وقد دفع هذا المجهر في طول النطاق الجزيئي 4- 8.
منذ اختراع لها، وقد تم تطوير أنواع من FIONA. على سبيل المثال، والتصوير مشرق الميدان مع دقة نانومتر واحد (bFIONA) 9، وهو البديل طفيف FIONA والصور ويموضع الأجسام الكثيفة مثل الأجسام الصباغية في الجسم الحي (الأجسام الداكنة التي تحتوي على صبغة الميلانين) مع الضوء المرسل. بالإضافة إلى ذلك، واستخدمت FIONA لحل الأصباغ متعددة. على سبيل المثال، واحد جزيء التصوير ذات الدقة العالية مع photobleaching من (الجمبري) 10،11 أو واحد جزيء عالية الدقة colocalization (SHREC) وقد وضعت 12 لحل اثنين من الأصباغ خلال حوالي 10 نانومتر. (لاحظ أن هذا هو القرار، أي كيف يمكن للمرء أن أقول بدقة الأصباغ بصرف النظر متطابقة.) وفي الآونة الأخيرة، ساهم تحليل FIONA لعملية توطين معين فائقة قرار المجهري مثل ريكو البصرية العشوائيةالمجهر nstruction (STORM) 13- 15 و تنشيط صورة توطين المجهري (النخيل) 16، التي fluorophores المظلمة المؤقتة متحمس، ثم يتم ترجمة مضان. بواسطة مثيرة مرارا كثافة منخفضة نسبيا من الأصباغ (أقل من واحد في الحيود بقعة محدودة)، ثم جمع مضان، وتحليل كل منهم FIONA، يمكن للمرء بناء على خريطة عالية الدقة. القرار بعد ذلك يقتصر على عدد الفوتونات كل صبغ يضع بها، فضلا عن أشياء مثل الحفاظ على عينة ثابتة (بما في ذلك، على سبيل المثال، المسرح المجهر) خلال عملية الاستحواذ.
في هذه الورقة، ملخصا لتقنية FIONA وصفا موجزا أمثلة على البحوث التي تم تنفيذها باستخدام يقال FIONA. أولا، كيفية إعداد المعدات اللازمة لإجراء التجارب FIONA، أي مجموع الداخلية انعكاس مضان المجهري (TIRFM)، مع تفاصيل عن محاذاة البصريات، يوصف. ثم كيف لتنفيذ تجربة FIONA بسيطة على توطين وظائفها و Cy3-DNA الجزيئات واحدة باستخدام البروتوكولات الملائمة، ويتضح. بعد ذلك، واستخدام FIONA لقياس 36 نانومتر حجم الخطوة من الميوسين اقتطاع فرجينيا محرك واحد وصفت مع الكم نقطة وتقدم. ميوسين فرجينيا هو بروتين محرك processive الضروري الذي يحمل البضائع الخلوية بينما translocating على طول خيوط الأكتين. هنا يتم استخدام ميوسين فرجينيا بناء اقتطاع لإزالة مجالات لا علاقة لها حجم الخطوة، ومع علامة FLAG تضاف إلى C-محطة للسماح سهولة وضع العلامات مع نقاط الكم بين functionalized مع الأجسام المضادة لمكافحة FLAG. تتم هذه التجربة في ظل انخفاض ATP لإبطاء الميوسين والسماح باستخدام الطويلة مرات التعرض كافية للحصول على عدد الفوتون جيد في كل إطار. يمكن استبدال أي تسمية الفلورسنت مشرقة بما فيه الكفاية في البروتوكول التالي. وأخيرا، يقال جهد مؤخرا توسيع نطاق تطبيق FIONA لعينات سميكة. كمبدأ إثبات صحة، كانت غارقة نقاط الكمالمواد الهلامية في سول والقرنيات أرنب العين ثم تصويرها والمحلية باستخدام FIONA. للتصوير، هدفا غمر المياه 60X مع NA = 1.2 كان يستخدم لهذا الهدف وعلى مسافة عمل أطول مما كانت سابقا 100X الهدف الغمر النفط. لتعويض الخسارة في التكبير في الهدف، تم إدراج عدسة التكبير خارج (3.3X 4.0X أو) في مسار الانبعاثات. بالإضافة إلى ذلك، برنامج التحصين الموسع ومضان (لا TIR) يحتاج المجهري لاستخدامها للوصول إلى المناطق العميقة في عينات سميكة. يتبين أن نقاط الكم غارقة في عمق المواد الهلامية سول والقرنيات أرنب العين (Z> 200 ميكرون) يمكن أن تكون مترجمة 2-3 مع الدقة نانومتر.
Protocol
Representative Results
Discussion
FIONA هي تقنية في توطين موقف باعث الفلورسنت (fluorophore العضوي أو الكم نقطة) مع الدقة نانومتر والقرار الزماني وصولا الى 1 ميللي ثانية 4- 8. عندما يتم جمع ما يكفي من الفوتونات، وهذا الأسلوب يسمح لتحديد موقف باعث الفلورسنت أكثر دقة بكثير من الحد حيود (~ 200 نانومتر)، وبالتالي …
Declarações
The authors have nothing to disclose.
Acknowledgements
وأيد هذا العمل من قبل المعاهد الوطنية للصحة 068625 المنح والمنح جبهة الخلاص الوطني 1063188 ومركز الفيزياء الخلايا الحية 0822613. شكر خاص للدكتور مرسى مارجانوفيتش في معهد بيكمان للعلوم والتقنية المتقدمة لهدية من عيون الأرانب.
Materials
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| Double-sided tape | 3M | — | ~ 75 um thick |
| EMCCD camera | Andor Technology | DU-897E-CS0-#BV | |
| Ultrasonic cleaner | Branson | 2510 | |
| Fluorescence filter set | Chroma | 49016 | |
| Actin polymerization buffer | Cytoskeleton | BSA02 | |
| Biotin G-actin | Cytoskeleton | AB07 | |
| G-actin | Cytoskeleton | AKL95 | |
| General actin buffer | Cytoskeleton | BSA01 | |
| Laser shutter (with driver) | Electro-Optical Products Corp. | SH-10-MP | |
| IDL | Exelis Visual Information Solutions | — | |
| Neutravidin | Fisher Scientific | PI-31000 | |
| Coverslip | Fisherbrand | 22X30-1.5 | 0.16-0.19 mm thick |
| Microscope slide | Gold Seal Microslides | 30103X1 | 0.93-1.05 mm thick |
| Plasma cleaner | Harrick Plasma | PDC-001 | |
| Glass bottom dish | In Vitro Scientific | D35-20-1.5-N | |
| Cy3-DNA oligos | Integrated DNA Technologies | — | 5'-Cy3/GCCTCGCTGCCGTCGCCA-3'Bio |
| Fluorescent beads | Invitrogen | T-7280 | |
| Qdot 605-streptavidin | Invitrogen | Q10101MP | |
| Qdot605 | Invitrogen | Q21301MP | |
| Qdot705 | Invitrogen | Q22021MP | |
| Qdot705 Antibody Conjugation Kit | Invitrogen | Q22061MP | |
| Matlab | MathWorks | — | |
| Optical table | Newport Corp | — | RS4000 Series |
| 60X Objective | Nikon | Plan Apo VC 60x WI | |
| 100X Objective | Olympus | PlanApo 100X/1.45 Oil ∞/0.17 | |
| 60X Objective | Olympus | UPlanApo 60X/1.20W | |
| Inverted microscope | Olympus | IX71/IX70/IX81 | |
| Origin | OriginLab | — | |
| Anti-FLAG antibody | Sigma Aldrich | F7425-.2MG | |
| ATP | Sigma Aldrich | A7699 | |
| BME | Sigma Aldrich | 63689-25ML-F | |
| BSA | Sigma Aldrich | A7906 | |
| BSA-biotin | Sigma Aldrich | A8549-10MG | |
| CK | Sigma Aldrich | C3755 | Creatine Phosphokinase from rabbit muscle |
| CP | Sigma Aldrich | P1937 | Phosphocreatine di(tris) salt |
| DTT | Sigma Aldrich | 43815 | DL-Dithiothreitol |
| EGTA | Sigma Aldrich | E3889 | Ethylene glycol-bis(2-aminoethylether)-N,N,N′,N′-tetraacetic acid |
| HCl | Sigma Aldrich | 93363-500G | |
| HEPES | Sigma Aldrich | H0887 | |
| KCl | Sigma Aldrich | P9333 | |
| MgCl2 | Sigma Aldrich | M1028 | |
| NaCl | Sigma Aldrich | S7653 | |
| PCA | Sigma Aldrich | 03930590 | Protocatechuic acid |
| PCD | Sigma Aldrich | P8279 | Protocatechuate-3,4-dioxygenase |
| TMOS | Sigma Aldrich | 341436-25G | Tetramethyl orthosilicate |
| Tris-HCl | Sigma Aldrich | 93363 | |
| Trolox | Sigma Aldrich | 238813 | 6-hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid |
| 1” diameter broadband dielectric mirrors with mounts | Thorlabs | BB1-E02, KM100 | Quantity: 2 |
| ½” diameter posts | Thorlabs | TR4 | Quantity ≥ 6 |
| 10x beam expander | Thorlabs | BE10M-A | |
| 2” diameter broadband dielectric mirrors with mounts | Thorlabs | BB2-E02, KM200 | Quantity: 2 |
| 2” diameter f = 300 mm lens with mount | Thorlabs | LA1256-A, LMR2 | TIR lens |
| Fluorescent alignment target | Thorlabs | VRC2SM1 | |
| Laser safety goggles | Thorlabs | LG3 | |
| ND filter(s) | Thorlabs | FW1AND | |
| Optical beam profiler | Thorlabs | BP209-VIS | |
| Post-mounted iris diaphragm | Thorlabs | ID25 | Quantity: 2 |
| Shearing interferometer | Thorlabs | SI100 | |
| XYZ translation stage, ½” travel | Thorlabs | T12XYZ | |
| Laser | World Star Technologies | TECGL-30 | 532 nm, 30 mW |
Referências
- Abbe, E. The Relation of Aperture and Power in the Microscope. Journal of the Royal Microscopical Society. 2 (3), 300-309 (1882).
- Abbe, E. The Relation of Aperture and Power in the Microscope (continued). Journal of the Royal Microscopical Society. 2 (4), 460-473 (1882).
- Thompson, R. Precise Nanometer Localization Analysis for Individual Fluorescent Probes. Biophysical Journal. 82 (5), 2775-2783 (2002).
- Yildiz, A., et al. Myosin V Walks Hand-Over-Hand: Single Fluorophore Imaging with 1.5-nm Localization. Science. 300 (5628), 2061-2065 (2003).
- Yildiz, A., Tomishige, M., Vale, R. D., Selvin, P. R. Kinesin Walks Hand-Over-Hand. Science. 303 (5658), 676-678 (2004).
- Yildiz, A., et al. Myosin VI Steps via a Hand-over-Hand Mechanism with Its Lever Arm Undergoing Fluctuations when Attached to Actin. Journal of Biological Chemistry. 279 (36), 37223-37226 (2004).
- Yildiz, A., Selvin, P. R. Fluorescence Imaging with One Nanometer Accuracy: Application to Molecular Motors. Accounts of Chemical Research. 38 (7), 574-582 (2005).
- Toprak, E., Yildiz, A., Hoffman, M. T., Rosenfeld, S. S., Selvin, P. R. Why kinesin is so processive. Proceedings of the National Academy of Sciences. 106 (31), (2009).
- Kural, C., et al. Tracking melanosomes inside a cell to study molecular motors and their interaction. Proceedings of the National Academy of Sciences. 104 (13), 5378-5382 (2007).
- Gordon, M. P., Ha, T., Selvin, P. R. Single-molecule high-resolution imaging with photobleaching. Proceedings of the National Academy of Sciences of the United States of America. 101 (17), 6462-6465 (2004).
- Qu, X., Wu, D., Mets, L., Scherer, N. F. Nanometer-localized multiple single-molecule fluorescence microscopy. Proceedings of the National Academy of Sciences of the United States of America. 101 (31), 11298-11303 (2004).
- Churchman, L. S., Ökten, Z., Rock, R. S., Dawson, J. F., Spudich, J. A. Single molecule high-resolution colocalization of Cy3 and Cy5 attached to macromolecules measures intramolecular distances through time. Proceedings of the National Academy of Sciences of the United States of America. 102 (5), 1419-1423 (2005).
- Huang, B., Wang, W., Bates, M., Zhuang, X. Three-Dimensional Super-Resolution Imaging by Stochastic Optical Reconstruction Microscopy. Science. 319 (5864), 810-813 (2008).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nat Meth. 3 (10), 793-796 (2006).
- Bates, M., Huang, B., Dempsey, G. T., Zhuang, X. Multicolor Super-Resolution Imaging with Photo-Switchable Fluorescent Probes. Science. 317 (5845), 1749-1753 (2007).
- Betzig, E., et al. Imaging Intracellular Fluorescent Proteins at Nanometer Resolution. Science. 313 (5793), 1642-1645 (2006).
- Abramoff, M. D., Magalhães, P. J., Ram, S. J. Image processing with ImageJ. Biophotonics international. 11 (7), 36-42 (2004).
- Enderlein, J., Toprak, E., Selvin, P. R. Polarization effect on position accuracy of fluorophore localization. Optics Express. 14 (18), 8111-8120 (2006).
- Cheezum, M. K., Walker, W. F., Guilford, W. H. Quantitative comparison of algorithms for tracking single fluorescent particles. Biophysical Journal. 81 (4), 2378-2388 (2001).
- Rasnik, I., McKinney, S. A., Ha, T. Nonblinking and long-lasting single-molecule fluorescence imaging. Nature Methods. 3 (11), 891-893 (2006).
- Zhuang, X., et al. A Single-Molecule Study of RNA Catalysis and Folding. Science. 288 (5473), 2048-2051 (2000).
- Aitken, C. E., Marshall, R. A., Puglisi, J. D. An Oxygen Scavenging System for Improvement of Dye Stability in Single-Molecule Fluorescence Experiments. Biophysical Journal. 94 (5), 1826-1835 (2008).

