Fluorescentie Imaging met One-nanometer nauwkeurigheid (FIONA)
Summary
Single fluoroforen kunnen worden gelokaliseerd met nanometer precisie met behulp van FIONA. Hier een overzicht van de FIONA techniek is gemeld, en hoe FIONA experimenten uit te voeren wordt beschreven.
Abstract
Fluorescentie beeldvorming met een-nanometer nauwkeurigheid (FIONA) is een eenvoudige, maar nuttige techniek voor het lokaliseren van enkele fluoroforen met nanometer precisie in het xy-vlak. Hier een overzicht van de FIONA techniek gemeld en voorbeelden van onderzoek dat is uitgevoerd met FIONA worden kort beschreven. Ten eerste, hoe het opzetten van de benodigde apparatuur voor FIONA experimenten, dat wil zeggen, een totale interne reflectie fluorescentie microscopie (TIRFM), met informatie over het uitlijnen van de optica, wordt beschreven. Dan hoe een simpele FIONA experiment uitvoeren aan lokaliseren geïmmobiliseerd Cy3-coderende enkelvoudige moleculen met geschikte protocols, gevolgd door de toepassing van FIONA de 36 nm stapgrootte van een afgeknotte myosine Va motor voorzien van een quantum dot meten geïllustreerd. Tenslotte wordt recente poging om de toepassing van FIONA breiden dikke monsters gerapporteerd. Het blijkt dat met behulp van een water immersie objectief en quantum dots gedrenkt diep in sol-gels en konijnenogen cornea (>200 urn), lokalisatie nauwkeurigheid van 2-3 nm worden bereikt.
Introduction
Rond 1882, Ernst Abbe vond dat de resolutie van een lichtmicroscoop zichtbaar is ~ λ / 2NA, of ~ 200 nm (waarbij λ is de golflengte en NA de numerieke lensopening) 1,2. Daarom geven object kleiner dan de afmeting lijkt als een buigingsbegrensde vlek in een optische microscoop. Het is echter mogelijk om te bepalen het midden van de spot, dat wil zeggen de locatie van het object, met een veel hogere precisie 3. Fluorescentie beeldvorming met een-nanometer nauwkeurigheid (FIONA) is een eenvoudige, maar nuttige techniek voor het lokaliseren van enkele fluoroforen met nanometer precisie in het xy-vlak 4. De nauwkeurigheid van de lokalisatie, σ μ (dwz, de standaardfout van het gemiddelde), afhankelijk van het totale aantal verzamelde fotonen, 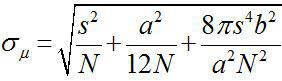 , Waarbij N het aantal fotonen, s is de standaardafwijking van de fluorescerende spot, ade pixelgrootte van de beeldvormende detector, en b de standaarddeviatie van de achtergrond 3,4. Voor een fluorofoor uitzendt ~ 10.000 fotonen, kan FIONA ~ 1 nm precisie 4 bereiken.
, Waarbij N het aantal fotonen, s is de standaardafwijking van de fluorescerende spot, ade pixelgrootte van de beeldvormende detector, en b de standaarddeviatie van de achtergrond 3,4. Voor een fluorofoor uitzendt ~ 10.000 fotonen, kan FIONA ~ 1 nm precisie 4 bereiken.
FIONA kunnen worden gebruikt om de positie van een stationaire zender of een bewegend on (uitgaande beelden kunnen snel genoeg worden genomen) nauwkeurig te bepalen. FIONA kunnen achtereenvolgens worden toegepast op de frames van de film en dus volgen de beweging van de enkel molecuul 4-8. Foto-beschermende reagentia moeten worden gezorgd dat het monster geen photodegrade. Bovendien kan het fluorescerende voorwerp zelf van elke grootte, kleiner of groter dan de diffractie limietsystemen bijvoorbeeld kan bestaan uit een organel (~ 1 pm) met veel fluorescerende eiwitten verspreid over de membraan. Met behulp van FIONA kan nog steeds leveren een zeer nauwkeurig (nanometer) gemiddelde van de gemiddelde midden-van-massa. De grote verbetering in lokalisatie precisie door Fiona laat oplossen nanometer-schaal bewegingen in de tijd. Dit heeft microscopie geduwd in de moleculaire lengte schaal 4-8.
Sinds de uitvinding, zijn varianten van FIONA ontwikkeld. Bijvoorbeeld, bright-field imaging met een-nanometer nauwkeurigheid (bFIONA) 9, een lichte variant van FIONA, afbeeldingen en lokaliseert dichte objecten zoals melanosomen in vivo (donkere voorwerpen die het pigment melanine) met doorvallend licht. Daarnaast is FIONA toegepast om meerdere kleurstoffen lossen. Bijvoorbeeld, single-molecule hoge resolutie beeldvorming met fotobleken (garnalen) 10,11 of single-molecule hoge resolutie colocalization (SHREC) 12 ontwikkeld twee kleurstoffen opgelost binnen ongeveer 10 nm. (Merk op dat dit besluit, dat wil zeggen hoe nauwkeurig een identieke kleurstoffen uit elkaar kunnen houden.) Meer recent heeft FIONA analyse bijgedragen aan de lokalisatie proces van bepaalde super-resolutie microscopie zoals stochastische optische reconstruction microscopie (STORM) 13-15 en foto-geactiveerde lokalisatie microscopie (PALM) 16, waarin tijdelijke donkere fluoroforen zijn enthousiast, en vervolgens de fluorescentie is gelokaliseerd. Door herhaaldelijk opwindende relatief lage dichtheid van kleurstoffen (minder dan een per diffractie beperkte spot), en vervolgens het verzamelen van de fluorescentie, onderzoekt al hun door FIONA, kan men opbouwen van een hoge resolutie map. De resolutie wordt dan alleen beperkt door het aantal fotonen per kleurstof steekt, evenals zaken als het bijhouden van de steekproef stationaire (waaronder bijvoorbeeld de microscoop podium) tijdens de overname.
In dit artikel een samenvatting van de FIONA techniek en een korte beschrijving van voorbeelden van onderzoek dat is uitgevoerd met behulp van FIONA wordt gemeld. Ten eerste, hoe het opzetten van de benodigde apparatuur voor FIONA experimenten, dat wil zeggen, een totale interne reflectie fluorescentie microscopie (TIRFM), met informatie over het uitlijnen van de optica, wordt beschreven. Maar ook hoe uhet uitvoeren van een eenvoudige FIONA experiment op het lokaliseren van geïmmobiliseerd Cy3- DNA enkele moleculen met behulp van de juiste protocollen, wordt geïllustreerd. Daarna gebruik van FIONA de 36 nm stapgrootte van een afgeknotte myosine Va motor voorzien van een quantum dot meten gepresenteerd. Myosine Va is een essentieel processief motor eiwit dat cellulaire lading vervoert terwijl translocerende langs actine filamenten. Hier een myosine Va construct afgeknot wordt gebruikt domeinen irrelevant voor de stapgrootte te verwijderen, en met een FLAG tag toegevoegd aan het C-uiteinde tot eenvoudige labeling met quantum dots gefunctionaliseerd met anti-FLAG-antilichamen mogelijk. Dit experiment gebeurt onder lage ATP te vertragen myosine en maken het gebruik van lange belichtingstijden genoeg om een goede foton telling te krijgen in elk frame. Elke voldoende fel fluorescerend label kan worden vervangen in het volgende protocol. Ten slotte is de laatste poging van de uitbreiding van de toepassing van FIONA dikke monsters gemeld. Als principe proof-of-werden quantum dots geweektin sol-gel en konijn ogen hoornvliezen en vervolgens gescand en gelokaliseerd met behulp van FIONA. Voor beeldvorming, een 60X water immersie objectief met NA = 1.2 werd gebruikt, omdat deze doelstelling heeft een langere afstand dan voorheen 100x olie-immersie objectief. Om het verlies in de vergroting te compenseren in de doelstelling, een extra vergroting lens (3,3 maal of 4.0X) werd ingebracht in de emissie-pad. Bovendien epi-fluorescentie (niet TIR) microscopie moet worden gebruikt om diepe gebieden in de dikke monsters. Er wordt aangetoond dat quantum dots gedrenkt diep in sol-gels en in konijnenogen cornea (Z> 200 um) kan worden gelokaliseerd met 2-3 nm nauwkeurig.
Protocol
Representative Results
Discussion
FIONA is een techniek om de positie van een fluorescent emitter (organische fluorofoor of quantum dot) met nanometer nauwkeurigheid en tijdsresolutie tot 1 msec 4-8 lokaliseren. Wanneer voldoende fotonen worden verzameld, deze techniek maakt het mogelijk de positie van een fluorescent emitter veel nauwkeuriger dan de diffractielimiet (~ 200 nm) te bepalen en dus deze techniek opent een manier te observeren wat niet gezien conventionele / traditionele optische microscopie 4 – 8. Sinds de uitvinding …
Declarações
The authors have nothing to disclose.
Acknowledgements
Dit werk werd ondersteund door NIH Grants 068.625, NSF subsidies 1.063.188 en het centrum van de fysica van levende cellen 0822613. Speciale dank gaat uit naar Dr Marina Marjanovic in Beckman Institute for Advanced Science and Technology voor de gave van de ogen van konijnen.
Materials
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| Double-sided tape | 3M | — | ~ 75 um thick |
| EMCCD camera | Andor Technology | DU-897E-CS0-#BV | |
| Ultrasonic cleaner | Branson | 2510 | |
| Fluorescence filter set | Chroma | 49016 | |
| Actin polymerization buffer | Cytoskeleton | BSA02 | |
| Biotin G-actin | Cytoskeleton | AB07 | |
| G-actin | Cytoskeleton | AKL95 | |
| General actin buffer | Cytoskeleton | BSA01 | |
| Laser shutter (with driver) | Electro-Optical Products Corp. | SH-10-MP | |
| IDL | Exelis Visual Information Solutions | — | |
| Neutravidin | Fisher Scientific | PI-31000 | |
| Coverslip | Fisherbrand | 22X30-1.5 | 0.16-0.19 mm thick |
| Microscope slide | Gold Seal Microslides | 30103X1 | 0.93-1.05 mm thick |
| Plasma cleaner | Harrick Plasma | PDC-001 | |
| Glass bottom dish | In Vitro Scientific | D35-20-1.5-N | |
| Cy3-DNA oligos | Integrated DNA Technologies | — | 5'-Cy3/GCCTCGCTGCCGTCGCCA-3'Bio |
| Fluorescent beads | Invitrogen | T-7280 | |
| Qdot 605-streptavidin | Invitrogen | Q10101MP | |
| Qdot605 | Invitrogen | Q21301MP | |
| Qdot705 | Invitrogen | Q22021MP | |
| Qdot705 Antibody Conjugation Kit | Invitrogen | Q22061MP | |
| Matlab | MathWorks | — | |
| Optical table | Newport Corp | — | RS4000 Series |
| 60X Objective | Nikon | Plan Apo VC 60x WI | |
| 100X Objective | Olympus | PlanApo 100X/1.45 Oil ∞/0.17 | |
| 60X Objective | Olympus | UPlanApo 60X/1.20W | |
| Inverted microscope | Olympus | IX71/IX70/IX81 | |
| Origin | OriginLab | — | |
| Anti-FLAG antibody | Sigma Aldrich | F7425-.2MG | |
| ATP | Sigma Aldrich | A7699 | |
| BME | Sigma Aldrich | 63689-25ML-F | |
| BSA | Sigma Aldrich | A7906 | |
| BSA-biotin | Sigma Aldrich | A8549-10MG | |
| CK | Sigma Aldrich | C3755 | Creatine Phosphokinase from rabbit muscle |
| CP | Sigma Aldrich | P1937 | Phosphocreatine di(tris) salt |
| DTT | Sigma Aldrich | 43815 | DL-Dithiothreitol |
| EGTA | Sigma Aldrich | E3889 | Ethylene glycol-bis(2-aminoethylether)-N,N,N′,N′-tetraacetic acid |
| HCl | Sigma Aldrich | 93363-500G | |
| HEPES | Sigma Aldrich | H0887 | |
| KCl | Sigma Aldrich | P9333 | |
| MgCl2 | Sigma Aldrich | M1028 | |
| NaCl | Sigma Aldrich | S7653 | |
| PCA | Sigma Aldrich | 03930590 | Protocatechuic acid |
| PCD | Sigma Aldrich | P8279 | Protocatechuate-3,4-dioxygenase |
| TMOS | Sigma Aldrich | 341436-25G | Tetramethyl orthosilicate |
| Tris-HCl | Sigma Aldrich | 93363 | |
| Trolox | Sigma Aldrich | 238813 | 6-hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid |
| 1” diameter broadband dielectric mirrors with mounts | Thorlabs | BB1-E02, KM100 | Quantity: 2 |
| ½” diameter posts | Thorlabs | TR4 | Quantity ≥ 6 |
| 10x beam expander | Thorlabs | BE10M-A | |
| 2” diameter broadband dielectric mirrors with mounts | Thorlabs | BB2-E02, KM200 | Quantity: 2 |
| 2” diameter f = 300 mm lens with mount | Thorlabs | LA1256-A, LMR2 | TIR lens |
| Fluorescent alignment target | Thorlabs | VRC2SM1 | |
| Laser safety goggles | Thorlabs | LG3 | |
| ND filter(s) | Thorlabs | FW1AND | |
| Optical beam profiler | Thorlabs | BP209-VIS | |
| Post-mounted iris diaphragm | Thorlabs | ID25 | Quantity: 2 |
| Shearing interferometer | Thorlabs | SI100 | |
| XYZ translation stage, ½” travel | Thorlabs | T12XYZ | |
| Laser | World Star Technologies | TECGL-30 | 532 nm, 30 mW |
Referências
- Abbe, E. The Relation of Aperture and Power in the Microscope. Journal of the Royal Microscopical Society. 2 (3), 300-309 (1882).
- Abbe, E. The Relation of Aperture and Power in the Microscope (continued). Journal of the Royal Microscopical Society. 2 (4), 460-473 (1882).
- Thompson, R. Precise Nanometer Localization Analysis for Individual Fluorescent Probes. Biophysical Journal. 82 (5), 2775-2783 (2002).
- Yildiz, A., et al. Myosin V Walks Hand-Over-Hand: Single Fluorophore Imaging with 1.5-nm Localization. Science. 300 (5628), 2061-2065 (2003).
- Yildiz, A., Tomishige, M., Vale, R. D., Selvin, P. R. Kinesin Walks Hand-Over-Hand. Science. 303 (5658), 676-678 (2004).
- Yildiz, A., et al. Myosin VI Steps via a Hand-over-Hand Mechanism with Its Lever Arm Undergoing Fluctuations when Attached to Actin. Journal of Biological Chemistry. 279 (36), 37223-37226 (2004).
- Yildiz, A., Selvin, P. R. Fluorescence Imaging with One Nanometer Accuracy: Application to Molecular Motors. Accounts of Chemical Research. 38 (7), 574-582 (2005).
- Toprak, E., Yildiz, A., Hoffman, M. T., Rosenfeld, S. S., Selvin, P. R. Why kinesin is so processive. Proceedings of the National Academy of Sciences. 106 (31), (2009).
- Kural, C., et al. Tracking melanosomes inside a cell to study molecular motors and their interaction. Proceedings of the National Academy of Sciences. 104 (13), 5378-5382 (2007).
- Gordon, M. P., Ha, T., Selvin, P. R. Single-molecule high-resolution imaging with photobleaching. Proceedings of the National Academy of Sciences of the United States of America. 101 (17), 6462-6465 (2004).
- Qu, X., Wu, D., Mets, L., Scherer, N. F. Nanometer-localized multiple single-molecule fluorescence microscopy. Proceedings of the National Academy of Sciences of the United States of America. 101 (31), 11298-11303 (2004).
- Churchman, L. S., Ökten, Z., Rock, R. S., Dawson, J. F., Spudich, J. A. Single molecule high-resolution colocalization of Cy3 and Cy5 attached to macromolecules measures intramolecular distances through time. Proceedings of the National Academy of Sciences of the United States of America. 102 (5), 1419-1423 (2005).
- Huang, B., Wang, W., Bates, M., Zhuang, X. Three-Dimensional Super-Resolution Imaging by Stochastic Optical Reconstruction Microscopy. Science. 319 (5864), 810-813 (2008).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nat Meth. 3 (10), 793-796 (2006).
- Bates, M., Huang, B., Dempsey, G. T., Zhuang, X. Multicolor Super-Resolution Imaging with Photo-Switchable Fluorescent Probes. Science. 317 (5845), 1749-1753 (2007).
- Betzig, E., et al. Imaging Intracellular Fluorescent Proteins at Nanometer Resolution. Science. 313 (5793), 1642-1645 (2006).
- Abramoff, M. D., Magalhães, P. J., Ram, S. J. Image processing with ImageJ. Biophotonics international. 11 (7), 36-42 (2004).
- Enderlein, J., Toprak, E., Selvin, P. R. Polarization effect on position accuracy of fluorophore localization. Optics Express. 14 (18), 8111-8120 (2006).
- Cheezum, M. K., Walker, W. F., Guilford, W. H. Quantitative comparison of algorithms for tracking single fluorescent particles. Biophysical Journal. 81 (4), 2378-2388 (2001).
- Rasnik, I., McKinney, S. A., Ha, T. Nonblinking and long-lasting single-molecule fluorescence imaging. Nature Methods. 3 (11), 891-893 (2006).
- Zhuang, X., et al. A Single-Molecule Study of RNA Catalysis and Folding. Science. 288 (5473), 2048-2051 (2000).
- Aitken, C. E., Marshall, R. A., Puglisi, J. D. An Oxygen Scavenging System for Improvement of Dye Stability in Single-Molecule Fluorescence Experiments. Biophysical Journal. 94 (5), 1826-1835 (2008).

