Primer voor Immunohistochemie op Cryosectioned Rat Brain Tissue: Voorbeeld kleuring voor Microglia en Neuronen
Summary
This introductory level protocol describes the reagents, equipment, and techniques required to complete immunohistochemical staining of rodent brains, using markers for microglia and neuronal elements as an example.
Abstract
Immunohistochemie is een veel gebruikte techniek om de aanwezigheid, locatie en relatieve overvloed van antigenen in situ. Deze inleidende niveau protocol beschrijft de reagentia, apparatuur en technieken die nodig zijn voor immunohistochemische kleuring van knaagdieren hersenweefsel te voltooien, met behulp van markers voor microglia en neuronale elementen als een voorbeeld. Concreet dit document is een stap-voor-stap protocol voor fluorescentie visualisatie van microglia en neuronen via immunohistochemie voor Iba1 en Pan-neuronale resp. Fluorescentie double-labeling is bijzonder bruikbaar voor de lokalisatie van meerdere eiwitten in hetzelfde monster, de mogelijkheid ontstaat om interacties tussen celsoorten, receptoren, liganden nauwkeurig observeren, en / of de extracellulaire matrix ten opzichte van elkaar en proteïne co- lokalisatie binnen een enkele cel. In tegenstelling tot andere visualisatietechnieken, kan fluorescentie immunohistochemie kleurintensiteit afnamede weken tot maanden na vlekken, tenzij passende voorzorgsmaatregelen worden genomen. Ondanks deze beperking in vele toepassingen fluorescentie double-labeling heeft de voorkeur boven alternatieven zoals 3,3'-diaminobenzidine tetrahydrochloride (DAB) of alkalisch fosfatase (AP), zoals fluorescentie tijdsefficiënter en maakt een zeer nauwkeurige onderscheiden van twee of meer markers. De discussie omvat tips voor probleemoplossing en advies om het succes te bevorderen.
Introduction
Immunohistochemie is een werkwijze voor het detecteren van antigenen (bijvoorbeeld eiwitten) in weefselsecties met primaire antilichamen die specifiek binden aan de antigenen van interesse. Immunohistochemie werd ontwikkeld door JR Marrack in 1934, toen hij bepaald dat antilichamen antigenen met grote specificiteit 1 kon lokaliseren. Beginnend in 1942, enkele eerste in vitro studies met fluorescerende antilichamen tegen immunohistochemie visualiseren gepubliceerd 2,3, waarna de eerste in vivo histochemische studie werd gepubliceerd 4. Gedurende de 1960's, dertig jaar na de start van immunohistochemische werkwijzen, begon enzym-geconjugeerde antilichamen voor gebruik als secundaire reagentia. Deze methoden werden gelijktijdig en onafhankelijk van elkaar ontwikkeld in Frankrijk en de VS 5,6. Vandaag de dag, een breed scala van antilichamen biedt eindeloze mogelijkheden voor immunohistochemie studies 7.
"> De algemene doelstelling van deze correspondentie is om een korte introductie in immunohistochemische kleuring zorgen, het is niet bedoeld om een uitgebreid en uitputtend overzicht van deze techniek in de geschetste methode worden immunohistochemische technieken voor twee antigenen gepresenteerd (markers voor microglia en. neuronen) voor kleuring paraformaldehyd geperfundeerde, sucrose cryobeschermd, cryosectioned rattenhersenen. Immunohistochemische kleuring begint blokkeermiddelen-specifieke antigeenbinding aan achtergrondkleuring te verminderen. Vervolgens incubatie met primair antilichaam zorgt voor binding aan een specifiek antigeen in het weefsel. Na het primaire antilichaam, een ander antilichaam, genaamd secundaire antilichaam wordt aan het primaire antilichaam te koppelen aan een geconjugeerd visualisatie signaal 8. Het tweede antilichaam is gericht op de immunoglobuline G (IgG) domein specifiek voor de diersoorten waarin de eerste antistof opgewekt werd. Het tweede antilichaam versterkt het signaal van het primaire antilichaam, aangezien de Fab-regio van tHij secundair antilichaam binden aan meerdere plaatsen op het IgG gebied van het primaire antilichaam. Enzymen of fluorescente moleculen geconjugeerd met de Fc-regio van het secundaire antilichaam mogelijk visualisatie. Bijvoorbeeld, een konijn anti-Iba1 primair antilichaam een konijn IgG-molecuul specifiek voor Iba1. Wanneer ezel anti-konijn IgG gebruikt als een secundair antilichaam, zal herkennen en binden aan meerdere gebieden van het konijn anti-Iba1 IgG (zie figuur 1). De ezel antilichaam kan worden gevisualiseerd door verschillende werkwijzen. Deze overeenstemming is gericht op de detectie van een fluorofoor geconjugeerd aan het tweede antilichaam, waarbij het primaire antilichaam herkent, voor visualisatie door fluorescentiemicroscopie. In fluorescerende immunohistochemie kan een nucleaire kleuring zoals Hoechst en DAPI worden gebruikt om alle kernen te visualiseren.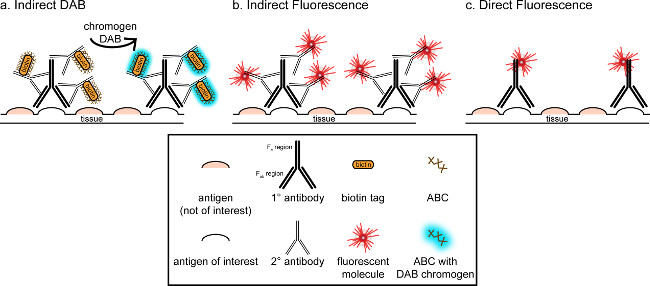
Figuur 1: SchEmatic representatie direct- en indirect antilichaam labeling technieken. Antilichamen binden aan het antigeen van belang en kan worden geamplificeerd door secundaire antilichamen opgewekt tegen de species van het primaire antilichamen. Deze techniek kan worden uitgevoerd met avidine-biotine complex (ABC) voor amplificatie en DAB visualisatie (A), of direct fluorescent geconjugeerd secundair antilichaam (B). Als alternatief kunnen primaire antilichamen direct worden geconjugeerd met veel verschillende labels, waaronder biotine of een fluorofoor (C). Klik hier om een grotere versie van deze figuur te bekijken.
Een alternatieve werkwijze voor het zichtbaar maken van immunohistochemische kleuring gebruikt 3,3'-diaminobenzidine tetrahydrochloride (DAB; zie figuren 1 pt 2). Dit verschilt van fluorescentie met behulp van een gebiotinyleerd ofhorse-radish peroxidase (HRP) geconjugeerd secundair antilichaam, dat een enzym DAB zetten naar een precipitaat dat zichtbaar is onder helderveld microscopie levert. In gevallen waarin een enkele antigeen is van belang of kleuring is verplicht langdurig te zijn, kan DAB beter geschikt zijn dan fluorescerende vlekken zijn. Echter, DAB-kleuring is niet goed geschikt voor differentiatie tussen meerdere markers, met name als twee nucleaire antigenen van belang. Voor informatie over DAB materialen en protocol modificaties raadplegen Tabel 1. Anders, nitro blauw tetrazolium chloride / 5-broom-4-chloor-3-indolylfosfaat (NBT / BCIP) kan worden gebruikt om een alkalische fosfatase (AP) geconjugeerd secundair visualiseren antilichaam.
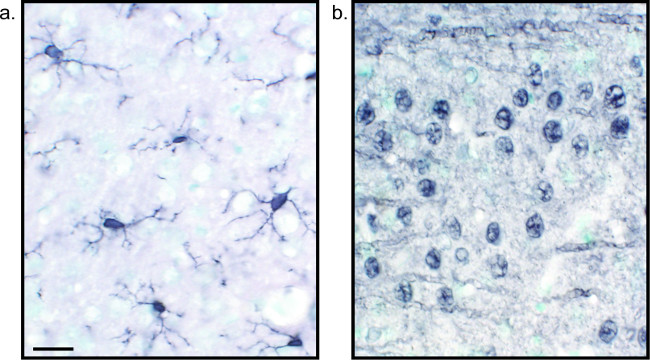
Figuur 2:. Vertegenwoordiger beelden van nikkel verbeterde DAB single-gelabeld rat hersenweefsel secties Rat hersenen seCTIES die zijn gelabeld met nikkel verbeterde DAB voor Iba1 (A) en Pan-neuronale (B) zorgen voor langdurige analyse van microglia of neuronen alleen. Schaalbalk 20 urn. Klik hier om een grotere versie van deze figuur te bekijken.
Men moet rekening houden met de geraamde omvang van het antigeen van belang in het weefsel dat wordt onderzocht. Indirecte werkwijzen (zoals hierboven beschreven) zijn nuttig voor doelen met lage abundantie. Wanneer het antigeen van interesse is in hoge overvloed, kan directe methoden worden toegepast. Direct werkwijzen omvatten een primair antilichaam dat rechtstreeks is geconjugeerd aan een visualisatie signaal en dus geen secundair antilichaam nodig. Deze werkwijze vereenvoudigt het kleurproces, maar elimineert de versterking bereikt met indirecte methoden. Met behulp van een direct geconjugeerd primair antilichaam elimineert ook cross-reactiviteit van secundaire antilichamenals dubbel-labeling.
Deze mededeling beschrijft de protocol voor double-labeling met Iba1 en Pan-neuronale (details in tabel 1). Iba1 vlekken microglia in veel activering staten, waaronder vertakte, hyper-vertakte, geactiveerde, amoeboid en staaf. Pan-neuronale vlekken neuronale axonen, dendrieten, en soma. Aangezien Iba1 vlekken meest microglia en Pan-neuronale targets het neuron, deze combinatie van vlekken is nuttig bij het verkrijgen van een breed begrip van microglia-neuron interacties.
Kortom, immunohistochemische kleuring voert de zorgvuldige selectie van antilichamen. Aangezien de vraagstelling wordt specifieker kunnen antilichamen opgewekt alternatieve antigenen wensen. Om een specifieke microgliale activeringstoestand richten, kan men kiezen om CD45 of CD68 antilichamen, in plaats van Iba1. Verder, in samenwerking met muizen, F4 / 80 kan de benodigde resultaten. Op dezelfde manier kan neuronale elementen specifiek worden gericht met antilichamen raseerde tegen de kern, synaps (pre- of post-), axon, en de groei kegel. Daarnaast zijn er andere merkers die de leeftijd van het neuron (Double-Cortin, NeuN) differentiëren en neuronale regeneratie (GAP-43).
Protocol
Representative Results
Discussion
De algemene doelstelling van deze mededeling was immunohistochemie procedures voeren om de lezer. Hiervoor heeft het voorbeeld van de dubbele labeling met Iba1 en pan-neuronale antigenen microglia en neuronen in paraformaldehyde geperfundeerde observeren, werd sucrose cryobeschermd, cryosectioned rattenhersenen gebruikt.
Deze techniek kan worden aangepast om eindeloze doeleinden. Een array van verschillende antigenen in verschillende weefseltypen zoals, maar niet beperkt tot de hersenen, lon…
Declarações
The authors have nothing to disclose.
Acknowledgements
The authors would like to thank Mr. Ryan Hart and Mr. Arriz Lucas for their invaluable feedback on this communication. This work was supported by NIH NINDS R01 NS065052 and Phoenix Children’s Hospital Mission Support Funds.
Materials
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| Fisherbrand Superfrost Plus Glass Slides | Fisher Scientific | 22-034-979 | Used for tissue mounting (1.2.2) |
| Oven | Thermo Scientific | 51028112 | Used for tissue drying (2.1.1) |
| Mini Pap pen | Life Technologies | 00-8877 | Used in step 2.2.2 |
| Andwin Scientific Tissue-tek Slide Staining Dish | Fisher Scientific | 22-149-429 | Used for all washes during staining (2.2), as well as the Hoechst step (2.2.8) |
| Kimwipes | Fisher Scientific | 06-666-A | Used for drying slides (2.2) |
| Black Staining Box | Ted Pella | 21050 | Used for blocking and staining steps (2.2) |
| Normal Donkey Serum | Fisher Scientific | 50-413-253 | Used for block and antibody incubation (2.2) |
| Mouse α-Pan-neuronal | Millipore | MAB2300 | Used for primary antibody (2.2.4) |
| Rabbit α-Iba1 | Wako Chemical | 019-19741 | Used for primary antibody (2.2.4) |
| Donkey α-Rabbit 594 | Jackson ImmunoResearch | 711-585-152 | Used for secondary antibody (2.2.6) |
| Donkey α-mouse 488 | Jackson ImmunoResearch | 715-545-150 | Used for secondary antibody (2.2.6) |
| Caterer's foil | Any | N/A | Used in steps 1.2.2 and 2.3.2 |
| Fluoromount-G | Southern Biotech | 0100-01 | Used for coverslipping (2.2.8) |
| Coverslips | Fisher Scientific | 12544E | Used for coverslipping (2.2.8) |
| Clear Nail Polish | Any | N/A | Used for coverslipping (2.2.8) |
| Axio Observer.Z1 and LSM 710 (laser scanning, confocal) | Carl Zeiss | N/A | Used for imaging (3) |
| Axioskop A2 | Carl Zeiss | N/A | Used for imaging (3) |
| CitriSolv | FisherScientific | For DAB protocol | |
| ABC | Vector Laboratories | PK-6100 | For DAB protocol |
| DAB Peroxidase kit | Vector Laboratories | SK-4100 | For DAB protocol |
| Biotinylated horse α-rabbit IgG | Vector Laboratories | BA-1100 | For DAB protocol |
| Biotinylated horse α-mouse IgG | Vector Laboratories | BA-2001 | For DAB protocol |
| 30% Hydrogen Peroxide | FisherScientific | H325-500 | For DAB protocol |
| Wheaton slide racks and staining dishes | TedPella | 21043 | For DAB protocol |
| Masterflex perfusion pump and tubing | Cole-Parmer | Used for perfusion (1.1.1 and 1.1.2) | |
| Andwin scientific tissue-tek CRYO-OCT compound (case of 12) | Fisher Scientific | 14-373-65 | Used for tissue freezing (1.2.1) |
| Thermometer (-50 to 50 C) | Fisher Scientific | 15-059-228 | Used for tissue freezing (1.2.1) |
| Cryostat | Leica | CM3500S | Used for tissue sectioning (1.2.2) |
| Staining Dish, Plastic with 2 Lids | Grale Scientific | 353 | For antigen retrival |
| 20 Place Staining Rack, Slides Horizontal | Grale Scientific | 354 | For antigen retrival |
| Microwave | Any | N/A | For antigen retrival |
Referências
- Marrack, J. R. Chemistry of antigens and antibodies. Nature. 134, 468-469 (1934).
- Coons, A. H., Creech, H. J., Jones, R. N., Berliner, E. The demonstration of pneumococcal antigen in tissues by the use of fluorescent antibody. J Immunol. 45, 159-170 (1942).
- Marshall, J. M. Localization of adrenocorticotropic hormone by histochemical and immunochemical methods. The Journal of experimental medicine. 94, 21-30 (1951).
- Mellors, R. C. Histochemical demonstration of the in vivo localization of antibodies: antigenic components of the kidney and the pathogenesis of glomerulonephritis. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 3, 284-289 (1955).
- Nakane, P. K., Pierce, G. B. Enzyme-labeled antibodies: preparation and application for the localization of antigens. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 14, 929-931 (1966).
- Avrameas, S., Uriel, J. Method of antigen and antibody labelling with enzymes and its immunodiffusion application. Comptes rendus hebdomadaires des seances de l’Academie des sciences. Serie D: Sciences naturelles. 262, 2543-2545 (1966).
- Cuello, A. C. . Immunohistochemistry. , (1983).
- Junqueira, L. C. U., Mescher, A. L. . Junqueira’s basic histology : text and atlas. , (2013).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of visualized experiments : JoVE. , (2012).
- Christensen, N. K., Winther, L., Kumar, G. L., Rudbeck, L. . Education Guide: Immunohistochemical (IHC) staining methods. , 103-108 (2009).
- Wang, G., Achim, C. L., Hamilton, R. L., Wiley, C. A., Soontornniyomkij, V. Tyramide signal amplification method in multiple-label immunofluorescence confocal microscopy). Methods. 18, 459-464 (1999).
- Feldengut, S., Del Tredici, K., Braak, H. Paraffin sections of 70-100 mum: a novel technique and its benefits for studying the nervous system. Journal of neuroscience methods. 215, 241-244 (2013).

