ミクログリアとニューロンのための例染色:凍結切片ラット脳組織の免疫組織化学のためのプライマー
Summary
This introductory level protocol describes the reagents, equipment, and techniques required to complete immunohistochemical staining of rodent brains, using markers for microglia and neuronal elements as an example.
Abstract
免疫組織化学は、 その場での抗原の存在、位置、および相対的な存在量を検出するために広く用いられている技術です。この入門レベルのプロトコルは、試薬、装置、一例として、ミクログリアおよび神経要素のためのマーカーを用いて、げっ歯類の脳組織の免疫組織化学的染色を完了するために必要な技術を記載しています。具体的には、本論文では、それぞれIBA1と汎神経、免疫組織化学のために介してミクログリアと神経細胞の蛍光可視化するためのステップバイステップのプロトコルです。蛍光二重標識は、正確な細胞型、受容体、リガンドの間の相互作用を観察する機会を提供し、同じ試料中の複数のタンパク質の局在化のために特に有用であり、及び/又は互いにならびにタンパク質共に関連する細胞外マトリックス単一細胞内の局在。他の可視化技術とは異なり、蛍光免疫組織化学染色の強度が低下することがで適切な予防措置が取られない限り、染色後数週間から数ヶ月。蛍光はより多くの時間が効率的であり、2つ以上の間でより正確な区別を可能にするように、この制限にもかかわらず、多くの用途において蛍光二重標識は、3,3'-ジアミノベンジジン四塩酸塩(DAB)またはアルカリホスファターゼ(AP)などの選択肢よりも好ましいですマーカー。議論は成功を促進するために、トラブルシューティングのヒントやアドバイスが含まれています。
Introduction
免疫組織化学は、目的の抗原に特異的に結合する一次抗体を用いて、組織切片中の抗原( すなわち、タンパク質)を検出するための処理です。免疫組織化学は、彼は抗体が大きな特異性1と抗原を局所化できることを決定し1934年にJR Marrackによって開拓されました。 1942年に始まって、免疫組織化学を可視化する蛍光抗体を用いた研究in vitroでの最初の一部は、 生体組織化学的研究では 、まず、4を発表した後の2,3を 、発表されました。 1960年代の間に、三十年免疫組織化学的方法の開始後に、酵素標識抗体を二次試薬として使用されるようになりました。これらの方法は、同時に独立し、フランスと米国の5,6に開発されました。今日では、抗体の広い配列は、免疫組織化学研究の7のための無限の可能性を提供します。
">この対応の全体的な目標は、免疫組織染色への簡単な紹介を提供することにある。それは、この技術の包括的かつ徹底的な見直しとなるものではありません概説した方法では、2つの抗原のための免疫組織化学的技術は、ミクログリアのために(マーカーを提示しています。パラホルムアルデヒド灌流、スクロース凍結保護、凍結切片ラットの脳の染色のためのニューロン)。免疫組織化学染色は、バックグラウンド染色を低減するために非特異的抗原を遮断することから始まる。次に、一次抗体とのインキュベーションは、組織内の特定の抗原に結合することができます。一次抗体に続いて、別の抗体、二次抗体と呼ばれる、共役可視化信号8に一次抗体をリンクするために適用される。二次抗体は、一次抗体が発生された種に特異的な免疫グロブリンG(IgG)ドメインを標的とする。二次抗体は、シグナルを増幅します一次抗体のTののFab領域のため、彼一次抗体のIgGのドメイン上の複数のサイトへの二次抗体に結合します。二次抗体のF C領域に結合させ、酵素または蛍光分子は、可視化を可能にします。例えば、ウサギ抗IBA1一次抗体はIBA1に特異的なウサギIgG分子です。ロバ抗ウサギIgGを二次抗体として適用した場合、それを認識し、ウサギ抗IBA1 IgGの複数の領域( 図1参照)に結合します。ロバ抗体は、種々の方法によって可視化することができます。この対応は、蛍光顕微鏡により可視化するために、一次抗体を認識する二次抗体にコンジュゲート蛍光団の検出に焦点を当てています。蛍光免疫組織化学では、例えば、ヘキスト又はDAPIなどの核染色はすべての核を可視化するために使用することができます。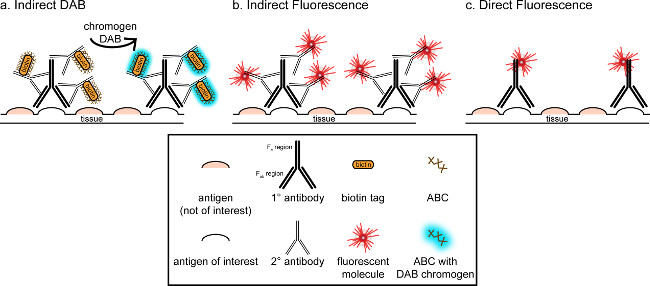
図1:のSch直接対間接的な抗体の標識技術のematic表現抗体は、目的の抗原に結合し、一次抗体の種に対して惹起二次抗体によって増幅することができます。この技術は、増幅およびDAB可視化のための(A)、または直接結合蛍光二次抗体(B)は、アビジン-ビオチン複合体(ABC)を用いて行うことができます。あるいは、一次抗体を直接ビオチンまたは蛍光団(C)を含む多くの異なるタグを用いて結合させることができる。 この図の拡大版を表示するには、こちらをクリックしてください。
免疫組織化学的染色を視覚化するための別の方法は、(DAB、 図1および図2を参照)3,3'-ジアミノベンジジンテトラヒドロクロライドを使用しています。これは、ビオチン化を用いて、蛍光とは異なる、または明視野顕微鏡下に表示されている沈殿物にDABを変換する酵素を提供するホースラディッシュペルオキシダーゼ(HRP)結合二次抗体。単一の抗原に関心があるか、染色が長く持続することが要求される事例では、DABは、蛍光染色よりも適切な場合があります。しかし、DAB染色は、2つの核抗原が注目されている場合は特に、複数のマーカーの間の区別には適していません。 DAB材料およびプロトコルの変更については、 表1を参照してください。代わりに、ニトロブルーテトラゾリウムクロリド/ 5-ブロモ-4-クロロ-3-インドリルホスフェート(NBT / BCIP)は、アルカリホスファターゼ(AP)を可視化するために用いることができる共役二抗体。
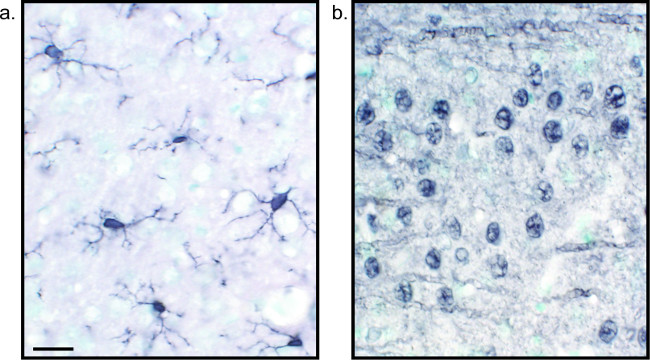
図2:ニッケル強化DAB単一標識ラット脳組織切片の代表的な画像ラット脳SEIBA1用ニッケル強化DAB(A)で標識し、汎神経されctions(B)は、単独でミクログリアまたは神経細胞の長期的な分析を可能にします。スケールバーは20μm。 この図の拡大版を表示するには、こちらをクリックしてください。
一つは、分析されている組織内の目的の抗原の推定豊かさを考慮する必要があります。間接的な方法には、(上記のように)低量と目標のために有用です。目的の抗原が多量である場合、直接法を適用することができます。直接法は、直接可視化信号に結合している一次抗体を伴う、したがって、二次抗体は必要ありません。この方法は、染色プロセスを簡略化するが、間接的な方法によって達成増幅を排除します。直接結合一次抗体を使用すると、二次抗体の交差反応性を排除しますときに二重標識。
この通信は、IBA1とパンニューロン( 表1の詳細)で二重標識のためのプロトコルの詳細について説明します。 IBA1は分岐し、ハイパー分岐し、活性化され、アメーバ状、及びロッドを含む多くの活性化状態において、ミクログリアを染色します。汎神経汚れ神経の軸索、樹状突起、およびソーマ。 IBA1が最もミクログリアとパン神経標的ニューロンを染色するので、汚れのこの組み合わせは、ミクログリア – ニューロン相互作用の広範な理解を得るのに有用です。
要するに、免疫組織化学染色は、抗体の慎重な選択に依存しています。調査の質問は、より具体的になるように、代替の抗原に対して惹起された抗体が所望され得ます。特定のミクログリアの活性化状態をターゲットとするためには、むしろIBA1よりも、CD45またはCD68抗体を使用することを選択することができます。また、マウスでの作業中に、F4 / 80は、必要な結果を提供することができます。同様に、神経細胞の要素は、具体的には、抗体のRAで標的とすることができます核に対するised、シナプス(前または後)、軸索と成長円錐。さらに、ニューロン(ダブルコルチン、のNeuN)の年齢を区別する他のマーカー、および神経再生(GAP-43)があります。
Protocol
Representative Results
Discussion
この通信の全体的な目標は、読者に、免疫組織化学の手順を導入することでした。このため、IBA1とパン神経抗原と二重標識の例は、ミクログリアおよび灌流パラホルムアルデヒド中でニューロンを観察するために、スクロース凍結保護、凍結切片ラットの脳を使用しました。
この技術は、無限の目的を果たすように構成することができます。脳、肺、肝臓、腎臓および?…
Declarações
The authors have nothing to disclose.
Acknowledgements
The authors would like to thank Mr. Ryan Hart and Mr. Arriz Lucas for their invaluable feedback on this communication. This work was supported by NIH NINDS R01 NS065052 and Phoenix Children’s Hospital Mission Support Funds.
Materials
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| Fisherbrand Superfrost Plus Glass Slides | Fisher Scientific | 22-034-979 | Used for tissue mounting (1.2.2) |
| Oven | Thermo Scientific | 51028112 | Used for tissue drying (2.1.1) |
| Mini Pap pen | Life Technologies | 00-8877 | Used in step 2.2.2 |
| Andwin Scientific Tissue-tek Slide Staining Dish | Fisher Scientific | 22-149-429 | Used for all washes during staining (2.2), as well as the Hoechst step (2.2.8) |
| Kimwipes | Fisher Scientific | 06-666-A | Used for drying slides (2.2) |
| Black Staining Box | Ted Pella | 21050 | Used for blocking and staining steps (2.2) |
| Normal Donkey Serum | Fisher Scientific | 50-413-253 | Used for block and antibody incubation (2.2) |
| Mouse α-Pan-neuronal | Millipore | MAB2300 | Used for primary antibody (2.2.4) |
| Rabbit α-Iba1 | Wako Chemical | 019-19741 | Used for primary antibody (2.2.4) |
| Donkey α-Rabbit 594 | Jackson ImmunoResearch | 711-585-152 | Used for secondary antibody (2.2.6) |
| Donkey α-mouse 488 | Jackson ImmunoResearch | 715-545-150 | Used for secondary antibody (2.2.6) |
| Caterer's foil | Any | N/A | Used in steps 1.2.2 and 2.3.2 |
| Fluoromount-G | Southern Biotech | 0100-01 | Used for coverslipping (2.2.8) |
| Coverslips | Fisher Scientific | 12544E | Used for coverslipping (2.2.8) |
| Clear Nail Polish | Any | N/A | Used for coverslipping (2.2.8) |
| Axio Observer.Z1 and LSM 710 (laser scanning, confocal) | Carl Zeiss | N/A | Used for imaging (3) |
| Axioskop A2 | Carl Zeiss | N/A | Used for imaging (3) |
| CitriSolv | FisherScientific | For DAB protocol | |
| ABC | Vector Laboratories | PK-6100 | For DAB protocol |
| DAB Peroxidase kit | Vector Laboratories | SK-4100 | For DAB protocol |
| Biotinylated horse α-rabbit IgG | Vector Laboratories | BA-1100 | For DAB protocol |
| Biotinylated horse α-mouse IgG | Vector Laboratories | BA-2001 | For DAB protocol |
| 30% Hydrogen Peroxide | FisherScientific | H325-500 | For DAB protocol |
| Wheaton slide racks and staining dishes | TedPella | 21043 | For DAB protocol |
| Masterflex perfusion pump and tubing | Cole-Parmer | Used for perfusion (1.1.1 and 1.1.2) | |
| Andwin scientific tissue-tek CRYO-OCT compound (case of 12) | Fisher Scientific | 14-373-65 | Used for tissue freezing (1.2.1) |
| Thermometer (-50 to 50 C) | Fisher Scientific | 15-059-228 | Used for tissue freezing (1.2.1) |
| Cryostat | Leica | CM3500S | Used for tissue sectioning (1.2.2) |
| Staining Dish, Plastic with 2 Lids | Grale Scientific | 353 | For antigen retrival |
| 20 Place Staining Rack, Slides Horizontal | Grale Scientific | 354 | For antigen retrival |
| Microwave | Any | N/A | For antigen retrival |
Referências
- Marrack, J. R. Chemistry of antigens and antibodies. Nature. 134, 468-469 (1934).
- Coons, A. H., Creech, H. J., Jones, R. N., Berliner, E. The demonstration of pneumococcal antigen in tissues by the use of fluorescent antibody. J Immunol. 45, 159-170 (1942).
- Marshall, J. M. Localization of adrenocorticotropic hormone by histochemical and immunochemical methods. The Journal of experimental medicine. 94, 21-30 (1951).
- Mellors, R. C. Histochemical demonstration of the in vivo localization of antibodies: antigenic components of the kidney and the pathogenesis of glomerulonephritis. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 3, 284-289 (1955).
- Nakane, P. K., Pierce, G. B. Enzyme-labeled antibodies: preparation and application for the localization of antigens. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 14, 929-931 (1966).
- Avrameas, S., Uriel, J. Method of antigen and antibody labelling with enzymes and its immunodiffusion application. Comptes rendus hebdomadaires des seances de l’Academie des sciences. Serie D: Sciences naturelles. 262, 2543-2545 (1966).
- Cuello, A. C. . Immunohistochemistry. , (1983).
- Junqueira, L. C. U., Mescher, A. L. . Junqueira’s basic histology : text and atlas. , (2013).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of visualized experiments : JoVE. , (2012).
- Christensen, N. K., Winther, L., Kumar, G. L., Rudbeck, L. . Education Guide: Immunohistochemical (IHC) staining methods. , 103-108 (2009).
- Wang, G., Achim, C. L., Hamilton, R. L., Wiley, C. A., Soontornniyomkij, V. Tyramide signal amplification method in multiple-label immunofluorescence confocal microscopy). Methods. 18, 459-464 (1999).
- Feldengut, S., Del Tredici, K., Braak, H. Paraffin sections of 70-100 mum: a novel technique and its benefits for studying the nervous system. Journal of neuroscience methods. 215, 241-244 (2013).

