Gentransfektion in Richtung Spheroid Zellen auf mikrostrukturierten Kulturplatten für genetisch veränderte Zelltransplantation
Summary
This protocol describes a cell transplantation system using genetically modified, injectable spheroids. Cell spheroids are cultured on micropatterned culture plates and recovered after gene introduction using polyplex nanomicelles. This system facilitates prolonged transgene expression from the transplanted cells in host animals while maintaining the innate function of the cells.
Abstract
Zur Verbesserung der therapeutischen Wirksamkeit der Zelltransplantation wurde ein Transplantationssystem von gentechnisch veränderten, injizierbare Sphäroiden entwickelt. Die Zellkügelchen werden in einem Kultursystem über mikroPlatten mit einer wärmeempfindlichen Polymer überzogen hergestellt. Eine Anzahl von Sphäroiden werden auf den Platten gebildet sind, entsprechend den Zelladhäsion Bereiche von 100 um Durchmesser, die regelmäßig in einer zweidimensionalen Weise angeordnet sind, die von nicht-klebenden Bereiche umgeben, die von einem Polyethylenglykol (PEG) Matrix beschichtet sind. Die Sphäroide können leicht als eine flüssige Suspension durch Absenken der Temperatur der Platten wiederhergestellt werden, und ihre Struktur ist gut, indem sie durch Injektionsnadeln mit einer ausreichend großen Kalibers (über 27 G) gehalten. Genetische Modifizierung durch Gentransfektion unter Verwendung des ursprünglichen nicht-virale Gen-Träger polyplex nanomicelle, die geeignet ist zur Einführung von Genen in Zellen ohne Störung des Sphäroids Struktur erreicht wird. Für primary Hepatozyten-Sphäroiden mit einem Luciferase-exprimierenden Gen transfiziert wird die Luciferase nachhaltig in transplantierten Tieren erhalten, zusammen mit erhaltenen Hepatozyten-Funktion, wie Albumin Ausdruck angegeben. Dieses System kann auf einer Vielzahl von Zelltypen, einschließlich von mesenchymalen Stammzellen angewendet werden.
Introduction
Zell-Transplantation Therapie hat große Aufmerksamkeit für die Behandlung von verschiedenen hartnäckigen Krankheiten angezogen. Die Aktivität und die Halbwertszeit des biologisch aktiven Faktoren, die durch die transplantierten Zellen sezerniert werden, sind essentiell für eine verbesserte therapeutische Wirksamkeit eines Zelltransplantationssystem. Genetische Modifikation der Zellen vor der Transplantation ist eine positive Technik zu regulieren und zellulären Funktionen, einschließlich der Sekretion der bioaktiven Faktoren manipulieren. Es ist auch wichtig, um eine günstige Mikroumgebung für die Zellen zur Vermeidung Zelltod oder den Verlust von Zellaktivität aufrechtzuerhalten. Dreidimensionale (3D) Sphäroid Zellkultur, in der Zell-zu-Zell-Wechselwirkungen sind gut erhalten, ist vielversprechend für diesen Zweck, zum Beispiel zur Verbesserung der Albumin-Sekretion aus primären Hepatozyten und Förderung Multilinien-Differenzierung von mesenchymalen Stammzellen (MSCs ) 1-7.
In dieser Studie wurde eine neue Kombination System spheroid Kultur und Gentransfektion wird verwendet, um als Plattform für gentechnisch veränderte Zelltransplantation dienen. Für die Erstellung von Sphäroid-Zellen wird ein Sphäroid Kultursystem auf mikrostrukturierten Kulturplatten verwendet. Auf diesen Platten sind die Zelladhäsion Bereiche Durchmesser von 100 um regelmäßig in einer zweidimensionalen Weise angeordnet und werden durch nicht-klebenden Bereiche mit einem PEG-Matrix 3 beschichtet umgeben. Durch Animpfen einer ausreichenden Zahl von Zellen, Anordnungen von 3D Sphäroiden von 100 um im Durchmesser entsprechend dem Mikromuster Kulturbett gebildet.
Die Sphäroide werden, ohne ihre 3D-Struktur mit wärmeZellKulturPlatten, die mit einem wärmeempfindlichen Polymer, Poly (iso-propylacrylamid) beschichtet waren (PIPAAm) 8-10 gewonnen. Die mikro Architektur basiert auf den wärmeempfindlichen Platten aufgebaut (custom-built). Einfach durch Absenken der Temperatur der Platten werden die Sphäroide aus dem Kulturbett abgetrennt und zerstreuend in phosphatgepufferter Salzlösung (PBS). Somit kann eine große Anzahl von Sphäroiden mit einer einheitlichen Grße von 100 & mgr; m in der Form einer injizierbaren Suspension, erhalten werden.
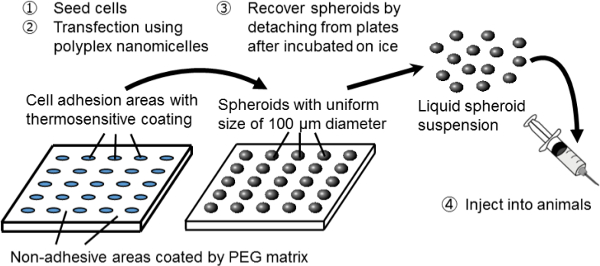
Abbildung 1. Schematische Darstellung der Sphäroid-Kultur-System auf einem mikrostrukturierten Platte. Genetische Veränderung wird durch Gentransfektion unter Verwendung der ursprünglichen nicht-viralen Gen-Träger, polyplex nanomicelle erreicht. Es wird Plasmid-DNA (pDNA) und Polyethylenglykol (PEG) -polycation Blockcopolymere 11 zusammengesetzt ist. Diese haben eine charakteristische Kern-Schale-Struktur, die aus einer PEG-Hülle und einem inneren Kern aus kondensierter pDNA, so dass sichere und wirksame Gen Einführung in die Zellen für therapeutische Zwecke 11. Bitte klicken Sie hier, um eine größere Version zu sehen thiWert.
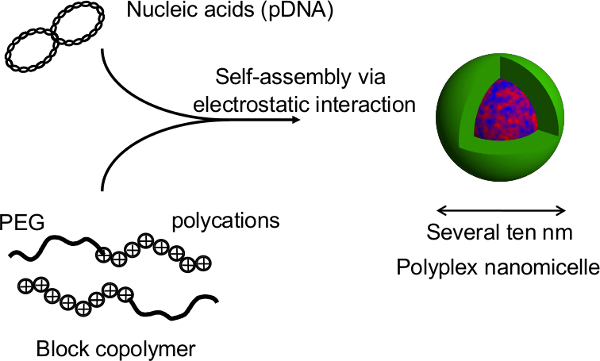
Figur 2. Die Struktur der polyplex nanomicelle durch den Komplex von Nukleinsäuren und PEG-Block-Polykation-Blockcopolymeren gebildet ist. In dieser Studie ist der primäre Vorteil dieses Verfahrens, daß die Sphäroid-Struktur wird während Gentransfektion durch die nanomicelles gestört. Nach nanomicelle vermittelte Transfektionen von primären Ratten Hepatocyten-Spheroiden, verlängert Transgen-Expression von mehr als einem Monat bei kontinuierlicher Albuminsekretion aus der Hepatozyten auf einem Niveau vergleichbar mit der von nicht-transfizierten Sphäroide 12 erhalten. Die Expression des Transgens und Albumin-Sekretion aus den Sphäroiden werden auch nach der Genesung von den wärmeempfindlichen Platten gehalten. Es ist offensichtlich, dass nanomicelles sicher Geneinführung ohne eigene Funktionen des hep beeinträchtigen erleichternatocytes. Somit ist die Kombination von Sphäroid Zellen auf mikrothermosensitiven Platten mit Gen-Einführung mit nanomicelles ist eine vielversprechende Plattform für gentechnisch veränderte Zelltransplantation kultiviert. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Protocol
Representative Results
Discussion
In diesem Protokoll ist es kritisch, um die 3D-Struktur der Sphäroide während der Schritte zur Geneinführung und Sphäroid Erholung aufrechterhalten. Es ist wesentlich, um eine günstige Mikroumgebung aufrechtzuerhalten, dass die Zellen den Zelltod oder den Verlust von Zellaktivität zu vermeiden. Zum Beispiel Albuminsekretion, ein Vertreter angeborene Funktion der Hepatozyten, ist in den Hepatozyten-Sphäroiden erhalten, während die Hepatozyten in der herkömmlichen Monolayer-Kultur schnell ihre sekretorischen Kapa…
Declarações
The authors have nothing to disclose.
Acknowledgements
Wir schätzen Dr. Takeshi Ikeya und technisches Personal in Toyo Gosei, Tokyo, Japan für die Bereitstellung von thermosensitiven mikroKulturPlatten sowie wissenschaftliche Beratung. Wir danken auch Frau Satomi Ogura, Ms. Sae Suzuki, Frau Asuka Miyoshi und Frau Katsue Morii für die technische Unterstützung bei Tierversuchen. Diese Arbeit wurde zum Teil durch die JSPS KAKENHI Grant-in-Aid for Scientific Research unterstützt, das Zentrum der Innovation (COI) Programm und die S- Innovationsprogramm von der Japan Science and Technology Agency (JST) und der JSPS Core zu-Kern-Programm, A. Advanced Research Networks.
Materials
| Pen-Strep-Glut | GIBCO | ||
| Dexamethasone | Wako Pure Chemical Industries | 041-18861 | |
| Nicotinamide | Wako Pure Chemical Industries | 141-01202 | |
| Hank’s buffered salt and L-ascorbic acid 2-phosphate (Asc-2P) | Sigma-Aldrich | A8960 | |
| Human epidermal growth factor (hEGF) | Toyobo | PT10015 | |
| Cell-able multi-well plates | Toyo Gosei | PP-12 | |
| Thermosensitive cell culture plates (Upcell) | CellSeed Inc | The micropatterned architecture is constructed on the thermosensitive plates (custom-built by Toyo Gosei) | |
| Lipid-based transfection reagent (FuGENE HD) | Promega | E2311 | |
| Renilla Luciferase Assay System | Promega | E2810 | |
| pGL4 Luciferase Reporter Vector | Promega | E6651 | |
| pDNA expressing Gaussia luciferase | New England BioLabs | N8082S | |
| Mouse erhthropoietin-expressing vector | Origene | MC208445 | |
| pCAG-GS | Kindly provided by Laboratory for Pluripotent Cell Studies, Center for Developmental Biology, RIKEN | ||
| Escherichia coli DH5α competent cells | Takara | 9057 | |
| Endotoxin-free plasmid DNA purification system | Nippon Genetics | NucleoBond Xtra EF | |
| collagenase | Wako Pure Chemical Industries | 639-00951 | |
| trypsin inhibitor | GIBCO | R-007-100 | |
| Luminometer | Promega | GloMax™ 96 Microplate Luminometer | |
| IVIS Imaging System | Xenogen Corp. | Xenogen IVIS Spectrum in vivo imaging system | |
| blood sample analyzer | Sysmex | pocH-100i Automated Hematology Analyzer |
Referências
- Landry, J., Bernier, D., Ouellet, C., Goyette, R., Marceau, N. Spheroidal aggregate culture of rat liver cells: histotypic reorganization, biomatrix deposition, and maintenance of functional activities. J Cell Biol. 101 (3), 914-923 (1985).
- Yuasa, C., Tomita, Y., Shono, M., Ishimura, K., Ichihara, A. Importance of cell aggregation for expression of liver functions and regeneration demonstrated with primary cultured hepatocytes. J Cell Physiol. 156 (3), 522-530 (1993).
- Otsuka, H., et al. Two-dimensional multiarray formation of hepatocyte spheroids on a microfabricated PEG-brush surface. Chembiochem. 5 (6), 850-855 (2004).
- Wang, W., et al. 3D spheroid culture system on micropatterned substrates for improved differentiation efficiency of multipotent mesenchymal stem cells. Biomaterials. 30 (14), 2705-2715 (2009).
- Bartosh, T. J., et al. Aggregation of human mesenchymal stromal cells (MSCs) into 3D spheroids enhances their antiinflammatory properties. Proc Natl Acad Sci U S A. 107 (31), 13724-13729 (2010).
- Frith, J. E., Thomson, B., Genever, P. G. Dynamic three-dimensional culture methods enhance mesenchymal stem cell properties and increase therapeutic potential. Tissue Eng Part C Methods. 16 (4), 735-749 (2010).
- Nakasone, Y., Yamamoto, M., Tateishi, T., Otsuka, H. Hepatocyte spheroids underlayered with nonparenchymal cells for biomedical applications. IEICE Transactions on Electronics. E94, 176-180 (2011).
- Nishida, K., et al. Corneal reconstruction with tissue-engineered cell sheets composed of autologous oral mucosal epithelium. N Engl J Med. 351 (12), 1187-1196 (2004).
- Ohashi, K., et al. Engineering functional two- and three-dimensional liver systems in vivo using hepatic tissue sheets. Nat Med. 13 (7), 880-885 (2007).
- Sekine, H., et al. Cardiac cell sheet transplantation improves damaged heart function via superior cell survival in comparison with dissociated cell injection. Tissue Eng Part A. 17 (23-24), 2973-2980 (2011).
- Itaka, K., Kataoka, K. Progress and prospects of polyplex nanomicelles for plasmid DNA delivery. Curr Gene Ther. 11 (6), 457-465 (2011).
- Endo, T., Itaka, K., Shioyama, M., Uchida, S., Kataoka, K. Gene transfection to spheroid culture system on micropatterned culture plate by polyplex nanomicelle: a novel platform of genetically-modified cell transplantation. Drug Deliv and Transl Res. 2 (5), 398-405 (2012).
- Howard, R. B., Christensen, A. K., Gibbs, F. A., Pesch, L. A. The enzymatic preparation of isolated intact parenchymal cells from rat liver. J Cell Biol. 35 (3), 675-684 (1967).
- Berry, M. N., Friend, D. S. High-yield preparation of isolated rat liver parenchymal cells: a biochemical and fine structural study. J Cell Biol. 43 (3), 506-520 (1969).
- Tateno, C., Yoshizato, K. Long-term cultivation of adult rat hepatocytes that undergo multiple cell divisions and express normal parenchymal phenotypes. Am J Pathol. 148 (2), 383-392 (1996).
- Kanayama, N., et al. A PEG-based biocompatible block catiomer with high buffering capacity for the construction of polyplex micelles showing efficient gene transfer toward primary cells. ChemMedChem. 1 (4), 439-444 (2006).
- Itaka, K., Ishii, T., Hasegawa, Y., Kataoka, K. Biodegradable polyamino acid-based polycations as safe and effective gene carrier minimizing cumulative toxicity. Biomaterials. 31 (13), 3707-3714 (2010).
- Uchida, S., et al. PEGylated Polyplex With Optimized PEG Shielding Enhances Gene Introduction in Lungs by Minimizing Inflammatory Responses. Mol Ther. 20 (6), 1196-1203 (2012).
- Golde, W. T., Gollobin, P., Rodriguez, L. L. A rapid, simple, and humane method for submandibular bleeding of mice using a lancet. Lab Anim (NY). 34, 39-43 (2005).
- Uchida, S., et al. An injectable spheroid system with genetic modification for cell transplantation therapy. Biomaterials. 35 (8), 2499-2506 (2014).

