Un protocolo simple y eficaz para la inserción catalítico de polimerización norbornenos funcionales
Summary
We describe the catalytic insertion polymerization of 5-norbornene-2-carboxylic acid and 5-vinyl-2-norbornene to form functional polymers with a very high glass transition temperature.
Abstract
Norborneno puede ser polimerizado por una variedad de mecanismos, incluyendo la polimerización de inserción mediante el cual el doble enlace se polimeriza y la naturaleza bicíclico del monómero se conserva. El polímero, polinorborneno resultante, tiene una temperatura muy alta de transición vítrea, Tg, y propiedades ópticas y eléctricas interesantes. Sin embargo, la polimerización de norbornenos funcionales por este mecanismo es complicado por el hecho de que el monómero de norborneno endo sustituido tiene, en general, una reactividad muy baja. Además, la separación del monómero endo sustituido a partir del monómero exo es una tarea tediosa. A continuación, presentamos un protocolo sencillo para la polimerización de norbornenos sustituidos (endo: exo ca. 80:20) que lleva un ácido carboxílico o un doble enlace colgante. El proceso no requiere que pueden separar los dos isómeros, y procede con cargas de catalizador bajas (0,01-0,02% en moles). Los pend cojinete de polímerodobles enlaces de hormigas pueden ser transformados adicionalmente con un alto rendimiento, para proporcionar un cojinete de polímero de grupos epoxi colgantes. Estos procedimientos simples se pueden aplicar para preparar polynorbornenes con una variedad de grupos funcionales, tales como ésteres, alcoholes, imidas, dobles enlaces, ácidos carboxílicos, bromo-alquilos, aldehídos y anhídridos.
Introduction
Norborneno, NBE, el aducto de Diels-Alder de etileno y ciclopentadieno (obtenido por "cracking" de diciclopentadieno (DCPD)), se polimeriza fácilmente usando polimerización por radicales libres, 1 polimerización catiónica, metátesis polimerización por apertura de anillo de 2 3 y la inserción catalítica polimerización. 4, 5, 6, 7 A diferencia de los otros mecanismos, la polimerización de inserción catalítico conduce a la formación de una temperatura muy alta de transición vítrea (Tg) del polímero mediante el cual se conserva la columna vertebral bicíclico de NBE. Una variedad de catalizadores tales como catalizadores de metaloceno y catalizadores de metales de transición finales se puede utilizar para promover la polimerización de NBE. 4, 5, 6, <sup class = "xref"> 7 Sin embargo, debido a su baja solubilidad y debido a las dificultades asociadas con el procesamiento de un polímero muy alta Tg, el homopolímero PNBE ha, que nosotros sepamos, nunca se encontró ningún uso.
Polynorbornenes funcionales (PNBEs) han sido objeto de un escrutinio considerable durante los últimos 20 años, ya que combinan la alta Tg impartida por la unidad de repetición rígida bicíclico, así como propiedades deseables dotadas por sus funcionalidades. 8, 9, 10 monómeros NBE se obtienen de materias primas bastante simple y de bajo costo, utilizando una reacción de Diels-Alder de un solo paso entre el ciclopentadieno y un dienófilo funcionalizado. Sin embargo, la reacción de Diels-Alder conduce a dos estereoisómeros, endo y exo, que tienen muy diferentes reactividades. 11, 12 De hecho, el equipo de música endoisómero es menos reactivo que forma exo y desactiva el catalizador. 11, 12 Por lo tanto, en el pasado, la preparación de polynorbornenes funcionales requiere generalmente la separación de los estereoisómeros endo y exo, y se utilizó sólo el estereoisómero exo. Dicho procedimiento de separación era mucho tiempo, y dio lugar a la acumulación de estereoisómeros endo sin reaccionar como residuos indeseables.
Recientemente hemos demostrado que la polimerización de NBEs funcionalizados que contienen ambos estereoisómeros es, de hecho, factible. 13 por lo que hemos sido capaces de preparar una variedad de PNBEs sustituidos, que contienen grupos funcionales tales como ésteres, anhídridos, aldehídos, alcoholes, imidas y dobles enlaces. Debido a su alto T g y funcionalidad, estos polímeros muestran propiedades deseables. Se describe aquí dos métodos para preparar polímeros funcionales. El primero conduce ala síntesis de la poli polímero soluble en agua (ácido 5-norborneno-2-carboxílico), PNBE (CO 2 H), utilizando un catalizador de Pd catiónico (Figura 1). 13, 14 El mismo método de polimerización puede usarse para preparar PNBEs funcionales con varias funcionalidades colgantes, tales como ésteres, alcoholes, imidas, bromo-alquilos, aldehídos y anhídridos. En nuestras manos, este catalizador Pd catiónico no se puede utilizar para NBEs que contienen dobles enlaces colgantes tales como 5-vinil-2-norborneno. En este caso, una inserción parcial del doble enlace colgante durante la polimerización conduce a la formación de un material reticulado. Por lo tanto, se presenta aquí un segundo método dedicado a la formación de poli (5-vinil-2-norborneno), PNBE (vinilo), usando Pd 2 (dba) 3: AgSbF 6: PPh 3 como un catalizador en situ. 14 Los grupos vinilo colgantes del polímero epoxidado son luego más allá, al llevar a THe formación de PNBE (epoxi) (Figura 1). Tanto PNBE (CO 2 H) y PNBE (epoxi) se han encontrado para conducir a la formación de resinas termoendurecibles con una Tg tan alta como 350 ° C. 14 Por lo tanto, el simple método descrito aquí permite a uno preparar eficientemente polímeros con una alta Tg y que tiene una variedad de grupos funcionales, que se pueden utilizar para numerosas aplicaciones.
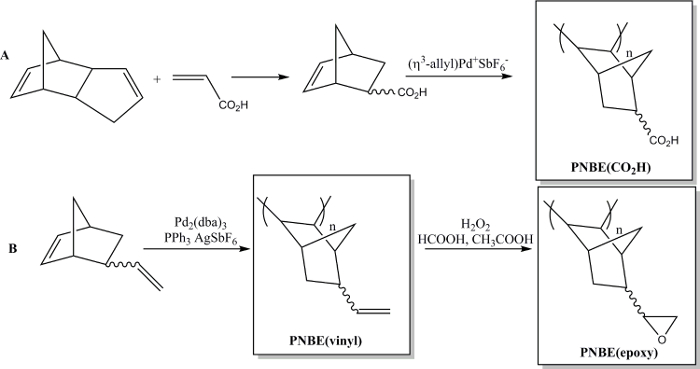
Figura 1: PNBEs funcionales preparados por Pd catalizada polimerización. (A) Preparación de PNBE (CO 2 H), (B) la preparación de PNBE (vinilo) y PNBE (epoxi). El enlace de trazos indica una mezcla de isómeros endo y exo. Haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
El método propuesto aquí es simple y fácilmente susceptible de aumento de escala. Todos los productos químicos podrían ser utilizados como se recibieron sin purificación. Tenga en cuenta que la realización de la reacción a una escala más baja (por ejemplo, balanzas ≤1 g) por lo general tienen rendimientos más bajos debido a una pérdida inevitable de material durante la manipulación y la colección.
Los catalizadores se forman in situ en la reacción de compues…
Declarações
The authors have nothing to disclose.
Acknowledgements
The authors acknowledge funding from Fonds de Recherche du Québec – Nature et Technologies, from Conseil Recherches en Sciences Naturelles et Génie (program INNOV) and PrimaQuébec.
Materials
| acrylic acid | Sigma-Aldrich | 147230 | |
| hydroquinone | Sigma-Aldrich | H9003 | |
| dicyclopendadiene | Sigma-Aldrich | 454338 | |
| palladium allyl dichloride dimer | Sigma-Aldrich | 222380 | |
| silver hexfluoro antimonate | Sigma-Aldrich | 227730 | |
| liquid nitrogen | Local Facility | NA | |
| ethyl acetate | Fischer Scientific | E14520 | |
| 5-vinyl-2-norbornene | Sigma-Aldrich | 148679 | |
| toluene | Fischer Scientific | T290-4 | |
| palladium dba | Sigma-Aldrich | 227994 | |
| triphenyl phosphine | Sigma-Aldrich | 93090 | |
| silica gel 40-63 microns | Silicycle | Siliaflash | |
| methanol | Fischer Scientific | BPA412-20 | |
| dichloromethane | EMD Millipore | DX08311 | |
| formic acid | Sigma-Aldrich | F0507 | |
| acetic acid | Sigma-Aldrich | 320099 | |
| hydrogen peroxide solution | Sigma-Aldrich | 216763 | |
| acetone | Fischer Scientific | A18-200 |
Referências
- Gaylord, N. G., Mandal, B. M., Martan, M. Peroxide-induced polymerization of norbornene. J. Polym. Science, Polym. Lett. Ed. 14 (9), 555-559 (1976).
- Janiak, C., Lassahn, P. G. The vinyl homopolymerization of norbornene. Macromol. Rapid Comm. 22 (7), 479-493 (2001).
- Bielawski, C. W., Grubbs, R. H. Living ring-opening metathesis polymerization. Prog. Polym. Sci. 32 (1), 1-29 (2007).
- Blank, F., Janiak, C. Metal catalysts for the vinyl/addition polymerization of norbornene. Coord. Chem. Rev. 253 (7-8), 827-861 (2009).
- Kaminsky, W., Boggioni, L., Tritto, I. Cycloolefin polymerization. Polymer Science: A Comprehensive Reference, 10 Volume Set. 3, 843-873 (2012).
- Boggioni, L., Tritto, I. State of the art of cyclic olefin polymers. MRS Bull. 38 (3), 245-251 (2013).
- Goodall, B., Rieger, B., Baugh, L., Kacker, S., Striegler, S. Cycloaliphatic polymers via late transition metal catalysis. Late Transition Metal Polymerization Catalysis. , 101-154 (2003).
- Zhou, W., He, X., Chen, Y., Chen, M., Shi, L., Wu, Q. Vinyl-addition copolymerization of norbornene and polar norbornene derivatives using novel bis(β-ketoamino)Ni(II)/B(C6F5)3/AlEt3 catalytic systems. J. Appl. Polym. Sci. 120 (4), 2008-2016 (2011).
- Müller, K., Jung, Y., Yoon, D. Y., Agarwal, S., Greiner, A. Vinyl-type polymerization of alkylester-substituted norbornenes without endo/exo separation. Macromol. Chem. Phys. 211 (14), 1595-1601 (2010).
- Boffa, L. S., Novak, B. M. Copolymerization of polar monomers with olefins using transition-metal complexes. Chem. Rev. 100 (4), 1479-1494 (2000).
- Funk, J. K., Andes, C. E., Sen, A. Addition Polymerization of Functionalized Norbornenes: The Effect of Size Stereochemistry, and Coordinating Ability of the Substituent. Organometallics. 23 (8), 1680-1683 (2004).
- Hennis, A. D., Polley, J. D., et al. Novel, efficient, palladium-based system for the polymerization of norbornene derivatives: Scope and mechanism. Organometallics. 20 (13), 2802-2812 (2001).
- Commarieu, B., Claverie, J. P. Bypassing the lack of reactivity of endo-substituted norbornenes with the catalytic rectification-insertion mechanism. Chem. Sci. 6 (4), 2172-2182 (2015).
- Commarieu, B., Potier, J., et al. Ultrahigh Tg epoxy thermosets based on insertion polynorbornenes. Macromoecules. 49 (3), 920-925 (2016).
- Pirrung, M. C. . The Synthetic Organic Chemist’s Companion. , (2007).
- Kanao, M., Otake, A., Tsuchiya, K., Ogino, K. Stereo-selective synthesis of 5-norbornene-2-exo-carboxylic acid-Rapid isomerization and kinetically selective hydrolysis. Int. J. Org. Chem. 2 (1), 26-30 (2012).
- Huertas, D., Florscher, M., Dragojlovic, V. Solvent-free Diels-Alder reactions of in situ generated cyclopentadiene. Green Chem. 11 (1), 91-95 (2009).
- Pierre, F., Commarieu, B., Tavares, A. C., Claverie, J. High Tg sulfonated insertion polynorbornene ionomers prepared by catalytic insertion polymerization. Polymer. 86, 91-97 (2016).
- Woo, H. G., Li, H. . Advanced functional materials, Chapter 1.6.8,30. 1, (2011).
- Kim, D. -. G., Bell, A., Register, R. a. Living vinyl addition polymerization of substituted norbornenes by a t-Bu3P-Ligated Methylpalladium Complex. ACS Macro Letters. 4 (3), 327-330 (2015).
- Seung, H., S, A., Baek, K., Sang, S., Intech, S. i. l. a. g. u. i. ,. M. .. A. .. ,. e. d. .. ,. Low Dielectric Materials for Microelectronics. Dielectric Material. , 59-76 (2012).

