مستوحاة تشريحيا ثلاثي الأبعاد الأنسجة الدقيقة المهندسة الشبكات العصبية لإعادة الإعمار الجهاز العصبي، والتحوير، والنمذجة
Summary
هذه المخطوطة تفاصيل تلفيق الشبكات العصبية الأنسجة الدقيقة المهندسة: بناء ثلاثي الأبعاد ميكرون الحجم تتألف من المسالك المحورية محاذاة طويلة تمتد سكان الخلايا العصبية المجمعة المغطاة في هيدروجيل أنبوبي. هذه السقالات الحية يمكن أن تكون بمثابة التبديلات وظيفية لإعادة بناء أو تعديل الدوائر العصبية أو كما بيوفيديك اختبار الأسرة تحاكي الرمادي الأبيض المادة العصبية.
Abstract
نادرا ما يحدث الانتعاش وظيفية بعد الإصابة أو انحطاط الناجم عن المرض داخل الجهاز العصبي المركزي (نس) بسبب البيئة المثبطة والقدرة المحدودة على تكوين الخلايا العصبية. نحن نعمل على تطوير استراتيجية لمعالجة في وقت واحد الخلايا العصبية والمحور فقدان المسار داخل الجهاز العصبي المركزي التالفة. تقدم هذه المخطوطة بروتوكول تصنيع الشبكات العصبية المهندسة الأنسجة الدقيقة (تينس-ميكرو)، والبنى زرع تتكون من الخلايا العصبية ومسارات محور عصبي الانحياز التي تمتد تجويف المصفوفة خارج الخلية (إسم) من هيدروجيل اسطوانة بريفورميد المئات من ميكرون في القطر التي قد تمتد سنتيمتر في الطول. يتم تحديد المجاميع العصبية إلى أقصى حد من التضمين ثلاثي الأبعاد وتمتد من إسقاطات محور عصبي. يتم وضع تينس الصغرى كاستراتيجية لإعادة الإعمار الجهاز العصبي المركزي، محاكاة جوانب الهندسة المعمارية الدماغ كونيكوم ويحتمل توفير وسائل لاستبدال الشبكة. نيوقد تتشابك مجاميع رونال مع أنسجة المضيف لتشكيل مرحلات وظيفية جديدة لاستعادة و / أو تعديل الدوائر المفقودة أو التالفة. ويمكن أن تكون هذه البنى أيضا بمثابة الموالية للتجدد "السقالات الحية" قادرة على استغلال الآليات التنموية للهجرة الخلية والمحاور المساري، وتوفير التآزر الهيكلي والذوبان الإشارات استنادا إلى حالة التجديد. يتم تصنيعها تينس الصغرى عن طريق صب هيدروجيل السائل في قالب أسطواني يحتوي على إبرة تركز طوليا. مرة واحدة وقد تلمح هيدروجيل، تتم إزالة الإبرة، وترك عمود الصغير جوفاء. يتم إضافة حل إسم إلى التجويف لتوفير بيئة مناسبة لالتصاق العصبية ونمو محور عصبي. يتم تجميع الخلايا العصبية متفرقة ميكانيكيا للبذر الدقيق داخل واحد أو طرفي العمود الصغير. هذه المنهجية تنتج موثوقة بنيات مصغرة مكتفية ذاتيا مع المسارات محور عصبي طويلة الإسقاط التي قد تلخص ملامح الدماغ العصبي. سينابتيك إمونولابيلينغ ومؤشرات الكالسيوم المشفرة وراثيا تشير إلى أن تينس الصغرى تمتلك توزيع متشابك واسعة النطاق والنشاط الكهربائي الجوهري. وبالتالي، تينس الصغرى تمثل استراتيجية واعدة لإعادة بناء الأعصاب المستهدفة من مسارات الدماغ، ويمكن أيضا أن تطبق كنماذج بيوفيديك لدراسة الظواهر العصبية الحيوية في المختبر .
Introduction
وهناك سمة مشتركة من اضطرابات وأمراض الجهاز العصبي المركزي، مثل إصابات الدماغ الصدمة (تبي)، إصابة الحبل الشوكي (سسي) والسكتة الدماغية ومرض الزهايمر، ومرض باركنسون، هو انقطاع مسارات محور عصبي والخلايا العصبية الخسارة 1 ، 2 ، 3 ، 4 ، 5 ، 6 . على سبيل المثال، عندما يذهب السكتة الدماغية دون علاج، ويقدر أن محاور يتم فقدان بمعدل 7 أميال من المحاور في الدقيقة 5 . في حالة تبي، والتي ما يقرب من 1.7 مليون شخص تجربة كل عام في الولايات المتحدة وحدها، قد تستمر انحطاط محور عصبي تحدث بعد سنوات من الصدمة، كما يعجل الإصابة الأولية على المدى الطويل الدولة الاعصاب 4 . ومما يزيد من حدة هذه الآثار الضارة أن الجهاز العصبي المركزي لديه كابا محدود للغايةمدينة للتجديد 1 ، 7 ، 8 ، 9 . بعد الإصابة، وتطور البيئة المثبطة التي تتميز بعدم توجيه توجيهات إلى أهداف بعيدة، وجود مثبطات المايلين المرتبطة التي تعيق نمو العصبية، وتشكيل ندبة الدبقية من قبل الخلايا النجمية رد الفعل 8 ، 10 ، 11 ، 12 . الندبة الدبقية بمثابة الحاجز البيوكيميائية والفيزيائية لتجديد، مع جزيئات مثل بروتيوغليكان كبريتات شوندروتن عرقلة نمو محور عصبي 8 ، 11 . وعلاوة على ذلك، على الرغم من أن الخلايا الجذعية العصبية تم العثور عليها في الجهاز العصبي المركزي الكبار، وإنتاج الخلايا العصبية الجديدة محدودة، ودليل ثابت على تكوين الخلايا العصبية لم يتم العثور عليها إلا في لمبة الشم، والحصينالمنطقة تحت الحبيبية، ومنطقة المحيطة بالبطين، والقناة المركزية للحبل الشوكي 13 ، 14 . هذه العقبات تمنع الانتعاش وظيفية من الخلايا العصبية المفقودة والهندسة المعمارية المادة البيضاء بعد الإصابة أو المرض، مما أدى إلى تغير الحياة في كثير من الأحيان وطويلة الأمد لهذه الظروف.
على الرغم من عدم وجود القدرة التجدد في الجهاز العصبي المركزي الكبار، وقد ثبت أن تجديد محور عصبي ممكن إذا تم تقديم الإشارات البيئية الكافية لاستضافة الخلايا العصبية 15 ، 16 ، 17 ، 18 . وقد حاول الباحثون تقديم ومعالجة عوامل النمو (على سبيل المثال، عامل نمو الأعصاب ، عامل نمو البشرة، عامل النمو المعتمد على الدبقية، والعامل العصبي -3) وغيرها من جزيئات التوجيه لتحفيز اللدونة وتجديد المحوار 14 ،/ سوب> 18 ، 19 . على الرغم من أن هذه الدراسات أكدت أن محاور الكبار قادرة على الاستجابة لعوامل النمو، وهذه الاستراتيجيات محدودة بسبب نفاذية منخفضة من حاجز الدم في الدماغ والتدرجات المكانية والزمانية المحددة المطلوبة لتعزيز التجدد 14 ، 18 ، 19 . وقد اعتمدت نهج أخرى على فرط تنشيط عوامل النسخ ذات الصلة التجدد في الخلايا العصبية الجهاز العصبي المركزي. على سبيل المثال، أوفيركسريسيون من عامل النسخ ST3 حفز تجديد محور عصبي في العصب البصري 20 . ومع ذلك، كلا تسليم جزيء حيوي و أوفيركسريسيون من عوامل النسخ تفشل في استبدال السكان العصبية المفقودة. وقد تركزت الاستراتيجيات القائمة على الخلية أساسا على زرع الخلايا الجذعية العصبية (نسس) في الجهاز العصبي المركزي، والاستفادة من قدرتها على استبدال الخلايا العصبية الجهاز العصبي المركزي، والإفراج عن العوامل الغذائية،ودعم محاولات العصبية التي تحدث بعد الإصابة 17 . على الرغم من هذا، لا تزال هناك تحديات ملحة تعوق هذا النهج، بما في ذلك القدرة المعوقة للخلايا العصبية المزروعة من أجل البقاء، والاندماج مع المضيف، وتظل مقيدة مكانيا إلى المنطقة المصابة 6 ، 14 ، 17 ، 21 . وبالإضافة إلى ذلك، تسليم الخلية وحدها غير قادرة على إعادة الهندسة المعمارية الخلوية من مسارات محور عصبي التالفة أو المفقودة. وهناك نهج بديل يعالج المشاكل التي تواجه استراتيجيات تسليم الخلايا والمخدرات / الكيميائية هو الجمع بين هذه النهج مع استخدام المواد الحيوية 14 ، 22 ، 23 . المواد الحيوية مثل الهلاميات المائية هي قادرة على محاكاة الخصائص البيوكيميائية والفيزيائية للمصفوفة خارج الخلية (إسم)، والمساعدة في تسليم الخليةد داخل المنطقة المصابة، وتسليم عوامل النمو وغيرها من الجزيئات النشطة بيولوجيا مع الافراج عن السيطرة 22 . وقد أدت الخصائص الجذابة لهذه الاستراتيجيات القائمة على المواد الحيوية في أدلة على الجسم الحي تجديد محور عصبي بعد زرع السقالات إلى منطقة ليسيونيد 24 ، 25 ، 26 ، 27 ، 28 ، 29 ، 30 . ومع ذلك، واستراتيجيات المواد الحيوية الخلوية لا تحل محل السكان العصبية المفقودة. عندما تستخدم كوسيلة تسليم الخلايا العصبية، الدبقية، أو الخلايا العصبية السلائف، والمواد الحيوية غير قادرة على إعادة تشكيل شبكات محور عصبي لمسافات طويلة. التحدي المتمثل في تطوير النهج الذي يعالج كل من محور عصبي انحطاط المسار وفقدان الخلايا العصبية المرتبطة إصابة الجهاز العصبي المركزي والمرض لا يزال <سوب كلاس = "كريف"> 31.
وقد ذكرت مجموعة أبحاثنا في وقت سابق تطوير الشبكات العصبية زرع الأنسجة العصبية زرع (تينس الصغرى)، والتي هي نوع من "سقالة المعيشة" تتكون من الهيئات خلية الخلايا العصبية تقتصر على واحد أو طرفي أغاروس هيدروجيل-إسم الصغرى العمود ، مع محاذاة محاور عصبية تمتد في جميع أنحاء المناطق الداخلية من هذا ثلاثي الأبعاد (3D) التشفير 1 ، 10 ، 31 ، 32 . واحدة من الاختلافات الرئيسية بين هذه التقنية والنهج السابقة هو أن الهندسة المعمارية الخلوية من تينس الصغرى يتم إنشاؤها تماما في المختبر وزرع بعد ذلك 33 ، 34 ، 35 ، 36 ، 37 ، 38 ، <سوب كلاس = "كريف"> 39 ، 40 ، 41 . في التصنيع المختبر يوفر السيطرة المكانية والزمانية واسعة من النمط الظاهري الخلوي والتوجه، والخصائص الميكانيكية / الفيزيائية، والإشارات البيوكيميائية، والعوامل الخارجية، والذي يفيد دمج هذه السقالات مع المضيف بعد زرع 41 ، 42 . الصغرى تينس مستوحاة تشريحيا لأنها تحاكي الدماغ العصبي، وعرض المسالك محور عصبي مماثلة لتلك التي تجسر مناطق وظيفية متميزة من الدماغ ( الشكل 1A ) 1 . لذلك، قد تكون هذه الاستراتيجية قادرة على استبدال جسديا مساحات المادة البيضاء المفقودة والخلايا العصبية بعد زرع في منطقة ليسيونيد. هذا الأسلوب هو أيضا مستوحاة من الآليات التنموية التي "السقالات الحية الطبيعية" التي شكلتها الخلايا الدبقية شعاعي والمحاور عصبية رائدة بمثابة أدلة دالة للخليةوالهجرة من المنطقة تحت البطينية ونمو محور عصبي، على التوالي 43 . يتم تلخيص هذه الآليات في محاور محور عصبي الانحياز من تينس الصغرى، والتي يمكن أن تقدم مسارات حية للهجرة الخلايا العصبية وتجديد محور عصبي من قبل محور عصبي بوساطة محور عصبي ( الشكل 1C ) 43 . وعلاوة على ذلك، هذه الاستراتيجية تستفيد من التكامل متشابك بين الخلايا العصبية تين الصغرى والدوائر الأصلية، وتشكيل التبديلات الجديدة التي قد تسهم في الانتعاش وظيفية ( الشكل 1B ) 43 . القدرة على تشكيل المشبك قد تمنح أيضا هذا النهج القدرة على تعديل الجهاز العصبي المركزي والرد على الأنسجة المضيف وفقا لتغذية مرتدة الشبكة. على سبيل المثال، يمكن تحفيز الخلايا العصبية النشطة أوبتوجينيتيكالي في السقالات الحية لتعديل الخلايا العصبية المضيف من خلال التفاعلات متشابك ( الشكل 1D ).
وبالإضافة إلى ذلك، فإن كونستر أنبوبي القائم على المواد البيولوجيةأوكتيون من تينس الصغرى يوفر بيئة كافية لالتصاق الخلايا، والنمو، وتمديد نيوريت، والإشارات، في حين أن أبعاد مصغرة من يبني يمكن أن تسمح غرس زرع الحد الأدنى، وتوفير المكروية جزئيا عزلها للاندماج التدريجي في الدماغ. في الواقع، وقد أظهرت المنشورات الأخيرة إمكانات تينس الصغرى لمحاكاة المسارات العصبية بعد زرع في الدماغ الفئران. وبعد حقن مكروي التجسيمي، ذكرنا سابقا أدلة على البقاء على قيد الحياة الصغرى تين الخلايا العصبية، وصيانة الهندسة المعمارية محور عصبي، وتوسيع العصبية في القشرة المضيف إلى 1 شهر على الأقل في الجسم الحي 10 ، 31 . وعلاوة على ذلك، وضع العلامات مع سينابسين قدمت أدلة نسيجية من التكامل متشابك مع الأنسجة الأصلية 10 ، 31 . وعموما، يمكن أن تكون شبكات تينس الصغرى مناسبة بشكل فريد لإعادة بناء وتعديل التالفنس عن طريق استبدال الخلايا العصبية المفقودة، ودمج متشابك مع الدوائر المضيف، واستعادة المفقودة الهندسة المعمارية المحاور المفقودة، وفي بعض الحالات، وتوفير محاور عصبية تجديد مع العظة المسارات المناسبة.
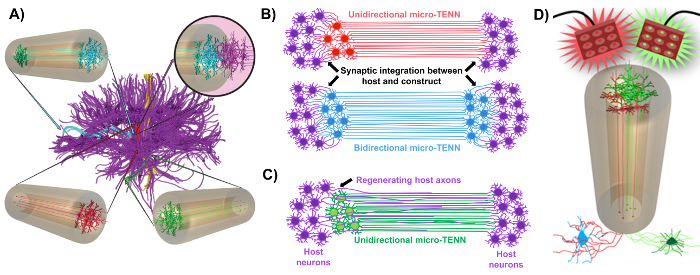
الشكل 1: المبادئ والإلهام وراء تطوير شبكات العصبية الأنسجة الدقيقة المهندسة (تينس الصغرى). ( A ) الصغرى تينس تقليد الهندسة المعمارية الخلوية من الدماغ كونكتوم (الأرجواني)، التي ترتبط مناطق متميزة وظيفيا من قبل طويلة محاذاة محاور عصبية في اتجاه أحادي الاتجاه (الأحمر والأخضر) أو ثنائية الاتجاه (الأزرق). على سبيل المثال، يمكن لشبكات تين الصغرى إعادة تكوين الوصلات المفقودة في المسالك القشرية والنيغروستريتية أو في المسار الثاقب من القشرة المخية إلى الحصين (مقتبس من ستروزينا وآخرون ، 2015) 1 . ( B ) رسم تخطيطي ل أونيديركتيونال و ثنائية الاتجاه الصغرى تين (الأحمر والأزرق، على التوالي) دمج متشابك مع الدوائر المضيف (الأرجواني) لتكون بمثابة تتابع وظيفي بين طرفي الآفة. ( C ) تخطيطي من المسالك المحورية من أحادي الاتجاه تين الصغرى (الأخضر) بمثابة دليل لتجديد يسرع محوار عصبي محاور (الأرجواني) نحو الهدف الذي تتفاعل الصغرى تين. ( D ) الرسم التخطيطي المفاهيمي لاستخدام تينس-أوبتوجينيتيكالي الصغرى تينس كما نيورومودولاتورس، والاستفادة من التكامل متشابك مع الخلايا العصبية استثارة أو مثبطة (القاع). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
المخطوطة الحالية تفاصيل المنهجية المستخدمة في تلفيق الصغرى تينس باستخدام الخلايا العصبية القشرية الدماغية المستمدة من الجنين. ومن الجدير بالذكر أن تينس الصغرى يمكن أن تكون ملفقة مع أنواع أخرى من الخلايا العصبية. على سبيل المثالوافرة، وتقارير أولية ناجحة التنمية الدقيقة الصغرى ظهرت الظهري العقدة الجذرية العقدة (درغ) الخلايا العصبية 32 . يمكن توليد الأعمدة الصغيرة هيدروجيل ( الشكل 2A ) عن طريق إضافة الاغاروز السائل إلى صفيف قناة أسطواني مصنوع حسب الطلب، أو أنابيب الشعرية، على حد سواء تحتوي على محاذاة إبر الوخز بالإبر. الإبرة تشكل التجويف ويحدد القطر الداخلي (إد) من العمود الصغير، في حين أن معرف أنبوب الشعرية وقطر الاسطوانات في جهاز قطع الليزر تملي القطر الخارجي (أود) من يبني. يمكن اختيار أود و إد وفقا للتطبيق المطلوب عن طريق اختيار أقطار مختلفة للجهاز / أنابيب الشعرية وإبر الوخز بالإبر، على التوالي. ويمكن أيضا أن يتغير طول الأعمدة الصغيرة. حتى الآن، أبلغنا عن بناء الصغرى تينس تصل إلى 20 ملم في الطول 10 وتسعى بنشاط حتى أطوال أطول. بعد المواد الهلامية الاغاروز والوخز بالإبر نتتم إزالة إيدلز، يتم إضافة حل إسم تتألف عموما من نوع I الكولاجين و لامينين إلى التجويف من يبني ( الشكل 2C ). يوفر جوهر إسم سقالة لدعم التصاق الخلايا العصبية ونمو محور عصبي. في البداية، كانت الخلايا العصبية القشرية الفئران الأولية مطلي في الأعمدة الصغيرة باستخدام تعليق خلية فصل 10 ، 31 ، 32 . ومع ذلك، فإن هذا النهج لم تنتج الهندسة المعمارية المستهدفة في جميع الحالات، والتي تم تعريفها على أنها الهيئات الخلية العصبية يقتصر على نهايات الأعمدة الصغيرة، مع التجويف المركزي تتألف من محض محاذاة محاور العصبية. ومنذ ذلك الحين، وقد مكن استخدام طريقة التجميع العصبي القسري (على أساس البروتوكولات تكييفها من أونغرين وآخرون ) تصنيع أكثر موثوقية ومتسقة من تينس الصغرى مع هيكل مثالي ( الشكل 2B ) 44 . بالإضافة إلى وصف التيارالمنهجية، هذه المادة سوف تظهر ممثل على النقيض من المرحلة والصور متحد البؤر من تينس الصغرى التي تثبت تشكيل المسالك محور عصبي مع مرور الوقت، فضلا عن الهدف النهائي الهندسة المعمارية. وهذه المخطوطة توسيع أيضا على الجوانب الجديرة بالملاحظة من البروتوكول والتحديات المتبقية والاتجاهات المستقبلية للتكنولوجيا تين الصغرى.
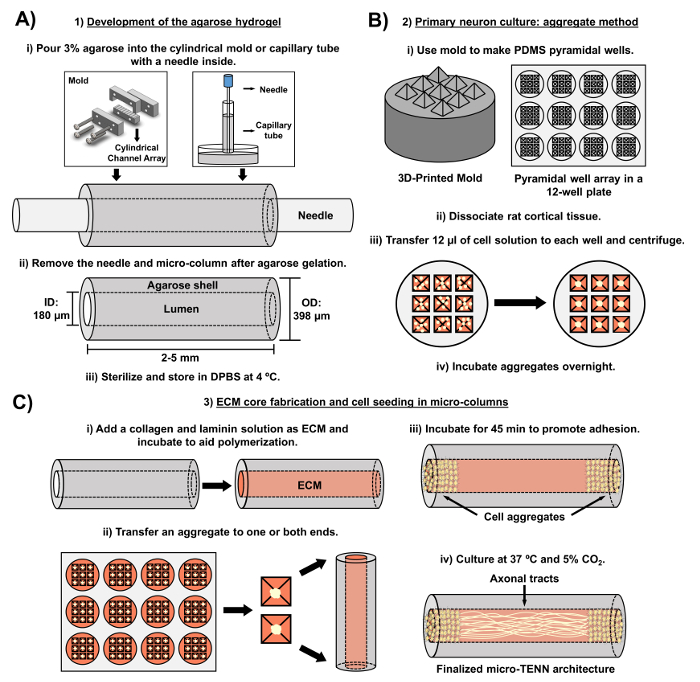
الشكل 2: الرسم التخطيطي لعملية التصنيع الصغرى تين ثلاث مراحل. ( أ ) تطوير هيدروجيل الاغاروز: (1) في البداية، يتم إدخال إبرة الوخز بالإبر الصغيرة (على سبيل المثال ، 180-350 ميكرون في القطر) في القنوات اسطوانية من صنع خصيصا، وقص الليزر قطع أو أنبوب شعري (على سبيل المثال ، 380-700 ميكرون في القطر). في الخطوة التالية، يتم عرض الاغاروز السائل في دبس في القنوات اسطوانية أو أنابيب الشعرية. (إي) بعد المواد الهلامية الاغاروز، تتم إزالة الإبرة ويتم تفكيك القالب لانتاج أجاروس الأعمدة الصغيرة جوفاء. (3) يتم بعد ذلك تعقيم هذه البنايات وتخزينها في دبس. ( ب ) ثقافة الخلايا العصبية الأولية وطريقة التجميع: (1) يتم تنفيذ تجميع الخلايا العصبية في صفيف هرمي الصغرى جيدا، يلقي من قوالب 3D المطبوعة، التي تناسب في آبار لوحة الثقافة 12 جيدا. (2) تشمل الشبكات الصغرى تينس الخلايا العصبية الفئران الأولية فصلها عن أدمغة الجنين من الجنينية-يوم 18 الجرذان. بعد تفكك الأنسجة مع التربسين إدتا ودناز الأول، يتم إعداد محلول خلية مع كثافة 1.0-2.0 × 10 6 خلية / مل. (إي) يتم نقل 12 ميكرولتر من هذا الحل إلى كل بئر في مجموعة هرم الصغيرة أيضا. يتم طرد لوحة تحتوي على هذه الآبار الصغيرة لإنتاج المجاميع الخلية. (4) ثم يتم احتضان هذه بين عشية وضحاها قبل الطلاء في الأعمدة الصغيرة. ( C ) إسم تلفيق الأساسية والبذر الخلية: (ط) قبل زرع الخلايا، والحل إسم تحتوي على 1 ملغ / مل نوع الأول الكولاجين و 1 ملغ / مليتم نقل لامينين إلى المناطق الداخلية من تينس الصغرى ويسمح للبلمرة. (2) اعتمادا على ما إذا كان يتم تصنيع تينس أحادي الاتجاه أو ثنائي الاتجاه تينس، يتم وضع مجمع في واحد أو كليهما من العمود الصغير، على التوالي. (3) بعد فترة من الحضانة لتعزيز الالتصاق، يتم زراعة تينس الصغرى في أطباق بتري غمرت مع المستمدة الجنينية المتوسطة القاعدية العصبية. (4) بعد 3-5 أيام في الثقافة، وينبغي أن الهيكل النهائي تين الدقيقة تظهر مجاميع الخلايا في أقصى النقيض من العمود الصغير، مع مساحات محور عصبي تمتد طوله. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
Representative Results
Discussion
إصابة الجهاز العصبي المركزي والمرض يؤدي عادة إلى فقدان أو خلل في المسارات محور عصبي لمسافات طويلة التي تتألف من كونكتوم الدماغ، مع أو بدون يصاحبها انحطاط الخلايا العصبية. ويضاعف هذا من قبل قدرة محدودة من الجهاز العصبي المركزي لتعزيز الخلايا العصبية والتجدد. على الر?…
Declarações
The authors have nothing to disclose.
Acknowledgements
وقدم الدعم المالي من قبل المعاهد الوطنية للصحة U01-NS094340 (كولين)، T32-NS043126 (هاريس)، و F31-NS090746 (كاتيار))، ومؤسسة مايكل J. فوكس (برنامج خط العلاج العلاجي # 9998 (كولين))، والرابطة الوطنية للعلوم (زمالات بحوث الدراسات العليا دج-1321851 (ستروزينا وأديوول))، وإدارة شؤون المحاربين القدامى (ر & D استعراض ميرت # B1097-I (كولين))، والجمعية الأمريكية من الجراحين العصبية وكونجرس الجراحين العصبية (2015-2016 زمالة كودمان في نيوروتراوما والرعاية الحرجة (بتروف))، والبحوث الطبية الجيش الأميركي وقيادة العتاد (# W81XWH-13-207004 (كولين) و W81XWH-15-1- 0466 (كولين)).
Materials
| Laser cutter | Universal Laser Systems | PLS4.75 | Used to fabricate the laser-cut micro-channel mold. |
| Laser-cut micro-column fabrication device | Custom-made | ————– | Contact our research group if interested. Dimensions and blueprints provided in the manuscript. |
| Screws | ————– | ————– | #4-40 with a thread diameter of 3.05 mm |
| Nuts | ————– | ————– | #4-40 with a thread diameter of 3.05 mm |
| Acupuncture needle (180 µm diameter) | Lhasa Medical | sj.16X40 | The diameter may be varied according to the desired size for the micro-column lumen. |
| Petri dish | Fisher | 08772B | |
| Dulbecco's phosphate buffered saline (DPBS) | Invitrogen | 14200075 | |
| Polystyrene disposable serological pipet | Fisher | 13-678-11D | |
| Agarose | Sigma | A9539-50G | |
| Capillary tube (398 µm diameter) | Fisher | 21170D | The diameter may be varied according to the desired size for the micro-column shell. |
| Hot plate | Fisher | SP88857200 | |
| Magnetic bar | Fisher | 1451352 | |
| Micropipette | Sigma | Z683884-1EA | |
| 25 mm gauge needle | Fisher | 14-826-49 | |
| Microscalpel | Roboz Surgical | RS-6270 | |
| Scissors | Fine Science Tools | 14081-09 | |
| Forceps | World Precision Instruments | 501985 | |
| Hot bead sterilizer | Sigma | Z378550-1EA | |
| Stereoscope | Nikon | SMZ800N | Used for all dissection steps and for micro-TENN fabrication. |
| Rat tail type I collagen | Corning | 354236 | Maintain at 4 ºC and remove only when needed. Use ice to preserve its temperature when in use. |
| Microcentrifuge tube | Fisher | 02-681-256 | |
| Mouse laminin | Corning | 354232 | Maintain at 4 ºC and remove only when needed. Use ice to preserve its temperature when in use. |
| Neurobasal medium | Invitrogen | 21103049 | Basal medium for the culture of pre-natal and embryonic neuronal cells. Store at 4ºC and warm at 37 ºC before use. |
| Sodium hydroxide (NaOH) | Fisher | SS2661 | |
| Hydrochloric acid (HCl) | Fisher | SA48-1 | |
| Litmus paper | Fisher | 09-876-18 | |
| Hank's balanced salt solution (HBSS) | Invitrogen | 14170112 | Store at 4 ºC. |
| 0.25% Trypsin-EDTA | Invitrogen | 25200056 | Store at -20 ºC and warm at 37 ºC before use. |
| Bovine pancreatic deoxyribonuclease (DNase) I | Sigma | 10104159001 | Store at -20 ºC and warm at 37 ºC before use. |
| B-27 Supplement | Invitrogen | 12587010 | Supplement added to Neurobasal medium for the culture of hippocampal and cortical neurons. Store at -20 ºC and warm at 37 ºC before use. |
| L-glutamine | Invitrogen | 35050061 | Store at -20 ºC and warm at 37 ºC before use. |
| Sprague Dawley embryonic day 18 rats | Charles River | Strain 001 | |
| Pasteur pipette | Fisher | 22-042816 | |
| 15 mL centrifuge tube | EMESCO | 1194-352099 | |
| Vortex | Fisher | 02-215-414 | |
| Centrifuge | Fisher | 05-413-115 | |
| Hemocytometer | Fisher | 02-671-6 | |
| Objet30 3D-Printer | Stratasys | ————– | Used to fabricate the pyramidal micro-well molds. |
| 3D-printed pyramidal well mold | Custom-made | ————– | Contact our research group if interested. Dimensions and blueprints provided in the manuscript. |
| Polydimethylsiloxane (PDMS) and curing agent | Fisher | NC9285739 | Comes as kit with elastomer and curing agent. Use inside a chemical fume hood. |
| Funnel | Fisher | 10-348C | |
| 1 ml pipette bulb | Sigma | Z509035 | |
| Micro-spatula | Fisher | S50821 | |
| 12-well culture plate | EMESCO | 1194-353043 | |
| Oven | Fisher | 11-475-154 | |
| Incubator | Fisher | 13 998 076 | |
| AAV1.Syn.GCaMP6f.WPRE.SV40 | UPenn Vector Core | 36373 | Store at -80ºC. Commercially available adeno-associated virus (AAV) with the GCaMP6f calcium indicator. |
| Formaldehyde 40% | Fisher | F77P-4 | Formaldehyde is a toxic compound known to be carcinogenic, and must be disposed of in a separate container. |
| Triton X-100 | Sigma | T8787 | Non-ionic surfactant used to permeabilize cell membranes. |
| Horse serum | Gibco | 16050-122 | |
| Mouse anti-Tuj-1/beta-III tubulin primary antibody | Sigma | T8578-200UL | Store at -20ºC. |
| Rabbit anti-synapsin 1 primary antibody | Synaptic Systems | 106-001 | Store at -20ºC. |
| Donkey anti-mouse 568 secondary antibody | Invitrogen | A10037 | Store at 4ºC. |
| Donkey anti-rabbit 488 secondary antibody | Invitrogen | A21206 | Store at 4ºC. |
| Hoechst 33342, Trihydrochloride | Invitrogen | H3570 | Store at 4ºC. Hoechst is a known mutagen that should be treated as a carcinogen. Therefore, it must be disposed of in a separate container. |
| A1RSI Laser Scanning Confocal Microscope | Nikon | ————– | Used for taking the confocal reconstructions of immunolabeled constructs. |
| Eclipse Ti-S Microscope | Nikon | ————– | Used for taking the phase-contrast images. With digital image acquisition using a QiClick camera interfaced with Nikon Elements Basic Research software (4.10.01). |
| High-speed Fluorescence Microscope | Nikon | ————– | Nikon Eclipse Ti microscope paired with an ANDOR Neo/Zyla camera for calcium imaging. |
| NIS Elements AR 4.50.00 Software | Nikon Instruments | ————– | Used to identify calcium transients from the recordings taken with the high-speed fluorescence microscope. |
Referências
- Struzyna, L. A., Harris, J. P., Katiyar, K. S., Chen, H. I., Cullen, D. K. Restoring nervous system structure and function using tissue engineered living scaffolds. Neural Regen. Res. 10 (5), 679-685 (2015).
- Tallantyre, E. C., Bø, L., et al. Clinico-pathological evidence that axonal loss underlies disability in progressive multiple sclerosis. Mult. Scler. 16 (4), 406-411 (2010).
- Cheng, H. C., Ulane, C. M., Burke, R. E. Clinical Progression in Parkinson Disease and the Neurobiology of Axons. Ann. Neurol. 67 (6), 715-725 (2010).
- Johnson, V. E., Stewart, W., Smith, D. H. Axonal pathology in traumatic brain injury. Exp. Neurol. 246, 35-43 (2013).
- Hinman, J. D. The back and forth of axonal injury and repair after stroke. Curr. Opin. Neurol. 27 (6), 615-623 (2014).
- Li, X., Katsanevakis, E., Liu, X., Zhang, N., Wen, X. Engineering neural stem cell fates with hydrogel design for central nervous system regeneration. Prog. Polym. Sci. 37 (8), 1105-1129 (2012).
- Horner, P. J., Gage, F. H. Regenerating the damaged central nervous system. Nature. 407 (6807), 963-970 (2000).
- Yiu, G., He, Z. Glial inhibition of CNS axon regeneration. Nat. Rev. Neurosci. 7 (8), 617-627 (2006).
- Montani, L., Petrinovic, M. M. Targeting Axonal Regeneration: The Growth Cone Takes the Lead. J. Neurosci. 34 (13), 4443-4444 (2014).
- Struzyna, L. A., Wolf, J. A., et al. Rebuilding Brain Circuitry with Living Micro-Tissue Engineered Neural Networks. Tissue Eng. Part A. 21 (21-22), 2744-2756 (2015).
- Huebner, E. a., Strittmatter, S. M. Axon Regeneration in the Peripheral and Central Nervous Systems. Results Probl. Cell Differ. 48, 339-351 (2009).
- Benowitz, L. I., Yin, Y. Combinatorial Treatments for Promoting Axon Regeneration in the CNS: Strategies for Overcoming Inhibitory Signals and Activating Neurons’ Intrinsic Growth State. Dev. Neurobiol. 67 (9), 1148-1165 (2007).
- Lie, D. C., Song, H., Colamarino, S. A., Ming, G., Gage, F. H. Neurogenesis in the Adult Brain: New Strategies for Central Nervous System Diseases. Annu. Rev. Pharmacol. Toxicol. 44, 399-421 (2004).
- Gao, Y., Yang, Z., Li, X. Regeneration strategies after the adult mammalian central nervous system injury-biomaterials. Regen. Biomater. 3 (2), 115-122 (2016).
- Benfey, M., Aguayo, A. J. Extensive elongation of axons from rat brain into peripheral nerve grafts. Nature. 296 (11), 150-152 (1982).
- David, S., Aguayo, A. J. Axonal Elongation into Peripheral Nervous System “Bridges” after Central Nervous System Injury in Adult Rats. Science. 214 (4523), 931-933 (1981).
- Shoichet, M. S., Tate, C. C., Baumann, M. D., LaPlaca, M. C. Strategies for Regeneration and Repair in the Injured Central Nervous System. Indwelling Neural Implant. Strateg. Contend. with Vivo Environ. , (2008).
- Lu, P., Tuszynski, M. H. Growth factors and combinatorial therapies for CNS regeneration. Exp. Neurol. 209 (2), 313-320 (2008).
- Curinga, G., Smith, G. M. Molecular/genetic manipulation of extrinsic axon guidance factors for CNS repair and regeneration. Exp. Neurol. 209 (2), 333-342 (2008).
- Mehta, S. T., Luo, X., Park, K. K., Bixby, J. L., Lemmon, V. P. Hyperactivated Stat3 boosts axon regeneration in the CNS. Exp. Neurol. 280, 115-120 (2016).
- Elliott Donaghue, I., Tam, R., Sefton, M. V., Shoichet, M. S. Cell and biomolecule delivery for tissue repair and regeneration in the central nervous system. J. Control. Release. 190, 219-227 (2014).
- Tam, R. Y., Fuehrmann, T., Mitrousis, N., Shoichet, M. S. Regenerative therapies for central nervous system diseases: a biomaterials approach. Neuropsychopharmacology. 39 (1), 169-188 (2014).
- Cullen, D. K., Wolf, J. A., Smith, D. H., Pfister, B. J. Neural Tissue Engineering for Neuroregeneration and Biohybridized Interface Microsystems In vivo (Part 2). Crit. Rev. Biomed. Eng. 39 (3), 243-262 (2011).
- Han, Q., Jin, W., et al. The promotion of neural regeneration in an extreme rat spinal cord injury model using a collagen scaffold containing a collagen binding neuroprotective protein and an EGFR neutralizing antibody. Biomaterials. 31 (35), 9212-9220 (2010).
- Suzuki, H., Kanchiku, T., et al. Artificial collagen-filament scaffold promotes axon regeneration and long tract reconstruction in a rat model of spinal cord transection. Med. Mol. Morphol. 48 (4), 214-224 (2015).
- Silva, N. A., Salgado, A. J., et al. Development and Characterization of a Novel Hybrid Tissue Engineering-Based Scaffold for Spinal Cord Injury Repair. Tissue Eng. Part A. 16 (1), 45-54 (2009).
- Moore, M. J., Friedman, J. A., et al. Multiple-channel scaffolds to promote spinal cord axon regeneration. Biomaterials. 27 (3), 419-429 (2006).
- Tsai, E. C., Dalton, P. D., Shoichet, M. S., Tator, C. H. Synthetic hydrogel guidance channels facilitate regeneration of adult rat brainstem motor axons after complete spinal cord transection. J. Neurotrauma. 21 (6), 789-804 (2004).
- Chen, B. K., Knight, A. M., et al. Axon regeneration through scaffold into distal spinal cord after transection. J. Neurotrauma. 26 (10), 1759-1771 (2009).
- Jain, A., Kim, Y. -. T., McKeon, R. J., Bellamkonda, R. V. In situ gelling hydrogels for conformal repair of spinal cord defects, and local delivery of BDNF after spinal cord injury. Biomaterials. 27 (3), 497-504 (2006).
- Harris, J. P., Struzyna, L. A., Murphy, P. L., Adewole, D. O., Kuo, E., Cullen, D. K. Advanced biomaterial strategies to transplant preformed micro-tissue engineered neural networks into the brain. J. Neural Eng. 13 (1), 16019-16037 (2016).
- Cullen, D. K., Tang-Schomer, M. D., et al. Microtissue engineered constructs with living axons for targeted nervous system reconstruction. Tissue Eng. Part A. 18 (21-22), 2280-2289 (2012).
- Tate, M. C., Shear, D. A., Hoffman, S. W., Stein, D. G., Archer, D. R., LaPlaca, M. C. Fibronectin promotes survival and migration of primary neural stem cells transplanted into the traumatically injured mouse brain. Cell Transplant. 11 (3), 283-295 (2002).
- Denham, M., Parish, C. L., et al. Neurons derived from human embryonic stem cells extend long-distance axonal projections through growth along host white matter tracts after intra-cerebral transplantation. Front. Cell. Neurosci. 6 (11), (2012).
- Fawcett, J. W., Barker, R. A., Dunnet, S. B. Dopaminergic neuronal survival and the effects of bFGF in explant, three dimensional and monolayer cultures of embryonic rat ventral mesencephalon. Exp. Brain Res. 106 (2), 275-282 (1995).
- Mine, Y., Tatarishvili, J., Oki, K., Monni, E., Kokaia, Z., Lindvall, O. Grafted human neural stem cells enhance several steps of endogenous neurogenesis and improve behavioral recovery after middle cerebral artery occlusion in rats. Neurobiol. Dis. 52, 191-203 (2013).
- Ren, H., Chen, J., Wang, Y., Zhang, S., Zhang, B. Intracerebral neural stem cell transplantation improved the auditory of mice with presbycusis. Int. J. Clin. Exp. Pathol. 6 (2), 230-241 (2013).
- Sinclair, S. R., Fawcett, J. W., Dunnett, S. B. Dopamine cells in nigral grafts differentiate prior to implantation. Eur. J. Neurosci. 11 (12), 4341-4348 (1999).
- Tate, C. C., Shear, D. A., Stein, D. G., Tate, M., LaPlaca, M. C., Archer, D. R. Laminin and fibronectin scaffolds enhance neural stem cell transplantation into the injured brain. J. Tissue Eng. Regen. Med. 3 (3), 208-217 (2009).
- Yoo, S. J., Kim, J., Lee, C. -. S., Nam, Y. Simple and novel three dimensional neuronal cell culture using a micro mesh scaffold. Exp. Neurobiol. 20 (2), 110-115 (2011).
- Chen, H. I., Jgamadze, D., Serruya, M. D., Cullen, D. K., Wolf, J. A., Smith, D. H. Neural Substrate Expansion for the Restoration of Brain Function. Front. Syst. Neurosci. 10, (2016).
- Cullen, D. K., Wolf, J. A., Vernekar, V. N., Vukasinovic, J., LaPlaca, M. C. Neural tissue engineering and biohybridized microsystems for neurobiological investigation in vitro (Part 1). Crit. Rev. Biomed. Eng. 39 (3), 201-240 (2011).
- Struzyna, L. A., Katiyar, K., Cullen, D. K. Living scaffolds for neuroregeneration. Curr. Opin. Solid State Mater. Sci. 18 (6), 308-318 (2014).
- Ungrin, M. D., Joshi, C., Nica, A., Bauwens, C., Zandstra, P. W. Reproducible, ultra high-throughput formation of multicellular organization from single cell suspension-derived human embryonic stem cell aggregates. PLoS One. 3 (2), (2008).
- Dahotre, N. B., Harimkar, S. . Laser fabrication and machining of materials. , (2008).
- Kutter, J. P., Klank, H., Snakenborg, D. Microstructure fabrication with a CO2 laser system. J. Micromechanics Microengineering. 14 (2), (2004).
- Spicar-Mihalic, P., Houghtaling, J., Fu, E., Yager, P., Liang, T., Toley, B. CO2 laser cutting and ablative etching for the fabrication of paper-based devices. J. Micromechanics Microengineering. 23 (6), (2013).
- Pacifici, M., Peruzzi, F. Isolation and culture of rat embryonic neural cells: a quick protocol. J. Vis. Exp. (63), (2012).
- Cullen, D. K., Gilroy, M. E., Irons, H. R., Laplaca, M. C. Synapse-to-neuron ratio is inversely related to neuronal density in mature neuronal cultures. Brain Res. 1359, 44-55 (2010).
- Huang, J. H., Cullen, D. K., et al. Long-Term Survival and Integration of Transplanted Engineered Nervous Tissue Constructs Promotes Peripheral Nerve Regeneration. Tissue Eng. Part A. 15 (7), 1677-1685 (2009).
- Katiyar, K. S., Winter, C. C., Struzyna, L., Harris, J. P., Cullen, D. K. Mechanical elongation of astrocyte processes to create living scaffolds for nervous system regeneration. J. Tissue Eng. Regan. Med. , (2016).
- Howard, M. A., Baraban, S. C. Synaptic integration of transplanted interneuron progenitor cells into native cortical networks. J. Neurophysiol. 116 (2), 472-478 (2016).
- Wernig, M., Benninger, F., et al. Functional Integration of Embryonic Stem Cell-Derived Neurons In Vivo. J. Neurosci. 24 (22), 5258-5268 (2004).
- Ganguly, K., Poo, M. Activity-dependent neural plasticity from bench to bedside. Neuron. 80 (3), 729-741 (2013).
- Dancause, N. Extensive Cortical Rewiring after Brain Injury. J. Neurosci. 25 (44), 10167-10179 (2005).
- Winter, C. C., Katiyar, K. S., et al. Transplantable living scaffolds comprised of micro-tissue engineered aligned astrocyte networks to facilitate central nervous system regeneration. Acta Biomater. 38, 44-58 (2016).
- Adewole, D. O., Serruya, M. D., et al. The Evolution of Neuroprosthetic Interfaces. Crit. Rev. Biomed. Eng. 44 (1-2), 123-152 (2016).
- Cullen, D. K., Patel, A., Doorish, J. F., Smith, D. H., Pfister, B. J. Developing a tissue-engineered neural-electrical relay using encapsulated neuronal constructs on conducting polymer fibers. J. Neural Eng. 5 (4), 374-384 (2008).
- Cullen, D. K., Stabenfeldt, S. E., Simon, C. M., Tate, C. C., LaPlaca, M. C. In Vitro Neural Injury Model for Optimization of Tissue-Engineered Constructs. J. Neurosci. Res. 85, 3642-3651 (2007).
- Irons, H. R., Cullen, D. K., Shapiro, N. P., Lambert, N. A., Lee, R. H., Laplaca, M. C. Three-dimensional neural constructs: a novel platform for neurophysiological investigation. J. Neural Eng. 5 (3), 333-341 (2008).
- Morrison, B. I., Cullen, D. K., LaPlaca, M. In Vitro Models for Biomechanical Studies of Neural Tissues. Stud. Mechanobiol. Tissue Eng. Biomater. 3, 247-285 (2011).
- Vukasinovic, J., Cullen, D. K., Laplaca, M. C., Glezer, A. A microperfused incubator for tissue mimetic 3D cultures. Biomed. Microdevices. 11 (6), 1155-1165 (2009).
- Cullen, D. K., Lessing, M. C., Laplaca, M. C. Collagen-dependent neurite outgrowth and response to dynamic deformation in three-dimensional neuronal cultures. Ann. Biomed. Eng. 35 (5), 835-846 (2007).
- LaPlaca, M. C., Vernekar, V. N., Shoemaker, J. T., Cullen, D. K. Three-dimensional neuronal cultures. Methods Bioeng. 3D Tissue Eng. , (2010).
- Chwalek, K., Tang-Schomer, M. D., Omenetto, F. G., Kaplan, D. L. In vitro bioengineered model of cortical brain. Nat. Protoc. 10 (9), 1362-1373 (2015).

