Redes neuronais modificadas por micro-tecidos tridimensionais com inspiração anatômica para a reconstrução, modulação e modelagem do sistema nervoso
Summary
Este manuscrito detalha a fabricação de redes neurais manipuladas com micro-tecidos: construções tridimensionais de tamanho micrométrico, constituídas por longos trilhos axonais alinhados que abrangem a (s) população (s) neuronal agregada (s) envolvida (s) em um hidrogel tubular. Esses andaimes vivos podem servir como relés funcionais para reconstruir ou modular circuitos neurais ou como bancas biofidais que imitam a neuroanatomia de matéria cinza-branca.
Abstract
A recuperação funcional raramente ocorre após uma lesão ou degeneração induzida por doença no sistema nervoso central (SNC) devido ao ambiente inibitório e à capacidade limitada de neurogênese. Estamos desenvolvendo uma estratégia para abordar simultaneamente a perda de via neuronal e axonal no SNC danificado. Este manuscrito apresenta o protocolo de fabricação de redes neurais modificadas com micro-tecidos (micro-TENNs), construções implantáveis constituídas por neurônios e traços axonais alinhados que abrangem o lúmen da matriz extracelular (ECM) de um cilindro de hidrogel pré-formado com centenas de microns de diâmetro que podem se estender centimetros em comprimento. Os agregados neuronais são delimitados aos extremos do encasamento tridimensional e são abrangidos por projeções axonais. Os MicroTENNs são unicamente posicionados como uma estratégia para a reconstrução do SNC, emulando aspectos da citoarquitetura de conexão do cérebro e potencialmente fornecendo meios para a substituição da rede. O neuOs agregados ronais podem sinapse com o tecido hospedeiro para formar novos relés funcionais para restaurar e / ou modular circuitos faltantes ou danificados. Essas construções também podem atuar como "andaimes vivos" pró-regenerativos capazes de explorar mecanismos de desenvolvimento para a migração celular e a localização do axonal, fornecendo pistas sinergísticas estruturais e solúveis com base no estado de regeneração. Micro-TENNs são fabricados por vazamento de hidrogel líquido em um molde cilíndrico contendo uma agulha centrada longitudinalmente. Uma vez que o hidrogel tenha gelado, a agulha é removida, deixando uma micro-coluna oca. Uma solução ECM é adicionada ao lúmen para fornecer um ambiente adequado para adesão neuronal e crescimento axonal. Os neurônios dissociados são agregados mecanicamente para semeadura precisa dentro de uma ou ambas as extremidades da micro-coluna. Esta metodologia produz de forma confiável construções em miniatura autônomas com traços axonais de longa projeção que podem recapitular características da neuroanatomia cerebral. Synaptic immIndicadores de cálcio não genéricos e codificados genômicamente sugerem que micro-TENNs possuem ampla distribuição sináptica e atividade elétrica intrínseca. Conseqüentemente, os microTENNs representam uma estratégia promissora para a reconstrução neurocirúrgica direta de caminhos cerebrais e também podem ser aplicados como modelos biofidelicos para estudar fenômenos neurobiológicos in vitro .
Introduction
Uma característica comum de distúrbios e doenças do sistema nervoso central (SNC), como lesão cerebral traumática (TCE), lesão da medula espinhal (AVC), acidente vascular cerebral, doença de Alzheimer e doença de Parkinson é a desconexão das vias axonais e células neuronais Perda 1 , 2 , 3 , 4 , 5 , 6 . Por exemplo, quando um acidente vascular cerebral isquêmico não é tratado, estima-se que os axônios sejam perdidos a uma taxa de 7 milhas de axônios por minuto 5 . No caso do TBI, que aproximadamente 1,7 milhões de pessoas experimentam anualmente apenas nos EUA, a degeneração axonal pode continuar a ocorrer anos após o trauma, já que a lesão inicial precipita um estado neurodegenerativo de longo prazo 4 . Agravando esses efeitos deletérios, o SNC tem uma capa severamente limitadaCidade para regeneração 1 , 7 , 8 , 9 . Após a lesão, desenvolve-se um ambiente inibidor caracterizado pela falta de orientação dirigida para alvos distantes, a presença de inibidores associados à mielina que impedem a proliferação de neurites e a formação de uma cicatriz glial por astrocitos reativos 8 , 10 , 11 , 12 . A cicatriz glial serve como uma barreira bioquímica e física à regeneração, com moléculas como os proteoglicanos de sulfato de condroitina que obstruem o crescimento do axônio 8 , 11 . Além disso, mesmo que as células estaminais neurais tenham sido encontradas no SNC adulto, a produção de novos neurônios é limitada, uma vez que evidências consistentes de neurogênese só foram encontradas no bulbo olfativo, no hipocampoZona subgranular, área periventricular e canal central da medula espinhal 13 , 14 . Esses obstáculos impedem a recuperação funcional de neurônios perdidos e arquitetura de matéria branca após lesão ou doença, resultando em efeitos que muitas vezes mudam a vida e prolongam essas condições.
Apesar da falta de capacidade regenerativa no SNC adulto, demonstrou-se que a regeneração axonal é possível se houver sugestões ambientais adequadas para os neurônios hospedeiros 15 , 16 , 17 , 18 . Os pesquisadores tentaram entregar e manipular fatores de crescimento ( por exemplo, fator de crescimento nervoso, fator de crescimento epidérmico, fator de crescimento dependente da glia e fator neurotrófico 3) e outras moléculas de orientação para estimular a plasticidade e a regeneração do axônio 14 , </ Sup> 18 , 19 . Embora esses estudos tenham confirmado que os axônios adultos são capazes de responder a fatores de crescimento, essas estratégias são limitadas pela baixa permeabilidade da barreira hematoencefálica e pelos gradientes espaciais e temporais específicos necessários para promover a regeneração 14 , 18 , 19 . Outras abordagens basearam-se na hiperativação de fatores de transcrição relacionados à regeneração em neurônios do SNC. Por exemplo, a sobre-expressão do fator de transcrição Stat3 estimulou a regeneração axonal no nervo óptico 20 . No entanto, tanto a administração de biomoléculas como a sobreexpressão de fatores de transcrição não conseguem substituir as populações neuronais perdidas. As estratégias baseadas em células centraram-se principalmente no transplante de células-tronco neurais (NSCs) para o SNC, aproveitando sua capacidade para substituir os neurônios do SNC, liberar fatores tróficos,E apoiam as tentativas de neurogênese que ocorrem após a lesão 17 . Apesar disso, ainda há desafios urgentes que impedem essa abordagem, incluindo a habilidade dificultada das células neurais transplantadas para sobreviver, integrar-se ao hospedeiro e permanecer restrita espacialmente à área lesada 6 , 14 , 17 , 21 . Além disso, a administração de células sozinha é incapaz de restabelecer a citoarquitetura de percursos axonais danificados ou perdidos. Uma abordagem alternativa que aborda os problemas que enfrentam as estratégias de entrega de células e drogas / químicas é combinar essas abordagens com o uso de biomateriais 14 , 22 , 23 . Os biomateriais, como os hidrogéis, são capazes de emular as propriedades bioquímicas e físicas da matriz extracelular (ECM), auxiliando na administração celular eRetenção dentro da área lesada e fornecimento de fatores de crescimento e outras moléculas bioativas com liberação controlada 22 . As características atraentes dessas estratégias baseadas em biomateriais resultaram em evidências de regeneração axonal in vivo após o transplante de andaimes para a área lesada 24 , 25 , 26 , 27 , 28 , 29 , 30 . No entanto, as estratégias biomateriais acelulares não substituem as populações neuronais perdidas; Quando utilizados como veículos de entrega para células precursoras neuronais, gliais ou neuronais, os biomateriais são incapazes de reconstituir redes axonais de longa distância. O desafio de desenvolver uma abordagem que aborda a degeneração da via axonal e a perda neuronal associada à lesão e à doença do SNC ainda permanecem <Sup class = "xref"> 31.
Nosso grupo de pesquisa relatou anteriormente o desenvolvimento de redes neurais implantáveis de micro-tecido (micro-TENNs), que são um tipo de "andaime vivo" que consiste de corpos celulares neuronais restritos a uma ou ambas as extremidades de uma micro coluna de hidrogel-ECM de agarose , Com traços axonais alinhados que se estendem por todo o interior deste encasamento tridimensional (3D) 1 , 10 , 31 , 32 . Uma das principais diferenças entre essa técnica e as abordagens anteriores é que a citocantação de microTENNs é criada completamente in vitro e é transplantada posteriormente 33 , 34 , 35 , 36 , 37 , 38 , <Sup class = "xref"> 39 , 40 , 41 . A fabricação in vitro oferece um extenso controle espacial e temporal do fenótipo e orientação celular, propriedades mecânicas / físicas, sugestões bioquímicas e fatores exógenos, o que beneficia a integração desses andaimes com o hospedeiro após a implantação 41 , 42 . Micro-TENNs são anatomicamente inspirados porque imitam a neuroanatomia do cérebro, exibindo traços axonais semelhantes aos que fazem a ponte entre as distintas regiões funcionais do cérebro ( Figura 1A ) 1 . Portanto, esta estratégia pode ser capaz de substituir fisicamente os tratos de matéria branca perdidos e os neurônios após a implantação em uma região lesionada. Esta técnica também é inspirada por mecanismos de desenvolvimento em que "andaimes vivos naturais" formados por células gliais radiais e axônios pioneiros atuam como guias de encaminhamento para célulasMigração da zona subventricular e crescimento axonal, respectivamente 43 . Esses mecanismos são recapitulados nos tratos axonais alinhados dos microTENNs, que podem apresentar vias vivas para a migração de células neurais e regeneração axonal por crescimento axonal mediado por axônio ( Figura 1C ) 43 . Além disso, esta estratégia aproveita a integração sináptica entre os neurônios micro-TENN e os circuitos nativos, formando novos relés que podem contribuir para a recuperação funcional ( Figura 1B ) 43 . A capacidade de formação de sinapse também pode conceder a essa abordagem a capacidade de modular o SNC e responder ao tecido do hospedeiro de acordo com o feedback da rede. Por exemplo, neurônios optogeneticamente ativos nos andaimes vivos podem ser estimulados para modular os neurônios do hospedeiro através de interações sinápticas ( Figura 1D ).
Além disso, a construção tubular baseada em biomateriaisA criação de microTENNs oferece um ambiente adequado para adesão celular, crescimento, extensão de neurite e sinalização, enquanto as dimensões em miniatura das construções potencialmente permitem implantação minimamente invasiva e fornecem um microambiente parcialmente seqüestrado para integração gradual no cérebro. Na verdade, publicações recentes demonstraram o potencial dos micro-TENNs para imitar os caminhos neurais após a implantação no cérebro do rato. Após microinjeção estereotáxica, anteriormente relatamos evidências de sobrevivência neuronal micro-TENN, manutenção da arquitetura do traço axonal e extensão de neurite no córtex do hospedeiro até pelo menos 1 mês in vivo 10 , 31 . Além disso, a rotulagem com sinapsina forneceu evidência histológica de integração sináptica com tecido nativo 10 , 31 . Em geral, os microTENNs podem ser unicamente adequados para reconstruir e modularCNS, substituindo os neurônios perdidos, integrando sinapticamente os circuitos do host, restaurando a citoarquitetura axonal perdida e, em certos casos, fornecendo axônios regeneradores com os sinais de detecção de caminho adequados.
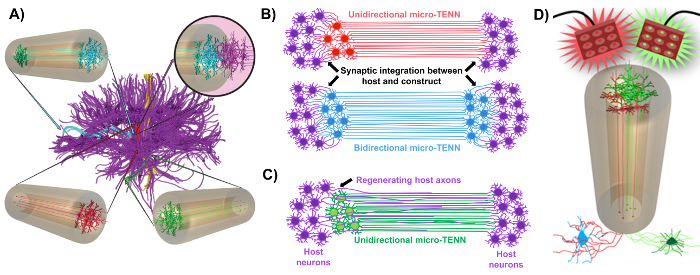
Figura 1: Princípios e inspiração por trás do desenvolvimento de redes neurais modificadas por micro-tecidos (micro-TENNs). ( A ) Micro-TENNs imitam a citoarquitetura do cérebro connectome (roxo), em que regiões funcionalmente distintas são conectadas por trilhos axonais longos e alinhados de maneira unidirecional (vermelha, verde) ou bidirecional (azul). Por exemplo, os microTENNs poderiam reconstituir conexões perdidas nas vias corticotalâmicas e nigrostriatais ou na via perfurante do córtex entorrinal ao hipocampo (adaptado de Struzyna et al. , 2015) 1 . ( B ) Diagrama de uma unidirectionaL e micro-TENN bidirecional (vermelho e azul, respectivamente) integrando sinapticamente com o circuito do host (roxo) para servir como um relé funcional entre as duas extremidades de uma lesão. ( C ) Esquema dos traços axonais de um micro-TENN (verde) unidirecional que serve como guia para a regeneração facilitada por axônio de axônios hospedeiros (roxo) em direção a um alvo com o qual o micro-TENN interage. ( D ) Diagrama conceitual do uso de microTENNS ativos optogeneticamente como neuromoduladores, aproveitando a integração sináptica com neurônios excitatórios ou inibitórios (parte inferior). Clique aqui para ver uma versão maior desta figura.
O manuscrito atual detalha a metodologia utilizada para fabricar micro-TENNs utilizando neurônios corticais cerebrais derivados de embriões. Notavelmente, os microTENNs podem ser fabricados com outros tipos de células neurais. Por exAmplo, os relatórios iniciais de desenvolvimento micro-TENN bem-sucedido apresentaram neurônios de gânglios de raízes dorsais (DRG) 32 . As microcolunas de hidrogel podem ser geradas ( Figura 2A ) pela adição de agarose líquida a uma disposição de canais cilíndricos personalizados ou cortados a laser ou a tubos capilares, ambos contendo agulhas de acupuntura alinhadas. A agulha forma o lúmen e determina o diâmetro interno (ID) da micro-coluna, enquanto a identificação do tubo capilar e o diâmetro dos cilindros no dispositivo de corte a laser determinam o diâmetro externo (OD) das construções. O OD e ID podem ser escolhidos de acordo com a aplicação desejada selecionando diâmetros diferentes para o dispositivo / tubos capilares e as agulhas de acupuntura, respectivamente. O comprimento das micro colunas também pode ser variado; Até à data, relatamos a construção de microTENNs de até 20 mm de comprimento 10 e seguimos ativamente até longos períodos. Após os géis de agarose e a acupuntura nOs eedles são removidos, uma solução ECM geralmente consistindo em colágeno tipo I e laminina é adicionada ao lúmen das construções ( Figura 2C ). O núcleo ECM fornece um andaime para suportar a adesão celular neuronal e a expansão axonal. Inicialmente, os neurônios corticais de ratos primários foram plaqueados nas micro-colunas usando suspensões de células dissociadas 10 , 31 , 32 . No entanto, essa abordagem não produziu a citoarquitetura alvo em todos os casos, que foi definida como os corpos celulares neuronais restritos às extremidades das micro colunas, com a luz central composta por trilhos axonais alinhados. Desde então, o uso de um método de agregação neuronal forçada (com base em protocolos adaptados de Ungrin et al .) Permitiu uma fabricação mais confiável e consistente de microTENNs com a estrutura ideal ( Figura 2B ) 44 . Além de descrever o atualMetodologia, este artigo mostrará imagens representativas de contraste de fase e confocal de microTENNs que demonstram a formação de trilhos axonais ao longo do tempo, bem como a cito-arquitetura de destino finalizada. Este manuscrito também expandirá os aspectos notáveis do protocolo e os demais desafios e direções futuras da tecnologia micro-TENN.
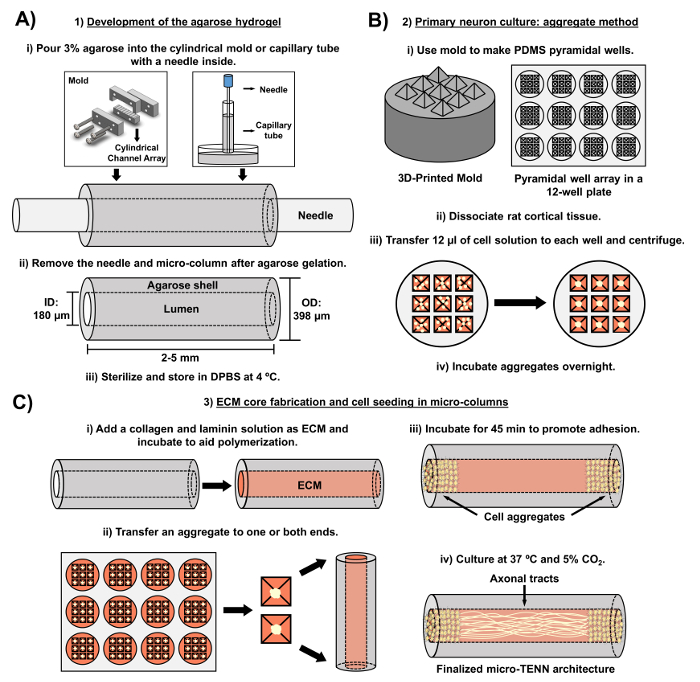
Figura 2: Diagrama esquemático do processo de fabricação de três estágios micro-TENN. ( A ) Desenvolvimento do hidrogel de agarose: (i) Inicialmente, uma pequena agulha de acupuntura ( por exemplo , 180-350 μm de diâmetro) é inserida nos canais cilíndricos de um molde personalizado por corte a laser ou um tubo capilar ( por exemplo, , 380-700 um de diâmetro). No passo seguinte, a agarose líquida em DPBS é introduzida nos canais cilíndricos ou nos tubos capilares. (Ii) Após os géis de agarose, a agulha é removida eO molde é desmontado para produzir as microcolunas de agarose vazias. (Iii) Essas construções são então esterilizadas e armazenadas em DPBS. ( B ) Cultura do neurônio primário e o método agregado: (i) A agregação neuronal é realizada em arrays de micro-poços piramidais, moldados a partir de moldes impressos em 3D, que se encaixam nos poços de uma placa de cultura de 12 poços. (Ii) Micro-TENNs incluem neurônios de ratos primários dissociados de cérebros fetais de ratos embrionários dia 18. Após a dissociação do tecido com tripsina-EDTA e DNase I, prepara-se uma solução celular com uma densidade de 1,0-2,0 x 10 6 células / mL. (Iii) 12 μL desta solução são transferidos para cada poço na matriz de micro-poços piramidais. A placa que contém esses micro-poços é centrifugada para produzir agregados celulares. (Iv) Estes são então incubados durante a noite antes do chapeamento nas micro colunas. ( C ) Fabricação de núcleos de ECM e semeadura de células: (i) Antes da semeadura de células, uma solução de ECM contendo 1 mg / mL de colágeno de tipo I e 1 mg / mLA laminina é transferida para o interior dos microTENNs e é permitida a polimerização. (Ii) Dependendo se os micro-TENNs unidireccionais ou bidireccionais estão sendo fabricados, um agregado é colocado em um ou ambos os extremos da micro-coluna, respectivamente. (Iii) Após um período de incubação para promover a adesão, os microTENNs são cultivados em placas de Petri inundadas com meio basal neuronal embrionário suplementado. (Iv) Após 3-5 dias em cultura, a estrutura micro-TENN final deve demonstrar agregados celulares nos extremos da micro-coluna, com traços axonais abrangendo seu comprimento. Clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
A lesão e a doença do SNC geralmente resultam na perda ou disfunção das vias axonais de longa distância que compõem o conector do cérebro, com ou sem degeneração neuronal concomitante. Isso é agravado pela capacidade limitada do SNC para promover neurogênese e regeneração. Apesar da busca de estratégias de reparo, como o fator de crescimento, a célula e a entrega do biomaterial como abordagens individuais ou combinatoriais, essas técnicas não respondem simultaneamente tanto à degeneração das células…
Declarações
The authors have nothing to disclose.
Acknowledgements
O apoio financeiro foi fornecido pelos Institutos Nacionais de Saúde U01-NS094340 (Cullen), T32-NS043126 (Harris) e F31-NS090746 (Katiyar)), a Fundação Michael J. Fox (Programa de Pipeline Terapêutico # 9998 (Cullen)), O Prêmio Piloto do Centro de Neurociências da Penn Medicine (Cullen), a National Science Foundation (Bolsas de Pesquisa de Pós-Graduação DGE-1321851 (Struzyna e Adeghtle)), o Departamento de Assuntos de Veteranos (Revisão do mérito de RR & D # B1097-I (Cullen)), a Associação Americana De Cirurgiões Neurológicos e Congresso de Cirurgiões Neurológicos (2015-2016 Codman Fellowship in Neurotrauma and Critical Care (Petrov)) e o US Army Medical Research and Materiel Command (# W81XWH-13-207004 (Cullen) e W81XWH-15-1- 0466 (Cullen)).
Materials
| Laser cutter | Universal Laser Systems | PLS4.75 | Used to fabricate the laser-cut micro-channel mold. |
| Laser-cut micro-column fabrication device | Custom-made | ————– | Contact our research group if interested. Dimensions and blueprints provided in the manuscript. |
| Screws | ————– | ————– | #4-40 with a thread diameter of 3.05 mm |
| Nuts | ————– | ————– | #4-40 with a thread diameter of 3.05 mm |
| Acupuncture needle (180 µm diameter) | Lhasa Medical | sj.16X40 | The diameter may be varied according to the desired size for the micro-column lumen. |
| Petri dish | Fisher | 08772B | |
| Dulbecco's phosphate buffered saline (DPBS) | Invitrogen | 14200075 | |
| Polystyrene disposable serological pipet | Fisher | 13-678-11D | |
| Agarose | Sigma | A9539-50G | |
| Capillary tube (398 µm diameter) | Fisher | 21170D | The diameter may be varied according to the desired size for the micro-column shell. |
| Hot plate | Fisher | SP88857200 | |
| Magnetic bar | Fisher | 1451352 | |
| Micropipette | Sigma | Z683884-1EA | |
| 25 mm gauge needle | Fisher | 14-826-49 | |
| Microscalpel | Roboz Surgical | RS-6270 | |
| Scissors | Fine Science Tools | 14081-09 | |
| Forceps | World Precision Instruments | 501985 | |
| Hot bead sterilizer | Sigma | Z378550-1EA | |
| Stereoscope | Nikon | SMZ800N | Used for all dissection steps and for micro-TENN fabrication. |
| Rat tail type I collagen | Corning | 354236 | Maintain at 4 ºC and remove only when needed. Use ice to preserve its temperature when in use. |
| Microcentrifuge tube | Fisher | 02-681-256 | |
| Mouse laminin | Corning | 354232 | Maintain at 4 ºC and remove only when needed. Use ice to preserve its temperature when in use. |
| Neurobasal medium | Invitrogen | 21103049 | Basal medium for the culture of pre-natal and embryonic neuronal cells. Store at 4ºC and warm at 37 ºC before use. |
| Sodium hydroxide (NaOH) | Fisher | SS2661 | |
| Hydrochloric acid (HCl) | Fisher | SA48-1 | |
| Litmus paper | Fisher | 09-876-18 | |
| Hank's balanced salt solution (HBSS) | Invitrogen | 14170112 | Store at 4 ºC. |
| 0.25% Trypsin-EDTA | Invitrogen | 25200056 | Store at -20 ºC and warm at 37 ºC before use. |
| Bovine pancreatic deoxyribonuclease (DNase) I | Sigma | 10104159001 | Store at -20 ºC and warm at 37 ºC before use. |
| B-27 Supplement | Invitrogen | 12587010 | Supplement added to Neurobasal medium for the culture of hippocampal and cortical neurons. Store at -20 ºC and warm at 37 ºC before use. |
| L-glutamine | Invitrogen | 35050061 | Store at -20 ºC and warm at 37 ºC before use. |
| Sprague Dawley embryonic day 18 rats | Charles River | Strain 001 | |
| Pasteur pipette | Fisher | 22-042816 | |
| 15 mL centrifuge tube | EMESCO | 1194-352099 | |
| Vortex | Fisher | 02-215-414 | |
| Centrifuge | Fisher | 05-413-115 | |
| Hemocytometer | Fisher | 02-671-6 | |
| Objet30 3D-Printer | Stratasys | ————– | Used to fabricate the pyramidal micro-well molds. |
| 3D-printed pyramidal well mold | Custom-made | ————– | Contact our research group if interested. Dimensions and blueprints provided in the manuscript. |
| Polydimethylsiloxane (PDMS) and curing agent | Fisher | NC9285739 | Comes as kit with elastomer and curing agent. Use inside a chemical fume hood. |
| Funnel | Fisher | 10-348C | |
| 1 ml pipette bulb | Sigma | Z509035 | |
| Micro-spatula | Fisher | S50821 | |
| 12-well culture plate | EMESCO | 1194-353043 | |
| Oven | Fisher | 11-475-154 | |
| Incubator | Fisher | 13 998 076 | |
| AAV1.Syn.GCaMP6f.WPRE.SV40 | UPenn Vector Core | 36373 | Store at -80ºC. Commercially available adeno-associated virus (AAV) with the GCaMP6f calcium indicator. |
| Formaldehyde 40% | Fisher | F77P-4 | Formaldehyde is a toxic compound known to be carcinogenic, and must be disposed of in a separate container. |
| Triton X-100 | Sigma | T8787 | Non-ionic surfactant used to permeabilize cell membranes. |
| Horse serum | Gibco | 16050-122 | |
| Mouse anti-Tuj-1/beta-III tubulin primary antibody | Sigma | T8578-200UL | Store at -20ºC. |
| Rabbit anti-synapsin 1 primary antibody | Synaptic Systems | 106-001 | Store at -20ºC. |
| Donkey anti-mouse 568 secondary antibody | Invitrogen | A10037 | Store at 4ºC. |
| Donkey anti-rabbit 488 secondary antibody | Invitrogen | A21206 | Store at 4ºC. |
| Hoechst 33342, Trihydrochloride | Invitrogen | H3570 | Store at 4ºC. Hoechst is a known mutagen that should be treated as a carcinogen. Therefore, it must be disposed of in a separate container. |
| A1RSI Laser Scanning Confocal Microscope | Nikon | ————– | Used for taking the confocal reconstructions of immunolabeled constructs. |
| Eclipse Ti-S Microscope | Nikon | ————– | Used for taking the phase-contrast images. With digital image acquisition using a QiClick camera interfaced with Nikon Elements Basic Research software (4.10.01). |
| High-speed Fluorescence Microscope | Nikon | ————– | Nikon Eclipse Ti microscope paired with an ANDOR Neo/Zyla camera for calcium imaging. |
| NIS Elements AR 4.50.00 Software | Nikon Instruments | ————– | Used to identify calcium transients from the recordings taken with the high-speed fluorescence microscope. |
Referências
- Struzyna, L. A., Harris, J. P., Katiyar, K. S., Chen, H. I., Cullen, D. K. Restoring nervous system structure and function using tissue engineered living scaffolds. Neural Regen. Res. 10 (5), 679-685 (2015).
- Tallantyre, E. C., Bø, L., et al. Clinico-pathological evidence that axonal loss underlies disability in progressive multiple sclerosis. Mult. Scler. 16 (4), 406-411 (2010).
- Cheng, H. C., Ulane, C. M., Burke, R. E. Clinical Progression in Parkinson Disease and the Neurobiology of Axons. Ann. Neurol. 67 (6), 715-725 (2010).
- Johnson, V. E., Stewart, W., Smith, D. H. Axonal pathology in traumatic brain injury. Exp. Neurol. 246, 35-43 (2013).
- Hinman, J. D. The back and forth of axonal injury and repair after stroke. Curr. Opin. Neurol. 27 (6), 615-623 (2014).
- Li, X., Katsanevakis, E., Liu, X., Zhang, N., Wen, X. Engineering neural stem cell fates with hydrogel design for central nervous system regeneration. Prog. Polym. Sci. 37 (8), 1105-1129 (2012).
- Horner, P. J., Gage, F. H. Regenerating the damaged central nervous system. Nature. 407 (6807), 963-970 (2000).
- Yiu, G., He, Z. Glial inhibition of CNS axon regeneration. Nat. Rev. Neurosci. 7 (8), 617-627 (2006).
- Montani, L., Petrinovic, M. M. Targeting Axonal Regeneration: The Growth Cone Takes the Lead. J. Neurosci. 34 (13), 4443-4444 (2014).
- Struzyna, L. A., Wolf, J. A., et al. Rebuilding Brain Circuitry with Living Micro-Tissue Engineered Neural Networks. Tissue Eng. Part A. 21 (21-22), 2744-2756 (2015).
- Huebner, E. a., Strittmatter, S. M. Axon Regeneration in the Peripheral and Central Nervous Systems. Results Probl. Cell Differ. 48, 339-351 (2009).
- Benowitz, L. I., Yin, Y. Combinatorial Treatments for Promoting Axon Regeneration in the CNS: Strategies for Overcoming Inhibitory Signals and Activating Neurons’ Intrinsic Growth State. Dev. Neurobiol. 67 (9), 1148-1165 (2007).
- Lie, D. C., Song, H., Colamarino, S. A., Ming, G., Gage, F. H. Neurogenesis in the Adult Brain: New Strategies for Central Nervous System Diseases. Annu. Rev. Pharmacol. Toxicol. 44, 399-421 (2004).
- Gao, Y., Yang, Z., Li, X. Regeneration strategies after the adult mammalian central nervous system injury-biomaterials. Regen. Biomater. 3 (2), 115-122 (2016).
- Benfey, M., Aguayo, A. J. Extensive elongation of axons from rat brain into peripheral nerve grafts. Nature. 296 (11), 150-152 (1982).
- David, S., Aguayo, A. J. Axonal Elongation into Peripheral Nervous System “Bridges” after Central Nervous System Injury in Adult Rats. Science. 214 (4523), 931-933 (1981).
- Shoichet, M. S., Tate, C. C., Baumann, M. D., LaPlaca, M. C. Strategies for Regeneration and Repair in the Injured Central Nervous System. Indwelling Neural Implant. Strateg. Contend. with Vivo Environ. , (2008).
- Lu, P., Tuszynski, M. H. Growth factors and combinatorial therapies for CNS regeneration. Exp. Neurol. 209 (2), 313-320 (2008).
- Curinga, G., Smith, G. M. Molecular/genetic manipulation of extrinsic axon guidance factors for CNS repair and regeneration. Exp. Neurol. 209 (2), 333-342 (2008).
- Mehta, S. T., Luo, X., Park, K. K., Bixby, J. L., Lemmon, V. P. Hyperactivated Stat3 boosts axon regeneration in the CNS. Exp. Neurol. 280, 115-120 (2016).
- Elliott Donaghue, I., Tam, R., Sefton, M. V., Shoichet, M. S. Cell and biomolecule delivery for tissue repair and regeneration in the central nervous system. J. Control. Release. 190, 219-227 (2014).
- Tam, R. Y., Fuehrmann, T., Mitrousis, N., Shoichet, M. S. Regenerative therapies for central nervous system diseases: a biomaterials approach. Neuropsychopharmacology. 39 (1), 169-188 (2014).
- Cullen, D. K., Wolf, J. A., Smith, D. H., Pfister, B. J. Neural Tissue Engineering for Neuroregeneration and Biohybridized Interface Microsystems In vivo (Part 2). Crit. Rev. Biomed. Eng. 39 (3), 243-262 (2011).
- Han, Q., Jin, W., et al. The promotion of neural regeneration in an extreme rat spinal cord injury model using a collagen scaffold containing a collagen binding neuroprotective protein and an EGFR neutralizing antibody. Biomaterials. 31 (35), 9212-9220 (2010).
- Suzuki, H., Kanchiku, T., et al. Artificial collagen-filament scaffold promotes axon regeneration and long tract reconstruction in a rat model of spinal cord transection. Med. Mol. Morphol. 48 (4), 214-224 (2015).
- Silva, N. A., Salgado, A. J., et al. Development and Characterization of a Novel Hybrid Tissue Engineering-Based Scaffold for Spinal Cord Injury Repair. Tissue Eng. Part A. 16 (1), 45-54 (2009).
- Moore, M. J., Friedman, J. A., et al. Multiple-channel scaffolds to promote spinal cord axon regeneration. Biomaterials. 27 (3), 419-429 (2006).
- Tsai, E. C., Dalton, P. D., Shoichet, M. S., Tator, C. H. Synthetic hydrogel guidance channels facilitate regeneration of adult rat brainstem motor axons after complete spinal cord transection. J. Neurotrauma. 21 (6), 789-804 (2004).
- Chen, B. K., Knight, A. M., et al. Axon regeneration through scaffold into distal spinal cord after transection. J. Neurotrauma. 26 (10), 1759-1771 (2009).
- Jain, A., Kim, Y. -. T., McKeon, R. J., Bellamkonda, R. V. In situ gelling hydrogels for conformal repair of spinal cord defects, and local delivery of BDNF after spinal cord injury. Biomaterials. 27 (3), 497-504 (2006).
- Harris, J. P., Struzyna, L. A., Murphy, P. L., Adewole, D. O., Kuo, E., Cullen, D. K. Advanced biomaterial strategies to transplant preformed micro-tissue engineered neural networks into the brain. J. Neural Eng. 13 (1), 16019-16037 (2016).
- Cullen, D. K., Tang-Schomer, M. D., et al. Microtissue engineered constructs with living axons for targeted nervous system reconstruction. Tissue Eng. Part A. 18 (21-22), 2280-2289 (2012).
- Tate, M. C., Shear, D. A., Hoffman, S. W., Stein, D. G., Archer, D. R., LaPlaca, M. C. Fibronectin promotes survival and migration of primary neural stem cells transplanted into the traumatically injured mouse brain. Cell Transplant. 11 (3), 283-295 (2002).
- Denham, M., Parish, C. L., et al. Neurons derived from human embryonic stem cells extend long-distance axonal projections through growth along host white matter tracts after intra-cerebral transplantation. Front. Cell. Neurosci. 6 (11), (2012).
- Fawcett, J. W., Barker, R. A., Dunnet, S. B. Dopaminergic neuronal survival and the effects of bFGF in explant, three dimensional and monolayer cultures of embryonic rat ventral mesencephalon. Exp. Brain Res. 106 (2), 275-282 (1995).
- Mine, Y., Tatarishvili, J., Oki, K., Monni, E., Kokaia, Z., Lindvall, O. Grafted human neural stem cells enhance several steps of endogenous neurogenesis and improve behavioral recovery after middle cerebral artery occlusion in rats. Neurobiol. Dis. 52, 191-203 (2013).
- Ren, H., Chen, J., Wang, Y., Zhang, S., Zhang, B. Intracerebral neural stem cell transplantation improved the auditory of mice with presbycusis. Int. J. Clin. Exp. Pathol. 6 (2), 230-241 (2013).
- Sinclair, S. R., Fawcett, J. W., Dunnett, S. B. Dopamine cells in nigral grafts differentiate prior to implantation. Eur. J. Neurosci. 11 (12), 4341-4348 (1999).
- Tate, C. C., Shear, D. A., Stein, D. G., Tate, M., LaPlaca, M. C., Archer, D. R. Laminin and fibronectin scaffolds enhance neural stem cell transplantation into the injured brain. J. Tissue Eng. Regen. Med. 3 (3), 208-217 (2009).
- Yoo, S. J., Kim, J., Lee, C. -. S., Nam, Y. Simple and novel three dimensional neuronal cell culture using a micro mesh scaffold. Exp. Neurobiol. 20 (2), 110-115 (2011).
- Chen, H. I., Jgamadze, D., Serruya, M. D., Cullen, D. K., Wolf, J. A., Smith, D. H. Neural Substrate Expansion for the Restoration of Brain Function. Front. Syst. Neurosci. 10, (2016).
- Cullen, D. K., Wolf, J. A., Vernekar, V. N., Vukasinovic, J., LaPlaca, M. C. Neural tissue engineering and biohybridized microsystems for neurobiological investigation in vitro (Part 1). Crit. Rev. Biomed. Eng. 39 (3), 201-240 (2011).
- Struzyna, L. A., Katiyar, K., Cullen, D. K. Living scaffolds for neuroregeneration. Curr. Opin. Solid State Mater. Sci. 18 (6), 308-318 (2014).
- Ungrin, M. D., Joshi, C., Nica, A., Bauwens, C., Zandstra, P. W. Reproducible, ultra high-throughput formation of multicellular organization from single cell suspension-derived human embryonic stem cell aggregates. PLoS One. 3 (2), (2008).
- Dahotre, N. B., Harimkar, S. . Laser fabrication and machining of materials. , (2008).
- Kutter, J. P., Klank, H., Snakenborg, D. Microstructure fabrication with a CO2 laser system. J. Micromechanics Microengineering. 14 (2), (2004).
- Spicar-Mihalic, P., Houghtaling, J., Fu, E., Yager, P., Liang, T., Toley, B. CO2 laser cutting and ablative etching for the fabrication of paper-based devices. J. Micromechanics Microengineering. 23 (6), (2013).
- Pacifici, M., Peruzzi, F. Isolation and culture of rat embryonic neural cells: a quick protocol. J. Vis. Exp. (63), (2012).
- Cullen, D. K., Gilroy, M. E., Irons, H. R., Laplaca, M. C. Synapse-to-neuron ratio is inversely related to neuronal density in mature neuronal cultures. Brain Res. 1359, 44-55 (2010).
- Huang, J. H., Cullen, D. K., et al. Long-Term Survival and Integration of Transplanted Engineered Nervous Tissue Constructs Promotes Peripheral Nerve Regeneration. Tissue Eng. Part A. 15 (7), 1677-1685 (2009).
- Katiyar, K. S., Winter, C. C., Struzyna, L., Harris, J. P., Cullen, D. K. Mechanical elongation of astrocyte processes to create living scaffolds for nervous system regeneration. J. Tissue Eng. Regan. Med. , (2016).
- Howard, M. A., Baraban, S. C. Synaptic integration of transplanted interneuron progenitor cells into native cortical networks. J. Neurophysiol. 116 (2), 472-478 (2016).
- Wernig, M., Benninger, F., et al. Functional Integration of Embryonic Stem Cell-Derived Neurons In Vivo. J. Neurosci. 24 (22), 5258-5268 (2004).
- Ganguly, K., Poo, M. Activity-dependent neural plasticity from bench to bedside. Neuron. 80 (3), 729-741 (2013).
- Dancause, N. Extensive Cortical Rewiring after Brain Injury. J. Neurosci. 25 (44), 10167-10179 (2005).
- Winter, C. C., Katiyar, K. S., et al. Transplantable living scaffolds comprised of micro-tissue engineered aligned astrocyte networks to facilitate central nervous system regeneration. Acta Biomater. 38, 44-58 (2016).
- Adewole, D. O., Serruya, M. D., et al. The Evolution of Neuroprosthetic Interfaces. Crit. Rev. Biomed. Eng. 44 (1-2), 123-152 (2016).
- Cullen, D. K., Patel, A., Doorish, J. F., Smith, D. H., Pfister, B. J. Developing a tissue-engineered neural-electrical relay using encapsulated neuronal constructs on conducting polymer fibers. J. Neural Eng. 5 (4), 374-384 (2008).
- Cullen, D. K., Stabenfeldt, S. E., Simon, C. M., Tate, C. C., LaPlaca, M. C. In Vitro Neural Injury Model for Optimization of Tissue-Engineered Constructs. J. Neurosci. Res. 85, 3642-3651 (2007).
- Irons, H. R., Cullen, D. K., Shapiro, N. P., Lambert, N. A., Lee, R. H., Laplaca, M. C. Three-dimensional neural constructs: a novel platform for neurophysiological investigation. J. Neural Eng. 5 (3), 333-341 (2008).
- Morrison, B. I., Cullen, D. K., LaPlaca, M. In Vitro Models for Biomechanical Studies of Neural Tissues. Stud. Mechanobiol. Tissue Eng. Biomater. 3, 247-285 (2011).
- Vukasinovic, J., Cullen, D. K., Laplaca, M. C., Glezer, A. A microperfused incubator for tissue mimetic 3D cultures. Biomed. Microdevices. 11 (6), 1155-1165 (2009).
- Cullen, D. K., Lessing, M. C., Laplaca, M. C. Collagen-dependent neurite outgrowth and response to dynamic deformation in three-dimensional neuronal cultures. Ann. Biomed. Eng. 35 (5), 835-846 (2007).
- LaPlaca, M. C., Vernekar, V. N., Shoemaker, J. T., Cullen, D. K. Three-dimensional neuronal cultures. Methods Bioeng. 3D Tissue Eng. , (2010).
- Chwalek, K., Tang-Schomer, M. D., Omenetto, F. G., Kaplan, D. L. In vitro bioengineered model of cortical brain. Nat. Protoc. 10 (9), 1362-1373 (2015).

